Az étkezés és a hipotalamusz változásai a viselkedési-variáns frontotemporális demenciában
Olivier Piguet
1 Neuroscience Research Australia, Sydney, Ausztrália
2 Orvostudományi Egyetem, Új-Dél-Wales Egyetem, Sydney, Ausztrália
Åsa Petersén
3 Transzlációs Neuroendokrin Kutatóegység, Kísérleti Orvostudományi Tanszék, Lund Egyetem, Lund, Svédország
Bonnie Yin Ka Lam
1 Neuroscience Research Australia, Sydney, Ausztrália
2 Orvostudományi Egyetem, Új-Dél-Wales Egyetem, Sydney, Ausztrália
Sanaz Gabery
3 Transzlációs Neuroendokrin Kutatóegység, Kísérleti Orvostudományi Tanszék, Lund Egyetem, Lund, Svédország
Karen Murphy
1 Neuroscience Research Australia, Sydney, Ausztrália
2 Orvostudományi Egyetem, Új-Dél-Wales Egyetem, Sydney, Ausztrália
John R Hodges
1 Neuroscience Research Australia, Sydney, Ausztrália
2 Orvostudományi Iskola, Új-Dél-Wales Egyetem, Sydney, Ausztrália
Glenda M Halliday
1 Neuroscience Research Australia, Sydney, Ausztrália
2 Orvostudományi Egyetem, Új-Dél-Wales Egyetem, Sydney, Ausztrália
Társított adatok
Absztrakt
Célkitűzés
A viselkedési-variáns frontotemporális dementia (bvFTD) egy progresszív neurodegeneratív agyi rendellenesség, amelyet klinikailag a megismerés, a személyiség és a viselkedés változásai jellemeznek. Az étkezési viselkedés jelentős zavarairól, például a túlevésről és az édes ételek kedveléséről is gyakran beszámolnak. A hipotalamusz kritikus szerepet játszik az etetés szabályozásában, ennek ellenére a régió patológiája és az FTD étkezési viselkedése közötti kapcsolat nem ismert. A tanulmány célja ennek a kérdésnek a kezelése két egymást kiegészítő megközelítés alkalmazásával.
Mód
Először 18 korai stádiumú bvFTD beteg és 16 egészséges kontroll szenvedett nagy felbontású strukturális mágneses rezonancia képalkotást és értékelte az étkezési magatartást. A hipotalamusz térfogatait manuálisan követtük a koronális képeken. Másodszor, 12 bvFTD eset és 6 egyeztetett kontroll postmortem elemzését végeztük. Rögzített hipotalamusz szöveti metszeteket festettünk egy sejt markerre és az etetési magatartást szabályozó peptidekre immunhisztokémia alkalmazásával. Sztereológiai becsléseket végeztünk a hipotalamusz térfogatáról, valamint az idegsejtek és a glia számáról.
Eredmények
A bvFTD-ben a hipotalamusz jelentős atrófiája mindkét elemzésben jelen volt. A magas táplálkozási zavarban szenvedő betegeknél a hátsó hipotalamusz jelentős atrófiáját mutatta. A neuronveszteség, amelyet csak bvFTD esetekben figyeltek meg Tar DNS-protein-43 lerakódással, szintén utólag volt domináns. Ezzel szemben az orexint (hipokretin), az Y neuropeptidet, a kokaint és az amfetamint szabályozó transzkriptumot és az étvágyat szabályozó vazopresszint tartalmazó idegsejteket kímélték a takarmányszabályozásban részt vevő hátsó magokban.
Értelmezés
A hipotalamuszon belüli degeneráció és következményes diszreguláció a bvFTD jelentős táplálkozási zavarához kapcsolódik. Ezek az eredmények alapot nyújtanak a terápiás modellek kidolgozásához. Ann Neurol 2011
A frontotemporális dementia (FTD) progresszív neurodegeneratív agyi rendellenesség. Ez a demencia második leggyakoribb oka, és ugyanolyan gyakori, mint az Alzheimer-kór fiatal, fiatal demenciában szenvedő egyéneknél. 1 A bemutatott klinikai tünetek alapján az FTD három fő klinikai fenotípusát ismerik el: viselkedési variáns FTD (bvFTD), szemantikus demencia és progresszív nonfluent afázia. 2 Mindegyik prezentációt az agy atrófiájának sajátos mintázata jellemzi, amely a frontális és az elülső temporális lebenyben koncentrálódik, bár az átfedés a betegség progressziójával járó prezentáció során történik. Neuropatológiailag a frontotemporális lebeny-degeneráció (FTLD) legtöbb esetben intracitoplazmatikus fehérje-lerakódást mutatnak vagy a mikrotubulusokkal társított foszfoprotein tau (FTLD-tau), vagy a TAR-DNS-kötő fehérje 43 (FTLD-TDP). A 3 - 6 klinikai bemutatás azonban továbbra is tökéletlen előrejelzője a mögöttes neuropatológiának.
A viselkedési variáns az FTD leggyakoribb fenotípusa, amely az összes FTD eset 50% -át teszi ki. Jellemzői a személyes, a társadalmi és az interperszonális magatartás változásai, a korai érzelmi tompulás és az éleslátás elvesztése. 2 Rendellenes étkezési magatartás (pl. Fokozott táplálékfogyasztás, az étkezési preferenciák változása) 7 az esetek 60% -ában van jelen a bemutatáskor, de a betegség folyamán> 80% -ot érint. 8 A súlygyarapodás gyakori, bár a betegek hajlamosak arra, hogy ne váljanak kórosan elhízottvá, ami az anyagcsere szabályozásának változásaira utal. A táplálkozási zavarok biológiai okai az FTD-ben még mindig kevéssé ismertek.
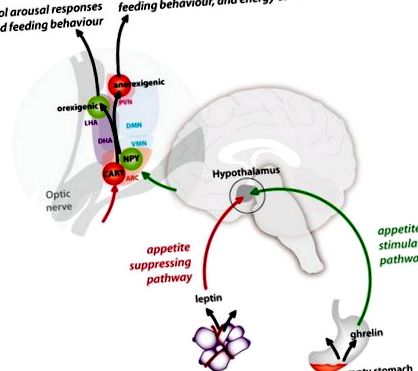
A periféria és a hipotalamusz közötti étvágygerjesztõ (zöld) és étvágycsökkentõ (piros) útvonalak, valamint a hipotalamusz magjain belüli kapcsolataik ábrázolása. PVN = paraventrikuláris mag; LHA = laterális hipotalamusz területe; DMN = dorsomedialis mag; DHA = háti hipotalamusz területe; VMN = ventromediális mag; NPY = Y neuropeptid; CART = kokain- és amfetamin-szabályozott átirat; ARC = íves mag.
Tantárgyak és módszerek
Kohortok
ASZTAL 1
A neurofelvétel és a postmortem kohortok klinikai jellemzői (átlag ± szórás)
Az étkezési magatartás jellemzése
Az étkezési viselkedésben bekövetkezett változásokat a Cambridge Behavioral Inventory (CBI) 15 segítségével határozták meg a neuro képalkotó csoportban. Ez a gondozói kérdőív számos magatartási jellemző jelenlétét és súlyosságát (gyakoriságát) határozza meg egy 5 pontos skálán, 0-tól (soha) és 4-ig (folyamatosan). Összetett étkezési zavar pontszámot a releváns CBI tételek pontszámainak összegzésével származtattunk.
Idegképalkotás és az érdeklődési kör elemzése
Valamennyi résztvevőn átesett az agy strukturális mágneses rezonancia képalkotása (MRI). Nagy felbontású (voxel méret: 1 × 1 × 1 mm) T1 képszekvenciát nyertünk a hipotalamusz morfometriai elemzésének elvégzésére. Egy második szekvenciát (kettős T2 kép) gyűjtöttünk az intrakraniális térfogat mérésére, hogy korrigáljuk az egyének közötti fejméret-különbségeket (lásd a Kiegészítő információkat a képalkotó szekvencia részleteihez). A hipotalamust kézzel definiáltuk a T1 képeken a koronális síkban, jól meghatározott határok felhasználásával. 16 A szerkezeti összetettség és a funkcionális specifitás miatt a kapott hipotalamusz térfogatot 2 egyenlő térfogatra osztottuk fel az elülső-hátsó tengelyben (a nyomkövetési protokoll részletes leírását lásd a Kiegészítő információkban és az 1. kiegészítő ábrát). Az alapképzést független, 5 esetből álló csoporton végezték. A hipotalamusz térfogatának magas szintű nyomon követhetőségét sikerült elérni (osztályon belüli korreláció = 0,964). Az elülső és a hátsó hipotalamusz térfogatát az intrakraniális térfogat arányában fejeztük ki, hogy korrigáljuk az agy méretének egyéni és nemi különbségeit.
A halál utáni szövetek előkészítése
Korábbi vizsgálataink nem mutattak ki aszimmetriát a hipotalamusz sejtkomponenseiben. 17, 18 Mint ilyen, a bal vagy a jobb hipotalamusz koronaszöveti blokkjait minden esetben boncolták a mérésekhez. A bal/jobb hipotalamusz aszimmetria hiányát ebben a mintában minden volumetrikus mérésnél és sejtszámnál megerősítették (minden p érték> 0,30). Mindegyik szövetblokkot szacharóz-oldatban krioprotektáljuk 3-5 napig, majd 50 μm-nél sorozatosan metszetezzük egy kriosztáton. Minden 15. szakaszt (750 μm távolságra) zselatinizált tárgylemezekre szereltünk, és 0,5% -os vizes krezil-ibolyával és 0,1% Luxol gyorskékkel festettük a sejtek mennyiségi meghatározásához és a rosttraktus felismeréséhez. Hat másik, véletlenszerűen kiválasztott szekció-sorozatot immunhisztokémiailag festettünk tau, TDP-43, NPY, orexin, CART és vazopresszin elleni antitestekkel (Kiegészítő táblázat).
Regionális és sejtanalízis
Mindegyik tárgylemezen a hipotalamust manuálisan követtük, a neuroimaging protokollban meghatározott hasonló regionális határok alkalmazásával. Az elülső és a hátsó régiókat felosztották, ahol a paraventricularis mag és a fornix vízszintesen igazodtak. Az 50 μm vastag Nissl-festett soros szakaszokban az optikai frakcionáló módszert alkalmaztuk az idegsejtek sejtmaggal és gliasejtekkel történő számolására. 19 Minden mérést vakkódolt tárgylemezeken végeztünk.
Statisztikai elemzések
Az idegképalkotó csoportban a bvFTD és az egészséges kontroll közötti különbségeket vizsgálták a hypothalamus térfogatában, paraméteres független mintatesztekkel. A bvFTD csoporton belül a hipotalamusi térfogatok és az étkezési zavar közötti összefüggéseket vizsgálták a magas és alacsony pontszámú hipotalamusi térfogatok szembeállításával az étkezési viselkedés összetett pontszámával, mivel a pontszámok eloszlása bimodális volt. Az etetésről 1 bvFTD beteg esetében nem állt rendelkezésre információ. A postmortem kohorszban, a kis mintanagyság miatt, a csoportok közötti különbségeket nem paraméteres statisztikákkal teszteltük: vagy Mann-Whitney-teszt 2 csoportnál, vagy Kruskal-Wallis-teszt 3 csoportnál, majd post hoc Mann-Whitney-tesztek követték az alcsoportok közötti különbségek meghatározását.
Eredmények
Étkezési zavarok az FTD-ben
Az étkezési zavar jellemzői, mint például a megnövekedett étvágy, az édes ételek kedvelése és az ugyanazon ételek fogyasztására való fokozott hajlam, csak a bvFTD csoportban voltak jelen, és az egészséges kontrollokban nem figyelték meg őket (lásd az 1. táblázat táblázatot). 1). A bvFTD csoporton belül 10 beteget, akiknél a leggyakoribb és legsúlyosabb jellemzők mutatkoztak, magas étkezési zavarok csoportjába csoportosítottuk (a medián megosztottság határozta meg). A 2 bvFTD alcsoport nem különbözött a nemi megoszlás, az életkor, a betegség időtartama, valamint az MMSE vagy az ACE-R pontszám tekintetében.
Kapcsolatok a hipotalamusi változásokkal in vivo
Összességében elmondható, hogy a bvFTD-betegek kisebb hipotalamusi térfogattal rendelkeztek, mint a kontrollok (2. ábra (2. ábra), 2. ábra), az atrófia a legszembetűnőbb (15% -kal csökkent, 2. ábra). 2). Noha a nemi megoszlás különbsége a beteg és a kontroll csoport között megközelítette a szignifikanciát, nem találtunk statisztikai különbséget a nem hipotalamusi térfogatra gyakorolt hatásában (minden p érték> 0,10).
Kóros változások a hipotalamuszban az FTLD-ben
Az FTLD-tau-ban szenvedő betegeknél a fehérje lerakódása kórosabb volt a hipotalamuszban, mint az FTLD-TDP-ben szenvedőknél. Az FTLD-TDP-ben ritka TDP-immunreaktív neuriteket figyeltek meg, esetenként intracitoplazmatikus zárványokkal a hátsó hipotalamusz neuronokban (beillesztve a 3. ábrán). 3). FTLD-tau-ban szenvedő betegeknél tau-immunreaktív idegsejteket és neuriteket figyeltek meg a hipotalamusz egész területén, esetenként Pick test zárványokkal (lásd a 3. ábra 3. részét).
Az étvágystimulációban részt vevő hátsó hipotalamusz régiók (dorsomedial [DM] és lateral hypothalamus [LH] magok) összehasonlítása kontrollok és frontotemporális lobar degeneráció (FTLD) esetekben tau vagy TAR-DNS-kötő fehérje (TDP) patológiával neuronveszteséget tár fel az FTLD-TDP-ben mindkét kontrollhoz és az FTLD-tau-hoz (1. sor) képest Nissl-festett szakaszokban (0,5% vizes krezilibolya [CV] és 0,1% Luxol gyorskék [LFB]). A betétek szemléltetik a tau (2. oszlop) és a TDP-43 (3. oszlop) immunopozitív zárvány patológiáját, amelyet ezekben a régiókban észleltünk. A kokain- és amfetamin-szabályozó transzkriptummal (CART, 2. és 4. sor) és az orexinnel (3. és 5. sor) végzett immunoperoxidáz-festés nem mutat nyilvánvaló különbséget ezeket a neuropeptideket tartalmazó idegsejtek sűrűségében vagy morfológiájában a DM csoportokban (2. és 2. sor). 3) vagy az LH (4. és 5. sor).
Összehasonlítás az in vivo változásokkal és az etetési szabályozásba bevont központok értékelése
Az íves mag (Arc) összehasonlítása a kontrollok és a frontotemporális lebeny degeneráció (FTLD) között tau vagy TAR-DNS-kötő fehérje (TDP) patológiával. A Nissl festés (0,5% vizes krezilibolya [CV] és 0,1% Luxol gyorskék) nem mutat észrevehető különbségeket az Arc idegsejt sűrűségében (1. sor). Az étvágycsökkentő neuronok kokain- és amfetamin-szabályozó transzkriptumának (CART, 2. sor) immunoperoxidáz-festése és az étvágygerjesztő idegsejteken belül az Y neuropeptid (NPY, 3. sor) nem mutat észrevehető degenerációt ezen idegsejteken. Hasonlóképpen nem voltak nyilvánvaló különbségek a vazopresszin és a CART festésében a periventrikuláris magban (PVN) a csoportok között.
2. TÁBLÁZAT
Hipotalamusi térfogatok, neuron- és gliaszám az FTLD-TDP, az FTLD-Tau és az egészséges kontrollokban (átlag ± szórás)
Vita
Korábbi strukturális idegképalkotó vizsgálatok rámutattak arra, hogy az orbitofrontalis-insular-striatalis agyhálózatban bekövetkező zavarok alapozzák az étkezési zavarok megjelenését az FTD-ben. 20 - 22 Meglepő módon, a hipotalamusz, amely kritikus szerepet játszik az etetés szabályozásában és szabályozza az anyagcsere-szükségleteink szempontjából központi funkciókat (testhőmérséklet, vízháztartás, alvási ciklus), nem érintett. A hipotalamusz változásainak észlelése a korábbi vizsgálatokban szinte biztosan módszertani volt. Itt az érdeklődésre számot tartó régió azonosítását alkalmaztuk koponyán belüli korrekcióval, ellentétben a korábbi munkákkal, amelyek voxel-alapú morfometriát (VBM) alkalmaztak, egy automatizált módszert, amely a csoportok közötti különbségeket vizsgálja az egyes voxelek szintjén. Bár a teljes agyi hatások vizsgálata a priori hipotézisek nélkül hatékony, a VBM hajlamos az artefaktusokra, különösen azoknál a populációknál, amelyek jelentős kortikális atrófiával rendelkeznek, mint az FTD esetében, és kisebb erővel rendelkezik a kis agyi struktúrák változásainak észlelésében. 23
Fontos, hogy a hipotalamusz atrófia jelenlétét az FTD-ben egy másik kohorszban igazolták, eltérő módszertan alkalmazásával. A postmortem szöveti vizsgálatok azt mutatták, hogy az atrófia mintázata, a hátsó, mint az elülső hipotalamusz régió markánsabb változásával, megegyezik az MRI-n jelentettel. A két vizsgálat közötti atrófia súlyossága azonban különbözött; atrophia a postmortem kohortban legalább kétszer akkora volt, mint az MRI kohortban. Az idegképalkotó csoportban a hipotalamusz méréseit a diagnózistól számított 2 éven belül végezték el, míg a postmortem szöveteken a betegség átlagosan 9-10 évig tartó időtartama után végeztek méréseket. Ez a megállapítás azt sugallja, hogy bár a betegség korai jellemzője, a hipotalamusz atrófiája a betegség folyamata alatt folyamatos folyamat, nem pedig csak a betegség kezdeti szakaszára korlátozódik. Érdekes módon a hipotalamusz atrófiájának helye viszonylag konzisztens és a betegség folyamán hátul összpontosul.
A bvFTD klinikai megjelenésének hátterében álló befogadási patológiák változóak és továbbra is nehezen megjósolhatók az életben, mivel a klinikai esetek egyenletesen oszlanak el a tau- és a TDP-pozitív zárványok között. 24, 25 Postmortem elemzéseink azonban kimutatták, hogy a hipotalamusz atrófia sokkal súlyosabb volt a TDP-pozitív zárványú esetekben, mint a tau-pozitív zárványokkal. Ezt az atrófiát jelentős idegsejtvesztés kísérte csak a TDP csoportban, és olyan magokban koncentrálódott, amelyekről ismert, hogy szabályozzák az etetési viselkedést. 26, 27 Az FTLD-TDP és nem az FTLD-tau hipotalamusz táplálkozási viselkedésének szelektív változásainak további bizonyítékai egy nemrégiben készült biomarker tanulmányból származnak, amely csak az FTLD-TDP esetekben mutatja a cerebrospinalis folyadék AGRP növekedését. 28 Bár az étkezési magatartásról egyik posztmortem kohorszban sem álltak rendelkezésre információk, ezek az eredmények, valamint a neuro-képalkotási eredmények azt sugallják, hogy az FTD étkezési zavarai valószínűleg a TDP jelenlétét tükrözik, nem pedig a tau patológiát. Ezen vizsgálatok megerősítéséhez további vizsgálatokra van szükség.
Annak ellenére, hogy az FTLD-TDP csoportban a hipotalamuszban jelentős a hátsó sejtvesztés, az etetési viselkedést szabályozó magokban nem volt látható orexint vagy CART-ot tartalmazó idegsejtek vesztesége. A nonpeptiderg idegsejtek elvesztése ezekben a hátsó hipotalamusz magokban a belső gátló szabályozás elvesztésére utalhat, ami ezen peptiderg utak túlműködéséhez és az ebből következő táplálkozási zavarokhoz vezet a bvFTD-ben. A dorsomedialis hipotalamusz mag hasonló megszakadását az LH-ban lévő orexin neuronok hiperaktivitásával összefüggésben javasolták a mértéktelen táplálkozás hátterében figyelemhiányos/hiperaktivitási rendellenességben. 29 A patológiára jellemző neuronveszteség kombinációja a táplálkozás szabályozásában szerepet játszó peptideket tartalmazó neuronok megőrzésével jelentős klinikai következményekkel járhat, mivel célzott terápiás beavatkozásokat fejlesztenek ki.
Összefoglalva: ez a tanulmány az első, amely összekapcsolja a hipotalamusz atrófiáját és patológiáját a bvFTD étkezési zavarával. Viselkedésképpen a magas étkezési zavarban szenvedő betegek jelentős atrófiát mutattak a hátsó hipotalamuszban. A postmortem vizsgálatokkal kombinálva eredményeink azt mutatják, hogy ez az étkezési zavar összefügg a neuronok veszteségével ebben a régióban, és nagyobb a TDP-43 patológiában szenvedő betegeknél. Egy nemrégiben készült tanulmány 28 alátámasztja azt a nézetet, hogy a hipotalamusz változásai az FTLD-TDP-re jellemzőnek tűnnek. További vizsgálatokra van szükség annak tisztázásához, hogy más agyrégiók milyen mértékben járulnak hozzá az étkezési zavarhoz az FTLD-ben. Összességében a jelen tanulmány azt mutatja, hogy a hipotalamuszon belüli degeneráció és következményes diszreguláció a bvFTD-ben bekövetkezett jelentős táplálkozási zavarhoz kapcsolódik, alapot szolgáltatva e klinikai jellemző terápiás modelljeinek kidolgozásához.
Potenciális összeférhetetlenség
O.P. és J.R.H. az ausztrál Nemzeti Egészségügyi és Orvosi Kutatási Tanácstól függő támogatásokkal rendelkezik.
Köszönetnyilvánítás
Ezt a projektet a Nemzeti Egészségügyi és Orvosi Kutatási Tanács (NHMRC) projekt támogatása (# 510106) támogatta. Az agyszöveteket a Sydney Brain Bank-ból nyertük, amelyet az ausztrál NHMRC, az Új-Dél-Wales-i Egyetem és az ausztrál Neuroscience Research támogat. Az O.P.-t egy NHMRC Klinikai Karrierfejlesztési Díj ösztöndíj (# 510184) támogatja. G.M.H. az NHMRC vezető tudományos munkatársa (# 630434). J.R.H. az ausztrál kutatási tanács szövetségi ösztöndíja (# FF0776229) támogatja. Az ÅP-t a Svéd Kutatási Tanács és a Scania tartomány támogatásai támogatják.
Köszönetet mondunk a tanulmány résztvevőinek, a Sydney Brain Bank munkatársainak és Dr. J. Krilnek az elemzett postmortem esetek összegyűjtéséért és jellemzéséért, Dr. M. Kuharnak a CART antitest adományozásáért és H. Cartwrightért az ábraért. munka.
- Rengeteg almát, bogyót és teát fogyasztó demencia, amely alacsonyabb kockázattal jár
- Az evési sebesség változásának hatása az elhízásra cukorbetegségben szenvedő betegeknél
- Extrém egészséges táplálkozás magyarázata, Molly Kimball, regisztrált dietetikus Moxie - Elme
- Diéta, amely magában foglalja a zsírevágást, szénhidrát csökkentését és a csillaggal jelölt válaszok végének elkerülését
- Fogyókúrás trendek 2017 Hogyan befolyásolja a népszerű 801010 étkezési terv a fogyást, a vércukrot