Az étrend modulálja a vakbél bakteriális sokféleségét és a fiziológiai fenotípusokat a BXD egér genetikai referenciapopulációjában
Maria Elisa Perez-Munoz
1 Patológia Tanszék, John Hopkins Egyetem Orvostudományi Kar, Baltimore, Maryland, Amerikai Egyesült Államok
2 Mezőgazdasági, Élelmiszer- és táplálkozástudományi tanszék, Alberta Egyetem, Edmonton, Alberta, Kanada
M. McKnite ősz
3 Állattudományi Tanszék, Nebraskai Egyetem, Lincoln, Nebraska, Amerikai Egyesült Államok
Evan G. Williams
4 Integratív Rendszerfiziológiai Laboratórium, Ecole Polytechnique Fédérale de Lausanne, Svájc
Johan Auwerx
4 Integratív Rendszerélettani Laboratórium, Ecole Polytechnique Fédérale de Lausanne, Svájc
Robert W. Williams
5 Genetikai, Genomikai és Informatikai Tanszék, University of Tennessee Egészségtudományi Központ, Memphis, Tennessee, Amerikai Egyesült Államok
Daniel A. Peterson
1 Patológiai Klinika, John Hopkins Egyetem Orvostudományi Kar, Baltimore, Maryland, Amerikai Egyesült Államok
Daniel C. Ciobanu
3 Állattudományi Tanszék, Nebraskai Egyetem, Lincoln, Nebraska, Amerikai Egyesült Államok
Társított adatok
A szekvenciaadatok elérhetők az NCBI Sequence Read Archive (SRA) BioProject PRJNA557049 szám alatt. A máj metabolitjainak adatkészlete elérhető a GeneNetwork.org adatbázisban (EPFL/LISP BXD Liver Polar Metabolites CD/HFD, június 14).
Absztrakt
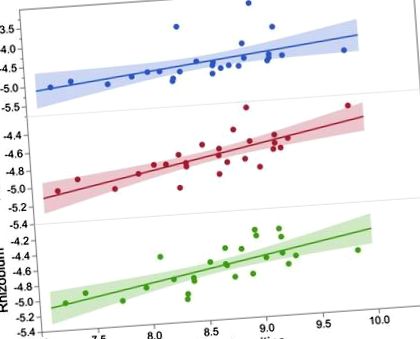
HFD esetén szignifikáns összefüggéseket (P ≤ 0,0001) figyeltek meg a taxonómiai egységek és a máj metabolitjai között a phylában, Firmicutes, Bacteroidetes és Proteobacteriumokban. Például a Firmicutes mennyisége negatívan összefügg a troxerutin szintjével (r = -0,70), amely flavonoid ismert potenciális antioxidáns tulajdonságokkal. A Lactococcus, a Firmicutes tagja, összefüggésben állt a krotonoil-CoA szintjével (r = 0,72), amely számos metabolikus út fontos összetevője, beleértve a zsírsavcserét is. Negatív összefüggéseket figyeltünk meg a Parabacteroides, a Bacteroidetes nemzetség és a molibdopterin-AMP (r = -0,73), valamint a pozitív kapcsolatok (r = 0,72) és a karbamoil-foszfát között. Végül, a Biophila, a Proteobacteria nemzetség, társult a p-krezol-glükuroniddal (r = 0,71), amely metabolit anaerob bélbaktériumok által végzett tirozin biotranszformáció eredményeként jött létre.
Beszélgetések
Ez a tanulmány további bizonyítékokat szolgáltat a metabolikus szindrómához kapcsolódó tulajdonságok fontos fenotípusos és genetikai variációiról a két legfontosabb egérgenetikai vonalban, a C57BL/6J és DBA/2J, valamint a hozzájuk kapcsolódó BXD RI erőforrás populációban. A HFD bemutatása rögzítette a különbségeket a BXD szülői vonalak és az F1 hibridek között, amelyeket a kontroll CD nem látott. Pontosabban, a DBA/2J és F1 hibridek, amelyek a DBA/2J gátakból származnak, több testzsírt halmoztak fel, mint a C57BL/6J és F1 hibridek, amelyek a C57BL/6J gátakból születtek, amikor HFD-nek voltak kitéve, ami nagyobb elhízásra való hajlamot mutat a DBA/2J-ben.
Azt is megállapítottuk, hogy a BXD szülői törzsek egyedi vakbél mikrobiális profilokkal rendelkeznek. A törzs szintjén, míg mindkét törzset a Firmicutes uralta, a C57BL/6J-t a nagyobb változatosság jellemzi, amely jelentősen hozzájárul a többi fő phylához, az Actinobacteriumokhoz és a Bacteroidetes-ekhez. Míg a szülői törzsek mikrobiális profiljának néhány különbsége potenciálisan összetéveszthető az anyai ketrec hatásával, az összes C57BL/6J minta csoportosulása, amelyet 3 különböző alom generált ugyanabban a filogenetikai csoportban, a gazda genetikájának szerepét sugallja a vakbél mikrobiális profiljának modulációjában. (2A. És 2B. Ábra). Ezenkívül a HFD BXD-be történő bevezetése környezeti szuppresszorként szolgált, növelve a cecalis sIgA szintet, csökkentve a vakbél mikrobiota sokféleségét, megzavarva a gazda genetika szerepét a bél mikrobiota összetételében, és kihatva a bél mikrobiota és a máj kapcsolatára is. metabolitok.
Az IgA a mikrobiális kórokozókkal szembeni adaptív immunválasz fontos alkotóeleme, és befolyásolhatja a bél mikrobiális flórájának összetételét [15]. Egy nemrégiben készült jelentés azt találta, hogy az egerek rövid távú HFD-expozíciója (2 hét) növelte a Firmicutes mennyiségét és befolyásolta a gyulladásgátló gén expressziós profilt, növelve a gazdaszervezet hajlamát a Listeria monocytogenes fertőzésre [17].
A cecum microbiota variációjához való gazda genetikai hozzájárulásának potenciális bizonyítékát CD-n mutatták be az Oscillibacter/Oscillospira (Chr 3-hoz feltérképezve) és a Bifidobacterium/Bifidobacterium pseudolongum (Chr 6-hoz feltérképezve) esetében. A HFD bevezetése a BXD-be környezeti szuppresszorként szolgált ezeknek a QTL-eknek, valószínűleg ezen nemzetségek BXD vakbélben való hozzájárulásának csökkenése miatt. A QTL-effektusokhoz kapcsolódó potenciális gének közé tartozik a Pde7a (Chr 3) és a Txnrd3 (Chr 6). A Pde7a-hoz kapcsolódó ontológiák magukban foglalják a fémion-kötést. Az esszenciális fémionok kritikus fontosságúak a mikrobiális fajok fontos sejtes folyamataiban [18]. A Pde7a és az ismert gének modulokban/útvonalakban történő ko-expressziós elemzése két béltranszkriptóma adatkészlet (> GSE59054 és> GSE6065, n> 80) alapján a Genebridge (www.systems-genetics.org/) segítségével feltárta a Pde7a társított szerepét bél immunhálózattal az IgA termeléséhez (Score> 840; KEGG 04672). Figyelembe véve a Pde7a javasolt szerepét az Oscillospira arányának modulálásában, feltételeztük, hogy szignifikáns kapcsolat van e faj és az sIgA között. A várakozásoknak megfelelően az sIgA szintje korrelált az Oscillospirával a CD-ben (r = -0,41, P 0,14), megerősítve a Pde7a javasolt szerepét a bél IgA-termeléssel társult expressziós hálózatokban.
A Txnrd3, a Bifidobacterium pseudolongum (Bifidobacterium) QTL-jéhez kapcsolódó potenciális jelölt gén, a szelenociszteint tartalmazó fehérjék (szelenoproteinek) családjának tagja, amely fontos szerepet játszik a redox homeosztázisban [19]. A Txnrd3 expressziója csökkent volt az egér RAW264.7 makrofág sejtvonalában lipopoliszacharid (LPS) kezelést követően [20]. A szelénkezelés megmentette a Txnrd3 expresszióját és csökkentette az LPS-hez kapcsolódó immunológiai stresszt. Az étrendi szelénbevitel befolyásolja a gazda szelenoproteinek expresszióját, de a bél mikrobiota sokféleségét is [21]. A bél mikrobiota kivonja az étrendből a szelént. Korlátozott szelénbevitel esetén verseny alakulhat ki a mikrobiota és a gazda között. Ez az állapot a szelenoproteinek expressziójának csökkenéséhez és az antioxidatív aktivitáshoz vezethet [22]. A bifidobaktériumok képesek felhalmozni és biotranszformálni a szervetlen szelént, szerves szelénforrást biztosítva a gazdának.
A cecalis sIgA általános növekedése a HFD-ben nem volt összefüggésben a máj metabolitjainak változásával. Mindazonáltal negatív kapcsolatot figyeltünk meg CD-n az sIgA szintje és a szfingolipid anyagcserével összefüggő vegyület, a galaktozil-szfingozin (r = -0,73) között. A szfingolipidek fontos tényezők az sIgA válaszok modulálásában [26]. Az étkezési palmitinsav szfingolipidekké metabolizálódik, mint például a szfingozin (szintén a galaktozil-szfingozin szubsztrátja), amely felszívódik a bélszövetbe, és ezt követően szfingozin-1-foszfáttá metabolizálódik, amelyről ismert, hogy modulálja a sejtcsempészetet és az orális antigénekre adott sIgA válaszokat.
Összefoglalva, ennek a tanulmánynak az eredményei bemutatják a környezeti/étrendi manipuláció fontos szerepét a gazda genetikája, az immunológiai paraméterek és a gyomor-bélrendszer mikrobiota közötti kölcsönhatásokban, valamint azok hatását a metabolitokra, amelyek az egészségi állapot indikátoraként szolgálhatnak. Ezeknek a finom kapcsolatoknak a mély megértése nyújthat olyan ismereteket, amelyek segíthetnek az anyagcsere-rendellenességek ok-okozati forrásainak dekonstrukciójában.
Anyagok és metódusok
C57BL/6J, DBA/2J és kölcsönös F1 étrendi kísérlet
A cecal microbiome kiindulási sokféleségének meghatározása céljából a BXD szülői törzsekben cecum mintákat gyűjtöttünk naiv férfiaktól és nőktől C57BL/6J és DBA/2J-ből, átlagos életkoruk 11 hét volt. A kísérleti egerek három (C57BL/6J, n = 7, átlagos életkor 72 d) és négy (DBA/2J, n = 6, átlagéletkor 87 d) alomból származnak. Az egereket specifikus kórokozóktól mentes környezetben, 20–24 ° C-on tartottuk, 14/10 órás világos/sötét ciklus mellett, ad libitum hozzáféréssel a vízhez és az élelemhez a Tennessee Egyetem Egészségügyi Tudományos Központjában (UTHSC). A hím és nőstény alomtársakat külön ketrecekben helyezték el. Az egereket normál chow-étrendnek vetették alá (CD, Harlan Teklan 22/5; 17% kalória zsírból, 54% kalória szénhidrátból, 29% kalória fehérjéből). Valamennyi állatot az NIH laboratóriumi állatok gondozására és felhasználására vonatkozó útmutatójának és az UTHSC Intézményi Állatgondozási és Felhasználási Bizottságának (IACUC) előírásainak megfelelően tartották. Az UTHSC IACUC-ja kifejezetten jóváhagyta a vizsgálatot (680. engedély).
A magas zsírtartalmú étrend (HFD) testtömegre és testösszetételre gyakorolt hatását úgy vizsgáltuk, hogy a C57BL/6J, DBA/2J és a kölcsönös F1 hibrideket két diétás kezelésnek vetettük alá 8 héten át, 5 hetes kortól kezdve. Ebben a kísérletben 4–8 hím egeret/törzset/étrendet alkalmaztak, vagy normál chow étrendnek (CD, Harlan 7001; 13% kalória zsírból, 53% kalória szénhidrátból, 34% kalória fehérjéből) vagy magas zsírtartalmú étrendnek (HFD)., Harlan TD.06415; 45% kalória zsírból, 36% kalória szénhidrátból, 19% kalória fehérjéből). Az egereket egy specifikus kórokozótól mentes környezetben, 20–24 ° C-on tartottuk, 14/10 órás világos/sötét ciklus mellett, és ad libitum hozzáféréssel a vízhez és az élelemhez a Nebraska-Lincolni Egyetemen (UNL). Az egyéni súlyt és a ketrecben lévő táplálékfelvételt hetente rögzítették az 5. és a 12. hét között. A testösszetételt, beleértve a csont ásványi sűrűségét, a sovány és zsírszövet arányát, 12. héten rögzítettük 4-5 egér/törzs/diéta alkalmazásával PIXImus DEXA alkalmazásával. Ezt a vizsgálatot az UNL IACUC hagyta jóvá (422. számú engedély).
BXD diétás kísérlet
Cecumot gyűjtöttünk 29 hetes 32 BXD-törzs hímtől, akiket két étrend, CD és HFD-nek tettek ki, beleértve az egyes étrendekhez tartozó 3-5 állatot/törzset. A CD-diétában 30 BXD törzs volt jelen (Harlan 2018; 18% kalória zsírból, 58% kalória szénhidrátból, 24% kalória fehérjéből), míg 29 BXD törzs képviseltette magát a HFD étrendben (Harlan 06414; 60% zsír kalória, 21% kalória szénhidrátból, 18% kalória fehérjéből). A HFD-t 8 héttől kezdve vezettük be a HFD kohorszba, és a 29. héten tartott szövetgyűjtésig tartottuk. Az egyes BXD törzseket és étrendet képviselő egereket ugyanabban a ketrecben helyeztük el a 23. hétig, majd ezt követően egyedi tartást végeztük, amíg a szövetek összegyűjtésre kerültek a 29. héten egy éjszakai böjt után.
Az eutanáziát izoflurán érzéstelenítéssel hajtottuk végre, amelyet a vena cava teljes vérvételével és foszfáttal pufferolt sóoldattal történő perfúzióval végeztünk, Williams és mtsai. (2016) leírása szerint. A vakbélt, beleértve a vakbéltartalmat, és a májszöveteket folyékony nitrogénben lefagyasztották, majd -80 ° C-on tárolták mRNS, fehérje, metabolit analízis és mikrobiota (vakbéltartalom esetén) céljából. A kutatási protokollokat a svájci kantoni állat-egészségügyi hatóságok (2257.0 és 2257.1 engedélyek) hagyták jóvá.
A máj metabolitprofiljait repülés közbeni tömegspektrometriával (ToF-MS) nyertük egy Agilent 6550 QTOF-en negatív üzemmódban, 4 GHz-en, 50–1000 Da közötti jellemzők szkennelésére Fuhrer és mtsai. (2011) [27].
979 egyedi metabolit tulajdonságot azonosítottak. Ezek közül 699-et egy specifikus metabolithoz térképeztek fel a Human Metabolome Database (HMDB) annotációi alapján, míg a fennmaradó 280-at több lehetséges enantiomerre térképezték fel, az alábbiak szerint [1]. Az adatkészlet a GeneNetwork.org adatbázisban érhető el (EPFL/LISP BXD Liver Polar Metabolites CD/HFD, június 14.).
A cecum-specifikus mikrobiális DNS következő generációs szekvenálása
Cecum szekréciós immunglobulin A (sIgA) ELISA
Statisztikai analízis
Az étrendi kezelések BXD szülői vonalak, C57BL/6J és DBA/2J, valamint ezek kölcsönös F1 hibridjeinek testtömegére és testzsír% -ára gyakorolt hatását lineáris kevert modell segítségével tesztelték a JMP Pro 13.1-ben, törzs, étrend és törzs x étrend alkalmazásával. rögzített effektek és ketrec véletlenszerű.
A normális eloszlású mikrobiom adatok normalitásának elérése érdekében az értékeket log 10 transzformációnak vetettük alá. Két csoport összehasonlításához (CD-HFD összehasonlítás) a Student t tesztjeit Welch korrekciójával hajtották végre, míg Kruskal-Wallis teszteket, majd Dunn többszörös összehasonlítását alkalmazták több mint két csoport (törzsminták) összehasonlítására. A statisztikai elemzéseket a Graph Pad Prism 7-es verziójával (GraphPad Software, La Jolla, Kalifornia, USA) és az R statisztikai szoftver 3.3.1-es verziójával (https://www.r-project.org/) végeztük.
Az azonos szülői törzseket képviselő férfiak és nők (C57BL/6J és DBA/2J) nem közös anyai ketrecekből származnak, és a törzsen belül a nem nem volt teljes mértékben képviselve több ketrecben. A zavaró hatások miatt a nemet és az anyai ketrecet kortárs csoport (CG) hatásként kombinálták lineáris modellben (törzs rögzített hatás és törzsbe ágyazott CG).
Az étrendnek a BXD vakbél mikrobiális profiljára gyakorolt hatását lineáris keverék modell alkalmazásával is teszteltük, a diétát fix hatásként és a törzsgenetikát véletlenszerűen alkalmazva. Az életkor és az áldozat sorrendjének hatását kovariátorként tesztelték, és a többszörös teszteléshez igazítva nem volt szignifikáns.
A cecum baktérium-összetétel phyla és nemzetség szintjén, a fentiek szerint, és a máj metabolitjainak fenotípusos összefüggéseit Spearman rang korrelációkkal becsültük meg.
QTL leképezés
A QTL-térképezés a 3 785 polimorf DNS-marker regresszióján alapult a megcélzott fenotípusokon, QTL Reaper alkalmazásával, a korábban leírtak szerint [10]. Az alkalmazott fenotípusok közé tartozik az sIgA szint és az egyes mikrobiota taxonok átlagos aránya. A normalitás elérése érdekében a taxonómiai bőséget log 10 transzformációnak vetették alá, a fentiek szerint. A marker genotípusokat -1, 0 és +1 kódokkal jelöltük a C57BL/6J, a heterozigóta és a DBA/2J genotípusok meghatározásához. Az esélyek (LOD) logaritmusának küszöbértéke a genom egészére kiterjedő szignifikáns QTL esetén (P (3,4 M, tiff)
- Az étrend modulálja a vakbél bakteriális sokféleségét és a fiziológiai fenotípusokat a BXD egérgenetikában
- Diéta; Fitnesz - Farmakogenomika - DNS-teszt UK - Genetikai tesztelés UK
- Kövér homokegér - tények, étrend, élőhely; Képek
- A nyugati étrend krónikus fogyasztása erőteljes gliaaktivációt vált ki az öregedő egerekben és egy egérben
- Genetikai tesztelés az ideális étrendhez