Az étrendi szelénhiány okozta hasnyálmirigy-atrófia hipoinsulinémiás hiperglikémiát vált ki a szelenoproteint kódoló gének globális lefelé történő szabályozásával a brojlerekben
Jingyang Xu
1 Állattáplálkozási Intézet, Szecsuán Mezőgazdasági Egyetem, Csengdu, Szecsuán, Kína
Longqiong Wang
1 Állattáplálkozási Intézet, Szecsuán Mezőgazdasági Egyetem, Csengdu, Szecsuán, Kína
Jiayong Tang
1 Állattáplálkozási Intézet, Szecsuán Mezőgazdasági Egyetem, Csengdu, Szecsuán, Kína
2 nyomelem kutatóközpont, Szecsuán Mezőgazdasági Egyetem, Csengdu, Szecsuán, Kína
Gang Jia
1 Állattáplálkozási Intézet, Szecsuán Mezőgazdasági Egyetem, Csengdu, Szecsuán, Kína
2 nyomelem kutatóközpont, Szecsuán Mezőgazdasági Egyetem, Csengdu, Szecsuán, Kína
Guangmang Liu
1 Állattáplálkozási Intézet, Szecsuán Mezőgazdasági Egyetem, Csengdu, Szecsuán, Kína
Xiaoling Chen
1 Állattáplálkozási Intézet, Szecsuán Mezőgazdasági Egyetem, Csengdu, Szecsuán, Kína
Jingyi Cai
1 Állattáplálkozási Intézet, Szecsuán Mezőgazdasági Egyetem, Csengdu, Szecsuán, Kína
Haiying Shang
1 Állattáplálkozási Intézet, Szecsuán Mezőgazdasági Egyetem, Csengdu, Szecsuán, Kína
Hua Zhao
1 Állattáplálkozási Intézet, Szecsuán Mezőgazdasági Egyetem, Csengdu, Szecsuán, Kína
2 nyomelem kutatóközpont, Szecsuán Mezőgazdasági Egyetem, Csengdu, Szecsuán, Kína
Társított adatok
Minden releváns adat megtalálható a dokumentumban és a kiegészítő információkat tartalmazó fájlokban.
Absztrakt
Anyagok és metódusok
Brojlerek és diéták
Mintagyűjtés és előkészítés
A kísérlet végén a madarakat nyolc órán át éheztettük, majd csoportonként hat, átlagos testtömegű madarat (1,19 ± 0,09 kg Se-hiánycsoportban és 1,38 ± 0,08 kg-ot a kontrollcsoportban) kiválasztottunk és feláldoztunk a vér összegyűjtésére, máj-, mellizom- és hasnyálmirigy-minták. Jéghideg felületen történő azonnali boncolás után a szerveket jéghideg, steril ioncserélt vízzel mossuk, és a műtéti olló segítségével alikvotákra osztjuk. A szövetmintákat folyékony nitrogénben gyorsfagyasztottuk, és felhasználásig -80 ° C-on tároltuk. A hasnyálmirigy-minták egy részét 10% -os pufferolt formaldehidben rögzítettük a kóros megfigyeléshez egyidejűleg. A plazmamintákat a teljes vér centrifugálásával készítettük (nátrium-etilén-diamin-tetraecetsav (EDTA) antikoagulánsként, 2000 × g 15 percig, 5804R centrifuga, F45-30-11 rotor, Eppendorf) és -80 ° C-on tároltuk.
Kóros megfigyelések
Az exudatív diatézist a durva megjelenés alapján azonosították, és boncolással megerősítették [33, 34]. A hisztopatológia céljából a hasnyálmirigy-mintákat paraffinviaszba ágyazták, 5 μm-es vékony szeletekre vágták, tárgylemezekre szerelték és hematoxilinnal és eozinnal (H&E) festették a hagyományos szövettani módszerek szerint. A szövettani metszeteket megvizsgáltuk és lefényképeztük Nikon (TS100) fénymikroszkóppal, és rögzítettük a hasnyálmirigy patológiás változásait.
Biokémiai vizsgálatok
A takarmányban és a szövetekben a szelénkoncentrációt a hibrid generációs atomi fluoreszcencia spektrométerrel (AFS-3200, Titan eszköz) mértük a standard Se referencia [GBW (E) 08044, National Research Center for Certified Reference Materials, Peking, Kína] alkalmazásával. A plazma glükóz, inzulin, teljes triglicerid (TG), összkoleszterin (TC), interleukin 6 (IL-6) és tumor nekrózis faktor-α (TNF-α) koncentrációkat a megfelelő vizsgálati készlet alkalmazásával (Jiancheng Bioengineering, Nanjing, Kína) mértük. a gyártó utasításai szerint. A szövetmintákat (kb. 0,5 g) jégen felolvasztottuk, jéghideg izotóniás sóoldatban (0,9% NaCl) kilencszeres homogenizálást végeztünk Ultra-Turrax homogenizátor alkalmazásával 7000 × g-n 15 másodpercig, centrifugáltuk 1000 x g-vel 10 percig 4 ° C-on. ° C. Ezután a felülúszót összegyűjtöttük a későbbi biokémiai elemzés céljából.
A teljes antioxidáns képességet (T-AOC), a malondialdehidet (MDA), a szuperoxid-diszmutáz (SOD) és a glutation-peroxidáz (GSH-Px) aktivitását megfelelő vizsgálati készletekkel (Jiancheng Bioengineering, Nanjing, Kína) mértük. A fehérje koncentrációját bicinchonininsav (BCA) módszerrel határoztuk meg egy kereskedelmi forgalomban lévő BCA fehérje assay kit (Jiancheng Bioengineering, Nanjing, Kína) alkalmazásával. Az optikai sűrűség (OD) értékeit ultraibolyán látható spektrofotométerrel mértük (Model 680, Bio-rad, Hercules, CA, USA). Minden egyes méréshez az összehasonlított mintákat ugyanazon a lemezen futtattuk, hogy kiküszöböljük a különböző lemezekből származó potenciális hibákat.
Az mRNS-bőség Q-PCR elemzése
A huszonhárom szelenoproteint kódoló gén, a tizenhét inzulinjelzéssel kapcsolatos gén és két referenciagén: a β-aktin (Actb) és a glicerinaldehid-3-foszfát-dehidrogenáz (Gapdh) primereit (S2 táblázat) a Primer Express 3.0 (Applied Biosystems, Foster City, Kalifornia). Az RNS extrakciót, a minőségellenőrzést, a valós idejű kvantitatív PCR eljárást és a relatív mRNS bőség kvantifikálást a korábbi vizsgálatokban leírtak szerint végeztük [10, 35, 36], azzal a különbséggel, hogy a hasnyálmirigy teljes RNS-ét RNeasy Tissue Mini Kit (Takara) segítségével extraháltuk, Dalian, Kína). A qPCR-eket az ABI 7900HT rendszeren (Applied Biosystems, Foster City, CA) végeztük 10 μl végtérfogatban Qiagen egylépéses RT-PCR kit (Qiagen, Duesseldorf, Németország) felhasználásával, mindegyik mintában 100 ng teljes RNS-t alkalmazott. Olvadásgörbe és ciklusküszöb elemzéseket végeztünk az amplifikáció specifitásának megerősítésére. A relatív mRNS-bőség kvantifikációja megegyezett a csoportunk által korábban leírt 2 -ΔΔCt módszerrel [35, 36]. Egy adott szövet minden célgénjéhez az összes mintát ugyanazon a 384 lyukú lemezen futtattuk (Applied Biosystems, Foster City, CA).
Statisztikai analízis
Független t-tesztet (SPSS for Windows 13.0; Chicago, IL, USA) alkalmaztunk az étrendi Se-hiány biokémiai alkotórészekre, enzimaktivitásokra és az egyes gének mRNS-szintjeinek vizsgálatára egy adott szövetben. Az adatokat átlag ± SE-ként adjuk meg, és a szignifikancia szintet P ≤ 0,05-ben állítottuk be, hacsak másképp nem jelezzük.
Eredmények
Növekedési teljesítmény és Se-hiánytünetek
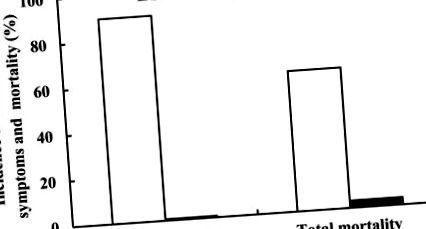
Az étrendi Se-hiány csökkentette a brojlerek növekedési teljesítményét (1. ábra). A Se-megfelelő kontroll csoporthoz (0,3 mg Se/kg) képest az étrendi Se-hiány csökkent (P 1. táblázat, míg a hiány és a mortalitás kumulatív adatai (%) a 2. ábrán láthatók. A Se-hiány-tünetek először a negyedik héten jelentek meg és a hiánytüneteket mutató madarak 90% -ából (2. ábra) 40%, azaz huszonnégy madár tüneteket mutatott a negyedik héten, míg a többi 50% az ötödik héten (1. táblázat). A Se-hiány szintén először a negyedik héten jelentkezett, és a teljes 61,7% -os mortalitásból (2. ábra) 23,3%, azaz tizennégy madár pusztult el a negyedik héten, míg a többi 38,3% -uk az ötödik héten pusztult el (1. táblázat).
A Se-hiánytünetek előfordulására és a madarak kumulatív/teljes elhullására vonatkozó adatokat százalékban fejezzük ki.
Asztal 1
| Hét | A Se-hiányos tünetekkel rendelkező madarak száma | |
| 1., 2. és 3. sz | 0 | 0 |
| Negyedik | 24. | 0 |
| 5. | 30 | 0 |
| Elpusztult madarak száma | ||
| 1. és 2. sz | 0 | 0 |
| 3. | 0 | 1 |
| Negyedik | 14 | 0 |
| 5. | 23 | 1 |
Kóros elváltozások
Bruttó morfometria (A) és hisztopatológiai nézet: kontrollcsoport (B) és Se-hiányos csoport (C).
A szövet Se koncentrációja, a plazma biokémiai tulajdonságai és a gyulladásos citokin mérések
A kontroll csoporthoz képest az étrendi Se-hiány szignifikánsan csökkent (P 2. táblázat). Az étrendi Se-hiány emelkedett (P 2. táblázat). A Se-hiány csökkenést eredményezett (P 2. táblázat). Hasonlóképpen, az étrendi Se-hiány is negatív hatást gyakorolt a plazma gyulladásos citokinekre. A Se-hiányos táplálékkal táplált madarak IL-6 és TNF-α plazmakoncentrációja 40,4% -kal és 23,4% -kal nőtt (P 2. táblázat).
2. táblázat
| Plazma Se (μmol/L) | 0,63 ± 0,09 | 3,08 ± 0,15 | 3. táblázat A kontroll csoporthoz képest az étrendi Se-hiány csökkent (P 4. ábra). Az első minta az volt, hogy az étrendi Se-hiány csökkent (P 4A ábra), tizennégy gén (Gpx2, Gpx3, Dio1, Dio3, Txnrd1, Selk, Seli, Selm, Selo, Sels, Selt, Sepn1, Sepp1 és Selx) az izomban (ábra 4B), és tizennyolc gént (Gpx2, Gpx3, Gpx4, Txnrd1, Txnrd3, Seli, Selk, Selm, Selo, Sels, Selu, Selt, Sep15, Sepn1, Sepp1, Sepw1, Selx és Sephs2) a hasnyálmirigyben (4C ábra). A második mintázat magasabb volt (P 4A ábra) Se hiányos étrenddel. Harmadszor, az étrendi Se-hiány nem befolyásolta a szelenoproteint kódoló gének expresszióját a három szövetben. Az egyes gének specifikus expressziós szintje egy adott szövetben és jelentősége (P 4. ábra . |
Az étrendi Se-hiány hatása az inzulinjelzéssel kapcsolatos gének relatív mRNS-szintjére a csirkék májában (A), izomában (B) és hasnyálmirigyében (C) összehasonlítva azokkal, akiket a kontroll étrendet etettek az ötödik héten. Az adatokat átlag ± SE (n = 6) formájában adjuk meg. A csillagok eltérnek a kontrolltól: * P 1. ábra ) és indukált Se-hiányos tünetek (S1 ábra), beleértve az exudatív diatezist (S2 ábra) és a hasnyálmirigy elváltozásait csirkében ( 3. ábra ). Az ilyen klasszikus Se-hiány-tünetek összhangban voltak a csirkével táplált Se-hiányos aminosav-diétával végzett korábbi vizsgálatokkal [21, 33, 34,37]. A jelenlegi vizsgálattal ellentétben egy nemrégiben készített jelentésben a csirkével táplált Se-hiányos étrend volt (2. táblázat ) és csökkentette a plazma GSH-Px aktivitását ( 3. táblázat ) brojlereknél, ami hasonló volt a rágcsálóknál [14], a sertéseknél [10, 35] és a csirkéknél [38, 39, 42]. Az étrendi Se-hiány (2. táblázat) nem mutatott semmilyen hatást az éhomi plazma glükóz- és inzulinkoncentrációra sertések [10, 35] és patkánygátak [9] modelljeiben. A szelén részt vesz az állatok szénhidrát- és lipidanyagcseréjében [11, 14], és a magas Se-expozíció a plazma lipidszintjének emelkedésével jár [11]. Jelen tanulmányban az étrendi Se-hiány által kiváltott hasnyálmirigy-atrófiát hipoinsulinémiás hiperglikémiával társították, és a csirkének is alacsonyabb a plazma TG- és TC-koncentrációja ( 2. táblázat ). Ezért a Se-hiány és a felesleg eltérő hatással volt a szénhidrát- és lipid-anyagcserére.
Következtetések
Ez a tanulmány azt jelzi, hogy az étrendi Se-hiány elnyomja a brojlerek növekedési teljesítményét, klasszikus Se-hiánybetegséget, táplálkozási hasnyálmirigy-atrófiát indukál és csökkenti az antioxidáns aktivitást. Az étrendi Se-hiány globálisan csökkenti a szelenoproteint kódoló- és inzulinszignál-kapcsolódó gének expresszióját a hasnyálmirigyben, a májban és az izomban, ami diszlipidémiát, hipoinsulinémiát és hiperglikémiát eredményez csirkében. A globális változások valószínűleg a Se-hiány, valamint a Se-hiány önmagában okozta hasnyálmirigy-atrófiához kapcsolódnak. Eredményeink azt mutatják, hogy az étrendi Se fontos szerepet játszik az inzulin működésének fenntartásában a szelenoproteint kódoló gének szabályozásán keresztül a megfelelő szövetekben.
- A kobalamin anyai táplálékhiányával összefüggő gyermekek neurológiai károsodása -
- A bőr és az étrend Az étrendi változás szerepének frissítése a bőrbetegség kezelési stratégiájaként
- A magas zsírtartalmú étrend utáni etetés elhízást és korai pubertást vált ki a C57BL6J egér kölykökben
- Káliumhiány (hypokalemia) Tünetek és kezelés
- A vesefunkció és a vérnyomás reakciója az étrendi só korlátozására normotenzív férfiaknál