Az FDA két gyógyszer értékelése a krónikus súlykezelés érdekében
Cikk
Audiointerjú
A genetikai, környezeti és kulturális tényezők összetett kölcsönhatásának köszönhetően az elhízás járványos méreteket öltött az Egyesült Államokban. Az elhízás egészségkárosító következményei sokrétűek, potenciálisan minden fő szervrendszert érintenek, és hozzájárulhatnak az életminőség csökkenéséhez. Minden elhízási terápia célja a negatív energiamérleg. A kábítószereket már régóta használják e cél elérésére.
Számos, egyszer ígéretes súlycsökkentő gyógyszer azonban felhagyott súlyos toxikus hatások miatt: az aminorex (amely pulmonalis hipertóniát okozott), fenfluramin és dexfenfluramin (valvulopathia), fenilpropanolamin (stroke), rimonabant (öngyilkossági gondolatok és viselkedés), és legutóbb szibutramint (miokardiális infarktus és stroke). A szibutraminnak a piacról való eltávolítása az orlistátot hagyta az egyetlen, az elhízás hosszú távú kezelésére jóváhagyott vényköteles gyógyszerként.
Ezt a problémás történelmet és a hatékony, biztonságos fogyókúrás gyógyszerek tagadhatatlan igényét szem előtt tartva az Élelmiszer- és Gyógyszerügyi Hivatal (FDA) nemrég két új gyógyszert engedélyezett a csökkentett kalóriatartalmú étrend és a krónikus krónikus fizikai aktivitás fokozásaként. testsúly-szabályozás elhízott felnőtteknél (testtömeg-index [BMI; a tömeg kilogrammban osztva a magasság négyzetének méterben kifejezve] ≥30) vagy túlsúlyos (BMI ≥27), legalább egy súly- kapcsolódó együttélő állapot.
A Belviq (lorcaserin, Arena Pharmaceuticals) a szerotonin (5-hidroxi-triptamin) 2C (5-HT2C) receptor szelektív agonistája. 1 A Qsymia (fentermin és nyújtott hatóanyag-leadású topiramát, Vivus) a szimpatomimetikus amin-phentermin, amely anorektikus szer, és az antiepileptikus topiramát gyógyszer fix dózisú kombinációja. 2 Mindkét gyógyszer csökkenti az étvágyat, és egyeseknél negatív energiaegyensúlyt vált ki.
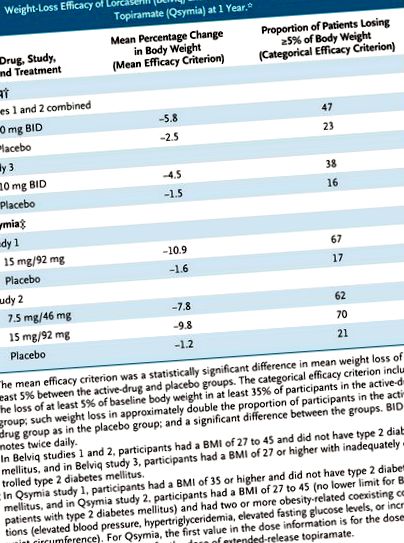
1 éves, placebo-kontrollos klinikai vizsgálatokban, amelyekben minden résztvevő életmódmódosítást kapott, a lorcaserin és a fentermin – topiramát megfelelt az FDA egyik vagy mindkét kritériumának a klinikailag jelentős súlycsökkenés szempontjából (lásd a táblázatot). 3 Sőt, a placebo beadásával összehasonlítva, a gyógyszeres kezelés általában a kardiometabolikus és antropometriai paraméterek (pl. Vérnyomás, nagy sűrűségű lipoprotein koleszterinszint és derék kerülete) számszerűen kedvezőbb változásaihoz kapcsolódott. Mindkét gyógyszer javította a glikált hemoglobinszintet a túlsúlyos és elhízott, 2-es típusú cukorbetegségben szenvedő résztvevőknél is.
Kezdetben potenciálisan komoly biztonsági aggályokat azonosítottak a lorcaserinnel kapcsolatban; ezek közé tartozott a patkányokban előforduló több daganattípus, köztük emlő- és agydaganatok, megnövekedett előfordulása, valamint az FDA által meghatározott valvulopathia - azaz mérsékelt vagy rosszabb mitrális szelepes regurgitáció vagy enyhe vagy rosszabb aorta-szelepes - előfordulásának numerikus egyensúlyhiánya regurgitáció. Az aggodalom a lorcaserin azon képessége miatt, hogy növeli az emlőrák kockázatát az emberekben, csökkent azután, hogy a patkányokban található emlődaganatokra vonatkozó adatokat egy öt független patológus testület újból megítélte, akik szinte egyöntetűen kevesebb daganatot soroltak rosszindulatúvá, mint a kezdeti olvasmányok. Egy klinikai tanulmány, amely bizonyítja, hogy a beadott lorcaszerin adagjának csak egy kis része jut be a központi idegrendszerbe, azt jelezte, hogy az embereknél nagy a biztonság biztonsága, és eloszlatta az agytumorok miatti aggodalmat.
A súlycsökkentő gyógyszereket, a fenfluramint és a dexfenfluramint, 1997-ben a szív valvulopathiájával való összefüggés miatt kivonták a forgalomból. A későbbi kutatások azt mutatták, hogy a szer intersticiális sejtjein a szerotonin 2B (5-HT2B) receptorok aktiválása volt valószínűleg a valvulopathia felelős mechanizmusa. 4 Több mint 5200 résztvevő echokardiográfiai adatai alapján, akik legfeljebb 1 évig kaptak lorcaserint vagy placebót, az FDA által meghatározott valvulopathia relatív kockázata a lorcaserinnel kezelt résztvevőknél 1,16 volt (95%) konfidencia intervallum, 0,81–1,67). Elkülönítve tekintve a valvulopathia relatív kockázatának 16% -os növekedése, bár statisztikailag nem szignifikáns, aggodalomra ad okot. Az in vitro receptorvizsgálatok adatai azonban azt mutatták, hogy a lorcaserin sokkal nagyobb szelektivitással rendelkezik az 5-HT2C receptor iránt, mint az 5-HT2B receptor, és a klinikailag ajánlott dózis mellett nem várható, hogy aktiválja az 5-HT2B receptort. Ezért ezen és más adatok alapján az FDA arra a következtetésre jutott, hogy nem valószínű, hogy a lorcaserin növeli az embereknél a valvulopathia kockázatát.
A fentermin és a nyújtott felszabadulású topiramát potenciálisan súlyos biztonsági aggályai közé tartozik a teratogenitás és a nyugalmi pulzus emelkedése. Az előzetes adatok arra utalnak, hogy azoknak a nőknek, akik terhesség alatt kaptak topiramátot, nagyobb valószínűséggel voltak orofaciális hasadékkal született csecsemők, egy további farmakoepidemiológiai tanulmány megerősítette. Ennek megfelelően a fentermin – topiramát jóváhagyásához kockázatértékelési és -csökkentési stratégiára (REMS) volt szükség. A REMS tartalmaz egy gyógyszeres útmutatót, egy betegismertetőt és egy hivatalos képzési programot az orvosok számára, amelyek mindegyike tájékoztatja a betegeket és az orvosokat a teratogén kockázatról, és hangsúlyozza annak szükségességét, hogy a reproduktív képességű nők hatékony fogamzásgátló módszereket alkalmazzanak. A REMS emellett csak speciálisan tanúsított gyógyszertárakban engedélyezi a fentermin – topiramát kiadását. Ez az összetevő fokozza az információs anyagok terjesztését a betegek számára, és maximalizálja az orvosok képzését.
A fentermin-topiramáttal 7,5 mg/46 mg és 15 mg/92 mg dózisban végzett kezelés a szívfrekvencia átlagos emelkedésével járt 0,6, illetve 1,6 ütés/perc, a placebóhoz képest. Azonban az ezekkel az adagokkal kezelt tanulmányi résztvevőknél nagyobb volt a vérnyomáscsökkenés, mint a placebót kapó résztvevőknél. Következésképpen a kombinált gyógyszerkészítmény számszerűen nagyobb csökkenéssel járt a sebesség-nyomás termékben - a szívizom oxigénfogyasztásának indexében -, mint a placebo csoportban. Figyelembe véve a súlycsökkenés nagyságát és a vérnyomás kedvező változását, az FDA arra a következtetésre jutott, hogy az előny-kockázat egyensúly pozitív volt, és támogatta a fentermin és a nyújtott felszabadulású topiramát jóváhagyását. A gyógyszer címkézése rendszeres pulzusmérést javasol, és nem javasolja a közelmúltban vagy instabil szív- vagy cerebrovaszkuláris betegségben szenvedő betegeknél, mivel ezeknél a betegeknél történő alkalmazását nem vizsgálták.
A fent vázolt biztonsági aggályokon kívül a lorcaserin növelheti a pszichiátriai, kognitív és szerotonerg káros hatások kockázatát. A fentermin – topiramát növelheti a metabolikus acidózis, a glaukóma, valamint a pszichiátriai és kognitív káros hatások kockázatát.
Az FDA elismeri, hogy még többet kell megtudni ezekről a gyógyszerekről. A releváns adatok megszerzésének biztosítása érdekében az ügynökség előírja, hogy a gyártók végezzenek számos utólagos klinikai vizsgálatot. Mindkét gyógyszer egyik követelménye a túlsúlyos és elhízott betegek hosszú távú kardiovaszkuláris biztonságának szigorú értékelése.
Mint minden újonnan forgalomba hozott gyógyszer esetében, a lorcaserin és a phentermine – topiramate esetében még ismeretlen előnyök és kockázatok lehetnek. A rendelkezésre álló adatok alapján azonban az FDA megállapította, hogy ez a két gyógyszer kedvező előny-kockázat profillal rendelkezik az elhízott és túlsúlyos betegek krónikus súlykezeléséhez.
- Fogyás; Súlykezelés Krónikus fájdalom Krónikus betegség Stresszkezelés Austin, TX 78738
- Súlykontroll és elhízás kezelése és kezelése Cleveland Clinic
- Fogyás és kezelés Dr
- Fogyás és súlykezelés piaca kiváló növekedést keres 2020-2028 birsalma piaci betekintés
- Fogyás és kezelés