Az időszakos böjt a kardiomiopátia fejlett formáját fordítja meg
Sejtbiológiai és Molekuláris Orvostudományi Tanszék, Rutgers New Jersey Medical School, Newark, NJ
Sejtbiológiai és Molekuláris Orvostudományi Tanszék, Rutgers New Jersey Medical School, Newark, NJ
* Levelezés: Junichi Sadoshima, MD, PhD, Kardiovaszkuláris Kutató Intézet, Rutgers Biomedical and Health Science, 185 S Orange Ave, MSB G609, Newark, NJ 07103. E-mail:
Sejtbiológiai és Molekuláris Orvostudományi Tanszék, Rutgers New Jersey Medical School, Newark, NJ
Absztrakt
Talán az egyik legjobban tanulmányozott szívbetegség, amelyet a fehérje minőség-ellenőrzési mechanizmusok szabályozatlansága okoz, a desmin-rel kapcsolatos kardiomiopátia (DRM). A DRM-et a dezmin hiánya vagy mutációja okozza, amely egy izom-specifikus, III. Típusú közbenső filamentum, amely állványként szolgál a szarcomér és más intracelluláris struktúrák összekapcsolására. Az 5 αB-kristályin (hősokk-fehérje [HSP] B5) egy kicsi HSP, amely kötődik a dezminhez, és bőséges a szív- és vázizmokban. Az αB-kristályin mutációi sokféle izomrendellenességet okoznak, beleértve a hipertrófiás és dilatált kardiomiopátiát és a csontváz myopathiáját, amelyekre jellemző az oldhatatlan fehérje-aggregátumok képződése, amelyek αB-kristályinból, fehérjékből és helytelenül dezminből állnak, és ennek következtében a sarcomere szerkezetének megzavarása. 6.
A folyóirat aktuális számában Az American Heart Association folyóirata (JAHA), Ma és munkatársai kimutatták, hogy az intermittáló koplalás (IF) megmenti a transzgenikus egerek fejlett kardiomiopátia fenotípusát a humán R120G αB-kristályin (CryABR120G), a DRM jól megalapozott egérmodelljének szívspecifikus expressziójával. 7 Bár számos olyan beavatkozás, amely a szív fehérje minőségének javítását célozza, beleértve a chaperonok és az autofágia szabályozását, kimutatták, hogy javítja a szívműködést ebben az egérmodellben, 8 a Ma és mtsai által végzett tanulmány 7 további hasznos betekintést nyújt a kezelés módjába. DRM-et kell megtervezni, amelyet az alábbiakban szeretnénk kiemelni.
Ha ez magában foglalja az evés és a koplalás váltakozását (1. ábra), az egészségre gyakorolt lehetséges jótékony hatása miatt egyre népszerűbb. A szerzők korábban megfigyelték, hogy ha az IF transzkripciósan szabályozza az autofágia-lizoszóma mechanizmusát kódoló géneket, és stimulálja az autofág fluxust a szív előfeltétele érdekében, csökkentve az ischaemia-reperfúziós sérüléseket és a sejtek halálát. 10 Ma és mtsai 7 kiterjesztették ezt a megfigyelést a DRM egy fejlett formájának kezelésére, és bebizonyították, hogy az IF megmenti a károsodott autofág fluxust, csökkenti a fehérje aggregátumokat és javítja a szívműködést a CryABR120G egerekben. Az a tény, hogy az IF képes javítani a DRM ezen kialakult és súlyos formájának szívfenotípusát, klinikailag ígéretes.
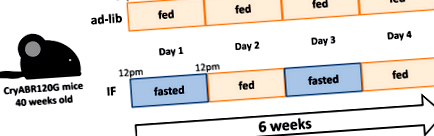
1.ábra. A tanulmányban Ma és mtsai. 7 Felnőtt egeret cédruson/egy ágyneműben tartanak, és egy chow-t etetnek (Lab Diet 5053). Az IF csoportban az egereket minden második nap 12 órától 12 óráig etetjük 6 héten keresztül. 6 hét után a testtömeg és a kumulatív kalóriabevitel szignifikánsan kisebb volt az IF csoportban, mint az ad-lib csoportban. A CryABR120G az R120G αB-kristályt jelenti.
Mechanikusan Ma és munkatársai kimutatták, hogy az IF az autofágia és a lizoszómális mechanizmusokat szabályozó kulcsfontosságú transzkripciós faktor, az EB transzkripciós faktor (TFEB) nukleáris lokalizációját indukálja, 7 és hogy a TFEB közvetlenül a HSPB8, egy kis HSP transzkripciós upregulációját indukálja (2. ábra). A TFEB és a HSPB8 aktiválja mind az általános autofágiát, mind a chaperone által segített szelektív autofágia (11, 12), ezáltal eltávolítja a fehérje aggregátumokat és a károsodott organellákat, beleértve a mitokondriumokat is. A HSPB8 a BAG3-HSPB8-HSC70 (BAG, B-sejtes limfóma 2-hez kapcsolódó antanogén; HSC, Heat shock rokon) 13 komplex részeként is elősegíti a fehérje újratekeredését, és segíti a dezmin fiziológiai lokalizációjának helyreállítását. Ennél is fontosabb, hogy a tanulmány megmutatja az első bizonyítékot arra, hogy mind a TFEB, mind a HSPB8 nélkülözhetetlen az IF üdvözítő hatásának közvetítéséhez CryABR120G egerekben. 7
2. ábra. Molekuláris mechanizmusok, amelyek révén az időszakos koplalás (IF) javítja a szív fenotípusát az R120G αB-kristályin (Cry ABR 120G) egerekben. IF inaktiválja a rapamicin emlős célpontját (mTOR), és az EB transzkripciós faktor (TFEB) nukleáris transzlokációját indukálja, amely a lizoszóma biogenezis és autofágia fő szabályozója. Az IF üdvös hatását a TFEB kritikusan közvetíti. A TFEB nemcsak aktiválja az autofágiát, ezáltal kiküszöböli a fehérje aggregátumokat és a károsodott mitokondriumokat, hanem transzkripciós úton is szabályozza a hősokk fehérjét (HSP) B 8, ami viszont normalizálja a dezmin lokalizációját. A HSPB 8 a chaperon-asszisztált szelektív autofágia és más ismeretlen mechanizmusok révén is stimulálja az autofágiát. A fehérje-aggregátumok autofág lebontása felszabadítja a belsejében lévő deszmint, amely viszont a HSPB 8 segítségével visszanyúlik a Z-vonalakba és az interkalált lemezekbe, és lehetővé teszi a normális szarkómás szerkezet helyreállítását. Bár Ma és mtsai 7 tanulmánya egyértelműen kimutatta, hogy a TFEB üdvös hatásait a Cry ABR 120G egerekben kritikusan közvetítik a HSPB 8, az autofágia stimulálása nélkülözhetetlen, még tisztázandó.
Az IF javítja az inzulinrezisztenciát a 2-es típusú diabetes mellitusban 14, és csökkenti a gyulladást és a magas vérnyomást. A 15, 16 IF szintén bizonyítottan növeli a patkányok és egerek élettartamát. 17 Bár a TFEB sejt autonóm módon képes megvédeni a kardiomiocitákat a CryABR120G túlexpresszióval, 7 az IF üdvözítő hatása a CryABR120G egerekben részben extracardialis mechanizmusokon keresztül is közvetíthető.
Bár a fehérje lebontásának mechanizmusait feltételezhetően rosszul összehajtott fehérjék jelenlétében indukálják, a CryABR120G egerekben a működési zavarok előrehaladott stádiumában a fehérjék és az organellumok minőségét fenntartó mechanizmusok nyilvánvalóan károsodtak vagy elégtelenek. A CryABR120G transzgénikus egerek szívében még azelőtt megfigyelhető az ubiquitin-proteasome rendszer károsodása, hogy az egereknél szívműködési zavar alakulna ki, 19 és az autofág aktivitás is csökken a szívműködési zavar késői szakaszában. 8 A minőség-ellenőrzési mechanizmusok aktiválódását megakadályozó molekuláris mechanizmusok tisztázása fontos. Ma és mtsai 7 azt javasolják, hogy a rosszul összehajtott fehérjék kezdeti lebomlásából származó aminosav-felszabadulás által okozott rapamicin-aktiváció emlős célpontja gátolja a TFEB nukleáris importját. Nem világos azonban, hogy a rapamicin aktiválásának emlős célpontja fenntartható-e, mert az autofágia gátolt a DRM előrehaladott stádiumában. További vizsgálatokra van szükség a DRM fehérje minőségének ellenőrzését szabályozó jelátviteli mechanizmusok tisztázásához.
Egyre több bizonyíték azt sugallja, hogy az IF javíthatja más kardiovaszkuláris állapotokat, beleértve a magas vérnyomást és az öregedés okozta szívhipertrófiát. Ma és mtsai 7 tanulmánya azt sugallja, hogy az IF alkalmazható a már kialakult szívbetegségek, például kardiomiopátia és szívelégtelenség kezelésére is. A tanulmány azt is sugallja, hogy lehetséges lehet beavatkozás kidolgozása a TFEB aktiválására vagy a szívben a HSPB8 szabályozására a DRM kezelésében, az IF alternatívájaként. A kalória-korlátozás utánzó szerekhez hasonlóan az IF mögöttes mechanizmusait utánzó beavatkozások is életképes lehetőségeket jelenthetnek a DRM kezelésében. Ilyen például a trehalóz, egy diszacharid és a spermidin, egy poliamin, amelyekről kimutatták, hogy szabályozzák a TFEB-et. Az IF azonban súlyosbíthatja a szívbetegségeket, ha akkor alkalmazzák, amikor az autofágia és/vagy a lizoszomális funkció helyrehozhatatlan, például a lizoszomális tárolási betegségek egyes formáiban. Ezért az IF alkalmazását gondosan értékelni kell a kardiovaszkuláris állapotok mögöttes mechanizmusaitól függően. Jelenleg az IF klinikai alkalmazása még mindig primitív stádiumban van, és várja annak biztonságosságának és hatásosságának alapos értékelését, valamint az etetési protokoll optimalizálását.
A finanszírozás forrásai
Ezt a munkát részben az Egyesült Államok Közegészségügyi Szolgálata támogatta a HL67724, HL91469, HL102738, HL112330, HL138720 és AG23039 támogatásokkal (Szadosimának). Ezt a munkát a Leducq Alapítvány Transzatlanti Kiválósági Hálózata, 15CBD04 (Szadosimáig) és az American Heart Association alapítók társult posztdoktori ösztöndíja is támogatta 18POST34060247 (Mukaiig).
- Időszakos böjt napló - Donna Reish
- Hogyan kell elvégezni a 168 szakaszos böjtöt; Fogyjon el folyamatosan a zsír
- Mason Hicks (Willis HS) szakaszos böjtöléssel 145 fontot dob le
- 20 kg-ot vesztettem a szakaszos böjtöléssel és erőedzéssel a Hemanta Sapkota Medium segítségével
- Jennifer Aniston a 16 8 szakaszos éhomi étrendet csinálja - mi ez