Az inzulinérzékenységet és a glükóz toleranciát a ketogén diéta fenntartása megváltoztatja
Absztrakt
A ketogén étrend (KD) alacsony szénhidráttartalmú, magas zsírtartalmú étrend, amelyet különféle egészséggel kapcsolatos hatások esetén alkalmaznak. Ez a fajta étrend hatékonyan elnyomja a görcsrohamot a refrakter epilepsziában szenvedő gyermekeknél (1), és talán gyakrabban táplálkozási stratégiaként valósítják meg, amelynek során a testsúly fenntartása vagy a fogyás a kívánt eredmény. Kimutatták, hogy az étrendi szénhidrátok korlátozása pozitív hatással van a szív- és érrendszeri paraméterekre. Az ilyen típusú étrend fogyasztása kedvezően befolyásolja a test zsírosságát és javítja a metabolikus szindróma jellemzőit az embereknél (2,3,4,5,6). Noha a KD-k hatékonyságát és metabolikus hatásait értékelő tanulmányok az elmúlt években növekedtek, a makrotápanyag-kontrollált étrend hatásai továbbra is ellentmondásosak az irodalomban.
Az inzulin erős rövid és hosszú távú hatással van az energiafogyasztásra és a glükóz homeosztázisra. Rövid távon az inzulin felszabadulása cefalis; az agy úgy kezdeményezi az inzulin szekrécióját, hogy az üzeneteket a vagus idegeken keresztül a hasnyálmirigy felé irányítja, szemben az inzulint szekretáló sejtek közvetlen hasnyálmirigy-stimulációjával. A cefalikus inzulin legkönnyebben az étkezés kezdetén figyelhető meg, és egy rövid inzulinpörgetésből áll, amely a bevitt ételre nézve preabsorptív. Étkezés elfogyasztása után az inzulinszekréció fokozódik és fenntartódik, mert az inzulin egyik szerepe a test felkészítése a táplálékfelvétellel járó glükóznövekedésre, valamint a megnövekedett glükózszint és felhasználás ellenőrzése (7 Hosszú távon az inzulin adipozitási jelként betöltött szerepe jól ismert, a megnövekedett testtömeg következtében megnő a plazma inzulinszintje. Az inzulin rövid és hosszú távú hatása együttesen lehetővé teszi a megfelelő glükóz homeosztázist és elősegíti a testtömeg szabályozását.
Az inzulin vércukorszint-szabályozó képességét megváltoztathatja a szokásos étrend makrotápanyag-tartalma. A magas zsírtartalmú étrend fogyasztása esetén az egyéneknél megnő a plazma inzulinszintje, ami végül inzulinrezisztenciához és a glükóz homeosztázis fenntartásának képtelenségéhez vezet. Azonban a magas zsírtartalmú étrendet, amely alacsony szénhidráttartalmú, nevezetesen egy KD-t, gyakran alkalmaznak fogyáshoz és a 2-es típusú cukorbetegség tüneteinek kezeléséhez az emberi populációban (8,9,10). Jelenleg nem ismert, hogy a KD hatása a glükóz homeosztázisra a KD használatával összefüggő súlycsökkenés vagy az étrendi szénhidrátbevitel szigorú korlátozásának eredménye-e.
Végül a központi idegrendszer inzulinjának ismert szerepe van az energia homeosztázisban. Az inzulinreceptorok az agy olyan területeire koncentrálódnak, amelyek kritikusan részt vesznek a táplálékfelvétel szabályozásában, ideértve a hipotalamusz íves magját is, és az inzulin adagolása az agyba dózisfüggő csökkenést okoz az élelmiszer-bevitelben és a testsúly csökkenésében (áttekintésként lásd: Ref. 7). Ezért megvizsgáltuk az intracerebroventrikuláris (icv) inzulinra adott reakciókészséget, valamint az inzulinreceptor mRNS expressziós szintjét a hipotalamuszban.
Anyagok és metódusok
Állatok és diéták
Minden vizsgálat során 200–225 g tömegű hím Long Evans patkányokat (Harlan, Indianapolis, IN) külön-külön rozsdamentes acélból készült drótketrecekben helyeztünk el, és állandó hőmérsékleten (25 ° C) tartottuk 12 órás lámpán, 12 órán át. sötét ciklus (0400 órakor világít). A laboratóriumba érkezéskor a patkányok 8 hetesek voltak. 1 hetes laboratóriumi akklimatizálás után, amely során ad libitum hozzáférést engedélyeztek a rágcsáló-chow-hoz (Harlan Teklad 2018), a patkányokat súly szerint egyeztettük és két csoportra osztottuk. Az egyik csoport ad libitum hozzáférést biztosított a chow-hoz, a másikat egy KD-re helyezték, amelyből a kalóriák 5% -a szénhidrátból, 80% zsírból és 15% fehérjéből származott (Research Diets D06040601, 6,1 kcal/g; Research Diets Inc., New Brunswick, NJ). A KD zsírforrásai a szójaolaj és a zsír, így az étrend telített és telítetlen hosszú láncú zsírsavakból állt. A kalóriabevitelt és a testtömeget naponta mértük és regisztráltuk. Minden kísérlet közvetlenül a diéta fenntartásának nyolcadik hete után kezdődött. A korábbi jelentéseknek (12,20) megfelelően a kalóriabevitel és a testtömeg nem különbözött az étrendi csoportok között. Az összes eljárást a Purdue Egyetem Állattenyésztési és Felhasználási Bizottsága hagyta jóvá.
1. kísérlet: az ip inzulin hatása a KD-n tartott patkányok táplálékfelvételére
Patkányoknak (chow, n = 9; vagy KD, n = 11) ip inzulint adtunk, hogy meghatározzuk az étrend hatását az exogén inzulinra adott válaszokra. Az injekciókat ellensúlyoztuk, és mindegyik patkány fiziológiás sóoldatot vagy inzulint (szarvasmarha; Sigma-Aldrich, St. Louis, MO) injektált a két injekció beadásának napján, 5 nappal elválasztva. Az injekciókhoz az ételt 2 órával eltávolították, mielőtt kigyulladt volna. Kilencven perccel később mindegyik patkánynak ip-be injektáltunk 1 ml sóoldatot vagy inzulint (1,0 egység/testtömeg-kg). Ezt az adagot olyan korábbi kutatások alapján választották meg, amelyek igazolták, hogy 1,0 U/testtömeg-kg hatékonyan csökkenti a vércukorszintet felnőtt hím patkányokban (21). Kigyulladáskor minden patkánynak előre lemért mennyiségű táplálékot adtak, az injekció után 1, 2, 4 és 24 órával mért táplálékfelvételt. Az egyes ketrecek alá papírokat helyeztek a kiömlés összegyűjtése érdekében, és a beviteli számításokat ennek megfelelően módosították.
2. kísérlet: A KD fenntartásának hatása a glükóz toleranciára
Az intraperitoneális glükóz tolerancia teszteket (IPGTT) 8 hét fogyasztó chow vagy KD után (chow, n = 12; vagy KD, n = 9) végeztük. Az ételt 16 órával az IPGTT megkezdése előtt eltávolítottuk, és az élelmiszer-nélkülözés utáni testtömegeket használtuk a glükózdózisok kiszámításához (1,5 g glükóz/testtömeg-kg). A vért a farok nickjén keresztül gyorsan összegyűjtöttük, hogy minimalizáljuk az állat stresszét (22,23) a glükózinjekció előtt. A glükózinjekció után vérmintákat vettünk 15, 30, 45, 60 és 120 percnél. A glükózt duplikált analízissel határoztuk meg Precision Xtra glükózmonitorozó rendszerrel (Abbott Laboratories, Abbott, IL). A maradék vérmintát jégre helyeztük. Az összes minta összegyűjtése után mindegyiket 2000 fordulat/perc sebességgel 15 percig, 4 ° C-on centrifugáltuk. Az inzulin koncentrációjának elemzéséhez plazmát gyűjtöttünk ultrahangos patkány inzulin ELISA-val (Crystal Chem Inc., Downers Grove, IL).
IP inzulin tolerancia tesztet (IPITT) végeztek külön patkánycsoportban (chow, n = 8; KD, n = 8), akik 1 U/testtömeg-kg inzulint kaptak ip. Az ételt 16 órával az IPITT megkezdése előtt eltávolítottuk, és az étkezés utáni testtömegeket használtuk az inzulinadagok kiszámításához. A vért farokcsonkon keresztül ugyanolyan időközönként vettük, mint az IPGTT esetében, és a glükóz- és inzulinszintet a fent leírtak szerint határoztuk meg.
3. kísérlet: a KD és az étkezés okozta inzulin- és glükózszint fenntartása
A chow-n tartott patkányoknak (n = 12) a tesztelés előtt három külön edzésen hozzáférést biztosítottak vaníliaízű Ensure-hoz (67,6% szénhidrát), a KD patkányokhoz (n = 12) pedig alacsony szénhidráttartalmú, vaníliaízű Atkins rázza (7,7% szénhidrát) három külön edzésen, amelyek során az ételt és a vizet eltávolítják 3 órával a sötét ciklus kezdete előtt, és egy előre lemért üveg táplálék-kiegészítőt helyeznek a ketrecbe, amikor a lámpa kialszik. A hozzáférést 1 órán át engedélyezték. A teszteléshez ugyanazt az eljárást követték vérvétel hozzáadásával. A vért a farokvénán keresztül vették közvetlenül azelőtt, hogy hozzáférhettek volna a táplálék-kiegészítőhöz (kiindulási érték), majd 15 és 30 perccel, valamint 1 és 2 órával az első nyalás után. A vércukorszintet minden alkalommal kétszer mértük, és a fennmaradó mintát jégre helyeztük a vizsgálat időtartama alatt. A mintákat a 2. kísérletben leírtak szerint kezeltük, majd később inzulinszintet elemeztünk. A táplálékkiegészítőt 1 óra múlva lemértük, ekkor kivették a ketrecből. A 2 órás vérvétel után az ételt és a vizet kicserélték.
Egy héttel később a KD patkányok hozzáférést kaptak a vanília ízű Ensure-hoz, hogy meghatározzák a magas szénhidráttartalmú étkezési kiegészítők fogyasztásának hatásait a KD hosszan tartó fenntartása után. A patkányok hozzáférést kaptak a vaníliaízű Ensure-hoz, és a vért a fent leírtak szerint gyűjtötték. A vércukorszintet kettős analízissel határoztuk meg, és a plazma inzulint ultraizenzív patkány inzulin ELISA-val mértük.
4. kísérlet: váltás a KD-ről a chow-ra - az inzulinra való reagálás és a glükóz toleranciára gyakorolt hatás
A patkányokat chow-n (n = 8) vagy KD-n (n = 7) tartottuk 8 hétig, ezután a KD-t eltávolítottuk a KD-patkányokról, és helyettesítettük chow-val (KD/chow-csoport). Öt nappal később a patkányoknak perifériás inzulint adtak, hogy meghatározzák az étrend hatását az exogén inzulinra adott válaszokra, az 1. kísérletben leírtak szerint. Mindegyik patkány sóoldatot vagy inzulint kapott az injekció beadásának két napján, az 1. kísérletben leírtak szerint (1,0 U/kg test súly).
Annak eldöntésére, hogy a KD-ről a chow-ra való áttérés befolyásolja-e a glükóz toleranciát, egy újabb patkánycsoportot tartottak chow-on vagy KD-n 8 hétig, majd a KD-t chow-val helyettesítették. Egy hét múlva megvizsgálták a glükóz toleranciát a fenti 2. kísérletben leírtak szerint.
5. kísérlet: az icv inzulin hatása
A patkányokat 8 hétig tartottuk chow-on vagy KD-n, majd mindegyiket sztereotaxikusan beültettük egy kanülvel az oldalsó agykamrába (icv), amint azt korábban leírtuk (24). Röviden, a patkányokat 1 ml/kg ketamin (100 mg/ml) és xilazin (20 mg/ml) 4: 3 arányú elegyével altattuk és sztereotaxiás készülékbe helyeztük. 23 mm-es vezető kanült (10 mm hosszú) helyeztek be 1,8 mm-rel a bregma mögé, 1,6 mm-re oldalirányban a középvonalig (a bregma és a lambda ugyanazon a függőleges koordinátán), és 3,3 mm-es ventrális a dura felé. A kanül elhelyezését angiotenzin II vizsgálattal igazoltuk. A patkányokat icv-vel injektáltuk 5 nmol angiotenzin II-vel, majd megmértük a vízbevitelt. Mindegyik legalább 5 ml-rel többet ivott, mint amennyit ivv sóoldat injekció után ivott (30 perc alatt), és ezért megfelelő kanül elhelyezésnek tekintik őket.
Egy héttel az elősebészeti testtömeg helyreállítása után a patkányoknak egy sor icv injekciót hajtottak végre, hogy meghatározzák az inzulin hatékonyságát a kalóriabevitel csökkentése érdekében a patkányokon, amelyeket chow vagy KD tartanak. A vizsgálati alanyokon belül olyan tervet alkalmaztunk, hogy a patkányok fiziológiás sóoldat vagy inzulin icv injekcióit kapták (6 és 9 mU 2 μl sóoldatban). Az adagokat olyan vizsgálatok alapján választották meg, amelyekben 8 mU megbízhatóan bizonyította, hogy csökkenti a táplálékfelvételt (25,26), és 6 és 9 mU-t teszteltek annak megállapítására, hogy a KD patkányok fokozott érzékenységet mutatnak-e a központilag alkalmazott inzulin anorektikus hatásaival szemben. Mindegyik patkány fiziológiás sóoldatot és mindkét inzulinadagot kapott, az injekciók között legalább 5 nap volt, kiegyensúlyozott sorrendben. A tesztnapokon az ételt 1 órával az injekció beadása előtt eltávolították. A patkányokat 30 perccel a sötét ciklus kezdete előtt injektálták, ekkor az ételt kicserélték a ketrecbe. A bevitelt 1, 2, 4 és 24 órával később mértük.
6. kísérlet: A KD krónikus bevitelének hatása az inzulinreceptor expressziójára a hipotalamuszban
Egy újabb patkánycsoportot tartottunk chow-n (n = 8) vagy KD-n (n = 8) 8 hétig, majd leöltük az inzulinreceptor mRNS expressziójának mérésére a hipotalamuszban. A leölés napján az ételt 6 órán át eltávolítottuk, és a patkányokat 2 órával a sötét ciklus kezdete előtt leöltük. A patkányokat éteres inhalációs anesztézia alatt gyorsan lefejeztük, az agyakat eltávolítottuk és RNAlater-be helyeztük (Ambion, Austin, TX), hogy a hipotalamuszban inzulinreceptor-expressziót kvantitatív RT-PCR (Q-PCR) segítségével később elemezzük.
A Q-PCR esetében az egyes patkányok teljes hipotalamuszát kivágtuk az agyból, és 1 ml Trizol-reagensben (Invitrogen, Carlsbad, Kalifornia) homogenizáltuk. Az elegy centrifugálása után az RNS-t izopropanolos kicsapással nyertük ki a vizes fázisból. Az esetleges szennyező genomi DNS-t ezután eltávolítottuk DNS-mentes dezoxiribonukleáz-kezeléssel és eltávolító reagensekkel (Applied Biosystems/Ambion, Austin, TX). A cDNS-t 5 μg RNS-ből szintetizáltuk SuperScript III első szálú szintézis rendszer (Invitrogen, Carlsbad, CA) alkalmazásával RT-PCR-hez, és 1: 3 arányban hígítottuk nukleázmentes vízben tárolás céljából -20 ° C-on.
Minden egyes primer készletet úgy optimalizáltunk, hogy a korrelációs együttható 0,99–1,0, a PCR hatékonysága pedig 90–100%. A cDNS integritását az L32, egy háztartási gén hagyományos RT-PCR amplifikálásával igazoltuk. Minden RNS-minta esetében egy kontrollreakciót is végeztünk reverz transzkriptáz enzim hozzáadása nélkül. A Q-PCR-t két példányban, iCycler és az iQ SYBR Green Supermix (Bio-Rad, Hercules, CA) alkalmazásával végeztük kétlépéses amplifikációval (95 C 10 mp-ig és 60 C 45 mp-ig) 40 ciklusig. Minden mintából L32-t amplifikáltunk endogén kontrollként történő felhasználás céljából.
statisztikai elemzések
Az ip és az icv inzulin kalóriabevitelre gyakorolt hatását ismételt ANOVA módszerrel értékeltük, és Bonferroni tesztet alkalmaztunk post hoc elemzéshez. Az összes glükóz- és inzulinadatot kétirányú ANOVA-val elemeztük, ismételt mérésekkel és Bonferroni tesztekkel post hoc elemzés céljából. A görbe alatti területet t teszt alkalmazásával elemeztük. Az összes statisztikát a Prism Statistical Software segítségével végeztük, és a szignifikanciát P sem-ben állítottuk be .
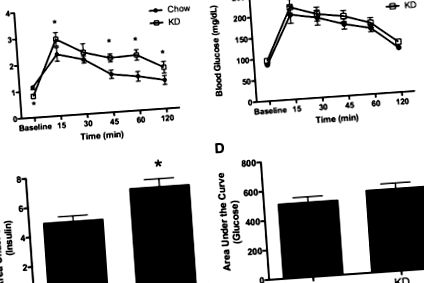
A Q-PCR elemzésekhez kiszámítottuk a hozzávetőleges hajtáskülönbséget, 2 -ΔΔCT (27). Az INSR esetében a chow értékeket Student's t teszttel hasonlítottuk össze a KD értékekkel. A P 1A, rövid távú kalóriabevitel értéke szignifikánsan nőtt mindkét patkánycsoportban ip inzulin beadása után. Az injekció beadása után négy órával a chow patkányok átlagos kalóriabevitele 18,9 ± 1,4 kcal volt fiziológiás sóoldatra reagálva és 27,7 ± 2,9 kcal ip inzulin (P 1B) után. ). Az inzulinnal stimulált kalóriabevitel változásának összehasonlítása szignifikánsan nagyobb változást mutatott a chow bevitelben az inzulin után, és összehasonlítva a KD patkányokban kiváltott kalóriabevitel változásával (P sem. *, P 2A, P 2B) nagyobb a KD patkányokban, mint a kontrollokban (P 2C). ). A glükóz AUC (2D. Ábra 2D. Ábra) nem különbözött az étrendi csoportok között.
Inzulin és glükóz IPGTT után. A és B, a plazma inzulint (A) mértük, és az inzulin (A) AUC-értékét kiszámítottuk a glükóz ip beadásának hatására; C és D, vércukorszintet (C) és vércukorszint (A) AUC-t is kaptunk az ip inzulin után. Az adatokat átlag ± félként adjuk meg. *, P 3A, a glükóz szignifikánsan csökkent a chow-val táplált patkányokban 15 perccel az ip inzulin injekció után, és a kiindulási értékhez képest a 120 perces tesztidőszak hátralévő részében szuppresszív maradt. Ezzel szemben a glükóz nem csökkent az alapszinttől KD patkányokban 15 perccel az inzulin beadása után. A glükóz szignifikánsan alacsonyabb volt a KD patkányokban 30–120 perccel az injekció beadása után (P 3B)) szignifikánsan nagyobb területet mutatott a KD patkányok számára az IPITT után, ami kevesebb inzulin okozta hipoglikémiát mutatott ki.
Kalóriabevitel a KD-ről a chow-ra való áttérés után és az ip inzulinra reagálva. A patkányokat KD-ről chow-ra cserélték, és ip inzulint kaptak. A kalóriabevitelt 4 órával (A) és 24 órával (B) később mértük. Az adatok átlagos kumulatív kalóriabevitel ± sem. *, P sem .
Reakció a központi inzulinra és az inzulinreceptor mRNS expressziója a hipotalamuszban
- Az alacsony glikémiás indexű étrend javíthatja az elhízott gyermekek inzulinérzékenységét
- A magas zsírtartalmú, alacsony szénhidráttartalmú étrend hatása a szívizom szubsztrát oxidációjára, inzulinérzékenységre,
- Hogyan lehet nyomon követni a ketogén diéta eredményeit - Tökéletes Keto
- A ketogén étrend használata a testösszetétel javítása érdekében - InBody USA
- Mennyi zsír egy ketogén étrenden KetoDiet Blog