Az oleanolsav hipolipidémiás hatását a miR-98-5p/PGC-1β tengely közvetíti magas zsírtartalmú étrend által kiváltott hiperlipidémiás egerekben
Jiangsu Metabolikus betegségekkel kapcsolatos gyógyszerkutatás-laboratórium, Kínai Gyógyszerészeti Egyetem, Nanjing, Kína, Természetes Gyógyszerek Állami Fő Laboratóriuma
Jiangsu Humán Funkcionális Genomika Fő Laboratóriuma, Nanjing Orvostudományi Egyetem, Nanjing, Jiangsu, Kína
Ezek a szerzők egyformán járultak hozzá ehhez a munkához. Keressen további cikkeket a szerzőtől
Jiangsu Metabolikus betegségekkel kapcsolatos gyógyszerkutatás-laboratórium, Kínai Gyógyszerészeti Egyetem, Nanjing, Kína, Természetes Gyógyszerek Állami Fő Laboratóriuma
Ezek a szerzők egyformán járultak hozzá ehhez a munkához. Keressen további cikkeket a szerzőtől
Élettudományi Kar, Kínai Gyógyszerészeti Egyetem, Nanjing, Kína
Élettudományi Kar, Kínai Gyógyszerészeti Egyetem, Nanjing, Kína
Jiangsu Metabolikus betegségekkel kapcsolatos gyógyszerkutatás-laboratórium, Kínai Gyógyszerészeti Egyetem, Nanjing, Kína, Természetes Gyógyszerek Állami Fő Laboratóriuma
Levelezés: Kínai Gyógyszerészeti Egyetem, 24 Tongjiaxiang St., Nanjing, Jiangsu 210009, Kína. E-mail: [email protected]
Levelezés: Kínai Gyógyszerészeti Egyetem, 639 Longmian Ave., Nanjing, Jiangsu 211198, Kína. E-mail: [email protected]
Jiangsu metabolikus betegségekkel kapcsolatos gyógyszerkutatás-laboratórium, Kínai Gyógyszerészeti Egyetem, Nanjing, Kína, Természetes Gyógyszerek Állami Kulcslaboratóriuma
Élettudományi Kar, Kínai Gyógyszerészeti Egyetem, Nanjing, Kína
Jiangsu kulcsfontosságú molekuláris és orvosi biotechnológiai laboratórium, Élettudományi Főiskola, Nanjing Normal University, Nanjing, Kína
Levelezés: Kínai Gyógyszerészeti Egyetem, 24 Tongjiaxiang St., Nanjing, Jiangsu 210009, Kína. E-mail: [email protected]
Levelezés: Kínai Gyógyszerészeti Egyetem, 639 Longmian Ave., Nanjing, Jiangsu 211198, Kína. E-mail: [email protected]
Jiangsu Metabolikus betegségekkel kapcsolatos gyógyszerkutatás-laboratórium, Kínai Gyógyszerészeti Egyetem, Nanjing, Kína, Természetes Gyógyszerek Állami Fő Laboratóriuma
Jiangsu Humán Funkcionális Genomika Fő Laboratóriuma, Nanjing Orvostudományi Egyetem, Nanjing, Jiangsu, Kína
Ezek a szerzők egyformán járultak hozzá ehhez a munkához. Keressen további cikkeket a szerzőtől
Jiangsu Metabolikus betegségekkel kapcsolatos gyógyszerkutatás-laboratórium, Kínai Gyógyszerészeti Egyetem, Nanjing, Kína, Természetes Gyógyszerek Állami Fő Laboratóriuma
Ezek a szerzők egyformán járultak hozzá ehhez a munkához. Keressen további cikkeket a szerzőtől
Élettudományi Kar, Kínai Gyógyszerészeti Egyetem, Nanjing, Kína
Élettudományi Kar, Kínai Gyógyszerészeti Egyetem, Nanjing, Kína
Jiangsu Metabolikus betegségekkel kapcsolatos gyógyszerkutatás-laboratórium, Kínai Gyógyszerészeti Egyetem, Nanjing, Kína, Természetes Gyógyszerek Állami Fő Laboratóriuma
Levelezés: Kínai Gyógyszerészeti Egyetem, 24 Tongjiaxiang St., Nanjing, Jiangsu 210009, Kína. E-mail: [email protected]
Levelezés: Kínai Gyógyszerészeti Egyetem, 639 Longmian Ave., Nanjing, Jiangsu 211198, Kína. E-mail: [email protected]
Jiangsu Metabolikus betegségekkel kapcsolatos gyógyszerkutatás-laboratórium, Kínai Gyógyszerészeti Egyetem, Nanjing, Kína, Természetes Gyógyszerek Állami Fő Laboratóriuma
Élettudományi Kar, Kínai Gyógyszerészeti Egyetem, Nanjing, Kína
Jiangsu kulcsfontosságú molekuláris és orvosi biotechnológiai laboratórium, Élettudományi Főiskola, Nanjing Normal University, Nanjing, Kína
Levelezés: Kínai Gyógyszerészeti Egyetem, 24 Tongjiaxiang St., Nanjing, Jiangsu 210009, Kína. E-mail: [email protected]
Levelezés: Kínai Gyógyszerészeti Egyetem, 639 Longmian Ave., Nanjing, Jiangsu 211198, Kína. E-mail: [email protected]
ABSZTRAKT
RÖVIDÍTÉSEK
ANYAGOK ÉS METÓDUSOK
Állatok
Szerológiai elemzés
A vérmintákat nem heparinált csövekbe gyűjtöttük, és 4000 fordulat/perc sebességgel 10 percig 4 ° C-on centrifugáltuk. A szérumokat összegyűjtöttük, és a TG-k, a TC, az LDL-C és a HDL-C szintjét spektrofotometriásan határoztuk meg a Nanjing Jiancheng Bioengineering Institute-tól (Nanjing, Kína) vásárolt kereskedelmi készletekkel.
Sejtkultúra
Az egér primer májsejtjeit egerekből izoláltuk a korábban leírt kollagenáz IV (Thermo Fisher Scientific) perfúziós módszerrel, és nedvesített atmoszférában tenyésztettük, amely 5% CO2-ot tartalmazott 37 ° C-on (39). Az egér AML-12 májsejteket DMEM/F-12 táptalajban (Thermo Fisher Scientific) tenyésztettük, amelyet inzulin-transzferrin-szelinnel (Thermo Fisher Scientific) és dexametazonnal (40 ng/ml; Sigma-Aldrich) egészítettünk ki. Minden transzfekciós kísérletet AML-12 sejtekben hajtottunk végre Lipofectamine 3000 (Thermo Fisher Scientific) felhasználásával, a gyártó utasításainak megfelelően. Mert in vitro OA kezeléssel 10 mM OA-t tartalmazó törzset állítottunk elő steril DMSO alkalmazásával.
A sejtek életképességének vizsgálata
CCK-8 toxicitási vizsgálatot alkalmaztak az OA potenciális toxikus hatásainak elemzésére az egér primer hepatociták életképességére. Röviden: 1 × 104 sejtet oltottunk egy 96 üregű lemez minden egyes lyukába, és egy éjszakán át 37 ° C-on tenyésztettük a rögzítéshez. A sejteket ezután 100 ul tápközegbe vittük, amely 0,1% DMSO-t vagy OA-t tartalmazott a megadott koncentrációkban, és 24 órán át inkubáltuk. Ezt követően minden egyes üregbe 10 µl WST-8 reagenst (EnoGene, Nanjing, Kína) adunk, tápközeggel elkeverjük és 2 órán át 37 ° C-on inkubáljuk. Végül egy mikrotányér-leolvasót használtunk az abszorbancia 450 nm-en történő mérésére.
Mennyiségi RT ‐ PCR
A teljes RNS-extrakciót és a kvantitatív RT-PCR-t (qRT-PCR) a korábban leírtak szerint végeztük (40). A részletes primer szekvenciák a következők voltak: Pgc ‐ 1β: (előre) 5′ – GGCAGGTTCAACCCCGA – 3 ′; (hátra) 5′ – CTTGCTAACATCACAGAGGATATCTTG – 3 ’; Fas (zsírsavszintézis): (előre) 5′ – TCCTGGAACGAGAACACGATCT – 3 ’; (hátra) 5′ – GAGACGTGTCACTCCTGGACTTG – 3 ′; Scd1 (sztearoil-koenzim A deszaturáz 1): (előre) 5′ – TTCTTACACGACCACCACCA – 3 ’; (hátra) 5′ – GCAGGAGGGAACCAGTATGA – 3 ′; és 36B4: (előre) 5′ – GAAACTGCTGCCTCACATCCG – 3 ′; (hátramenet) 5′ – GCTGGCACAGTGACCTCACACG ‐ 3 ′. A 36B4 gént használtuk belső kontrollként. A miRNS mennyiségi meghatározásához RiboBio (Guangzhou, Kína) tervezte a miR-98-5p-re specifikus domború hurokú miRNA qRT-PCR primer készleteket (egy készlethez egy RT primert és egy pár qPCR primert minden készlethez). A miRNA kidudorodási hurkát reverz átírással töltöttük át PrimeScript RT reagenskészlettel (Takara, Tokió, Japán), és qPCR segítségével számszerűsítettük SYBR Premix Ex Taq II (Takara) alkalmazásával, a gyártó utasításainak megfelelően. A miRNS expresszióját U6 snRNS-re normalizáltuk, hogy megkapjuk a relatív bőséget.
Western blottolás
A fehérje elemzéséhez a májmintákat RIPA pufferben lizáltuk. A fehérjekoncentrációt egy BCA Protein Quantitation Assay Kit (Jiancheng) segítségével számszerűsítettük. Ugyanolyan mennyiségű fehérjét töltöttünk be és 10% SDS-PAGE-vel választottunk el, majd PVDF membránra vezettük (Millipore, Billerica, MA, USA). A membránokat egy éjszakán át inkubáltuk megfelelő primer Abs-vel 4 ° C-on. A megkötött Abs-t torma-peroxidáz-konjugált másodlagos Abs alkalmazásával tettük láthatóvá. Az egér PGC-1β és FAS elleni abs-ját a ProteinTech-től vásároltuk (1: 500 hígítás; Chicago, IL, USA). Az egér SCD1 elleni ab-ját a Santa Cruz Biotechnology-tól szereztük be (1: 500 hígítás; Santa Cruz Biotechnology, Dallas, TX, USA). A glicerinaldehid-3-foszfát-dehidrogenáz elleni Ab-ot a Kangcheng Biotech-től (1: 5000 hígítás; Shanghai, Kína) szereztük be. Kvantitatív elemzést végeztünk Western blot képeken ImageJ szoftver (NIH) alkalmazásával.
Pgc ‐ 1β promóter építése
Egér Pgc ‐ 1β promótert (−793 és +100 bp között) amplifikáltuk az egér genomi DNS-jéből a következő primerek alkalmazásával: (előre) 5′ – AAGACGCGTGGTGGATGGCTGATTGGTGT – 3 ′; (hátra) 5′ – GGACTCGAGATAGTTGAGGAAGAAGGACG ‐ 3 ′. A szekvenciát szekvenálással validáltuk és PGL3-bázis vektorba klónoztuk Mluén és XhoI restrikciós enzim vágási helyek. A luciferáz riportervizsgálatokhoz 200 ng riporter plazmidot transzfektáltunk AML-12 sejtekbe. Minden transzfekcióhoz azonos mennyiségű DNS-t használtunk megfelelő vektor DNS hozzáadásával. Harminchat óra múlva a sejteket további 12 órán át OA-val vagy anélkül kezeltük. A relatív luciferáz aktivitásokat a Dual Luciferase System (Promega, Madison, WI, USA) alkalmazásával határoztuk meg. Az adatok legalább 3 független kísérletet reprezentáltak.
mRNS degradációs elemzés
A stabilitás Pgc ‐ 1β Az mRNS-t α-amanitin (α-AMA) üldözési kísérletekkel mértük. Az egér elsődleges májsejtjeit DMEM-ben inkubáltuk, amely a-AMA-t (15 µM; Sigma-Aldrich) tartalmazott OA-val vagy anélkül (10 µM). A sejteket a megadott időpontokban gyűjtöttük össze, és qRT-PCR elemzésnek vetettük alá.
miRNS mikroarray és bioinformatikai elemzések
A miRNS-ek azonosítása, amelyek potenciálisan közvetítik a Pgc ‐ 1β Az OA által indukált mRNS-lebontás miRNS mikroarray elemzést hajtottunk végre (Affymetrix GeneChip miRNS 4.0 tömb; Gene Tech, Shanghai, Kína) olyan májminták felhasználásával, amelyeket OA akut injekciót kapott egerekből izoláltunk. Az adatok előállításakor webalapú bioinformatikai predikciós algoritmusokat (miRanda és TargetScan) használtak a miRNS kiválasztására, amelyek megcélozták Pgc ‐ 1β 3 ′ UTR régió.
Pgc ‐ 1β 3 ′ UTR luciferáz riporter konstrukció
Az egér 3 'UTR régiója (536 nt) Pgc ‐ 1β A miR-98-5p 2 feltételezett célhelyét tartalmazó cDNS-t PCR-rel amplifikáltuk a következő primerek alkalmazásával: (előre) 5′ – GGCGGTCTCGAGATATCAGCCTTAACCTTCG – 3 ′; (fordított) 5′ – AATGCGGCCGCAATCAGAGCCATAAATACA – 3 ′, Xhoén és NemRestrikciós enzim vágási helyeket, közvetlenül a luciferáz géntől lefelé a pmiR-RB-jelentés vektorban (RiboBio). A tökéletes komplementaritás helyeiről 7 bp mutációjú kettős mutáns változatot (TACCTCA AGTTAGT-re mutálódott) is létrehoztak. A vad típusú (WT) és mutáns inszerteket szekvenálással igazoltuk. A transzfekcióhoz 200 ng WT vagy mutáns riportervektort transzfektáltunk AML-12 sejtekbe miR-98-5p utánzókkal vagy inhibitorokkal együtt (a RiboBio tervezte és szintetizálta). A sejteket ezután OA-val (10 uM) vagy anélkül 12 órán át kezeltük. Relatív luciferázaktivitások (a Renilla luciferáz szignál normalizálódott szentjánosbogár luciferázt) 48 órával a transzfekció után határoztuk meg. Minden transzfekcióhoz azonos mennyiségű DNS-t és utánzókat/inhibitorokat használtunk megfelelő vektorok hozzáadásával. Az összes transzfekciós kísérletet három példányban hajtottuk végre.
Statisztikai analízis
Az adatcsoportok átlagként ± sd. Az adatokat egyutas ANOVA alkalmazásával elemeztük, amelyet Fisher LSD-je követett post hoc teszt. A számításokat az Origin 8 (8.6-os verzió; OriginLab, Northampton, MA, USA) felhasználásával végeztük. Értéke P
EREDMÉNYEK
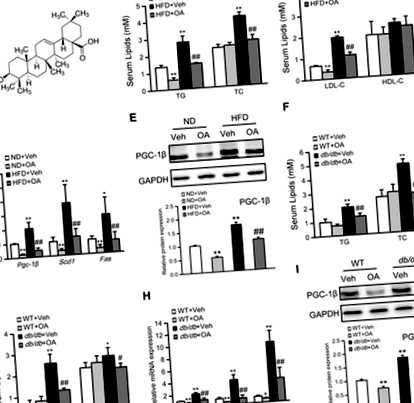
Az OA-val végzett akut és krónikus kezelések gátolják a máj PGC ‐ 1β expresszióját
A PGC ‐ 1 β gátlása közvetíti a TG redukcióját az OA által
Az OA sejt autonóm módon gátolja a PGC-1β expressziót
Mivel a PGC ‐ 1β-t az OA robusztusan szabályozhatja in vivo, legközelebb azt vizsgáltuk, hogy létezik-e ilyen szabályozás a tenyésztett egér primer hepatocitákban is. Amint az az S2 kiegészítő ábrán látható, a CCK-8 elemzés azt mutatta, hogy az OA nem volt mérgező a sejtekre, amikor a koncentráció
Az OA felgyorsul Pgc ‐ 1β mRNS lebomlás
miR-98-5p közvetíti az OA-indukálta Pgc ‐ 1β mRNS lebomlás
VITA
Bár korábbi vizsgálatok azt mutatták, hogy a természetes szerek képesek szabályozni a miRNS expresszióját, a legtöbbjük erősen leíró jellegű, és csak ezeknek a szereknek a miRNS expresszió szintjére gyakorolt hatásáról számol be - ez a vizsgálatunk korlátja is. Jelenleg még nem ismert, hogy az OA miként szabályozza a miR-98-5p-t. Egyrészt, tekintettel arra, hogy a miRNS expresszióját befolyásolhatják az epigenetikai változások, és hogy az OA csökkentette a hiszton 3H foszforiláció szintjét, érdekes megvizsgálni, hogy az OA befolyásolja-e a miRNS expresszióját keresztül epigenetikai módosítások (58). Másrészt meg kell jegyezni, hogy az OA orális beadása nem volt olyan hatékony, mint az intraperitoneális vagy a szubkután injekció a gyulladásos reakciók gátlásában, ami azt sugallja, hogy az OA farmakológiai funkcióinak végrehajtásához fontos az adagolási út (59). Valóban, az alacsony vízoldékonyság, gyenge in vivo a természetes szerek biohasznosulása és elfogadhatatlan farmakokinetikai profilja gyakran korlátozza hatékonyságukat terápiás szerként (60). Ezért izgalmas kutatási terület az OA szintetikus analógjainak fejlesztése a szerkezet-aktivitás vizsgálat és a hatékonyabb beadási út, például az OA liposzómával vagy nanorészecskékkel történő kapszulázása.
Összefoglalva megállapítottuk, hogy az OA hipolipidémiás hatását a miR-98-5p/PGC-1β tengely közvetíti HFD-indukált hiperlipidémiás egerekben. Beszámoltak arról, hogy az OA egyéb jótékony hatással van az energia-anyagcserére, például enyhíti a hiperglikémiát és az inzulinrezisztenciát. Ez a vegyület tehát ígéretes szer az anyagcsere-rendellenességek, köztük a hiperlipidémia kezelésére.
KÖSZÖNETNYILVÁNÍTÁS
Ezt a munkát a Kínai Nemzeti Alapkutatási Program (973 Program; 2013CB911600), a Kínai Nemzeti Természettudományi Alapítvány (31422028, 31271261, 31401009, 81373303, 81473080 és 81573299), a Tízezer tehetség program, a természettudomány támogatásával támogatják. Kína Jiangsu tartományának alapítványa (BK20140041), Hat tehetség csúcstalálkozó projekt, 333 tehetség projekt (BRA2015323), Jiangsu posztdoktori kutatási finanszírozási terv (1601020A), a Kardiovaszkuláris Betegségek Translációs Orvostudományának Együttműködési Innovációs Központja (Nanjing Medical University) és a Priority Academic Jiangsu felsőoktatási intézmények programfejlesztése. A szerzők nem jelentenek összeférhetetlenséget.
A SZERZŐ HOZZÁJÁRULÁSAI
S. Chen, J. Liu és C. Liu kutatásokat tervezett; S. Chen, X. Wen és W. Zhang elvégezték a kutatást; S. Chen, X. Wen, J. Liu és C. Liu elemezték az adatokat; C. Wang és J. Liu reagenseket biztosított; valamint S. Chen és C. Liu írták a lapot.
- A magas triglicerid- és húgysavszint szabályozása
- Magas ólomszint terhesség alatt, a gyermek elhízásával összefüggésben A folsav csökkentheti az elhízás kockázatát
- Magas dózisú folsav a perikoncepciós periódusban, és a terhesség alatt az alacsony testsúly kockázata
- A magas savtartalmú étrendnek negatív hatása lehet a vesék egészségére - ScienceDaily
- Kisgyermekek magas húgysavszintje később magasabb vérnyomást eredményezhet - ScienceDaily