Az ösztrogén lehetséges terápiás alkalmazása a nem alkoholos zsírmájbetegség/nem alkoholos szteatohepatitis nemi egyenlőtlenségeiben
Chanbin Lee
1 Integrált Biológiai Tudományok Tanszék, Pusan Nemzeti Egyetem, 63–2, Pusandaehak-ro, Geumjeong-gu, Pusan 46241, Korea; rk.ca.nasup@201bcl (C.L.); rk.ca.nasup@nueij (J.K.)
Jieun Kim
1 Integrált Biológiai Tudományok Tanszék, Pusan Nemzeti Egyetem, 63–2, Pusandaehak-ro, Geumjeong-gu, Pusan 46241, Korea; rk.ca.nasup@201bcl (C.L.); rk.ca.nasup@nueij (J.K.)
Youngmi Jung
1 Integrált Biológiai Tudományok Tanszék, Pusan Nemzeti Egyetem, 63–2, Pusandaehak-ro, Geumjeong-gu, Pusan 46241, Korea; rk.ca.nasup@201bcl (C.L.); rk.ca.nasup@nueij (J.K.)
2 Biológiai Tudományok Tanszék, Pusan Nemzeti Egyetem, 63–2, Pusandaehak-ro, Geumjeong-gu, Pusan 46241, Korea
Absztrakt
1. Bemutatkozás
2. A NAFLD/NASH patogenezise
A felesleges zsír felhalmozódása a májban oxidatív stresszt és/vagy endoplazmatikus retikulum stresszt eredményez, és végül sejtdiszfunkcióhoz és apoptózishoz vezet [63,64,65]. A lipotoxicitás által károsított hepatociták apoptózison mennek keresztül, és ezek a haldokló hepatociták reaktív oxigénfajtákat (ROS), károsodáshoz kapcsolódó molekuláris mintázatokat, sonic hedgehog ligandumokat stb. Termelnek [66,67,68,69]. Ezek a felszabadító tényezők tovább stimulálják a gyulladásos reakciókat a rezidens makrofágok aktiválásával és fibrotikus helyreállítást váltanak ki a májban [70,71,72]. Mivel a hepatociták a máj fő parenchimasejtjei, amelyek a máj fő funkcióit látják el, a hepatociták súlyos elvesztése és a nem parenchymás sejtek, például a Kupffer-sejtek, a májstellátum-sejtek (HSC-k) és az őssejtek későbbi kompenzációs proliferációja májvesztést eredményez. funkció és májelégtelenség, végül életvesztés [73,74,75]. Ezért a májsejtek halálának megelőzése a lipidanyagcsere szabályozásával terápiás stratégia lehet a NASH kezelésében.
3. Ösztrogén és ösztrogén jelzés a májban
Az A1 villás doboz fehérje (FOXA1) nukleoszomális átrendeződés indukálásával befolyásolja az ösztrogén/ERα komplex aktivitását, amely lehetővé teszi az ösztrogén/ERα komplex számára a célgének promóter-proximális régióinak könnyű felmérését [113, 114, 115, 116]. A májban a FOXA1 közismerten részt vesz a májsejtekben a lipidfelhalmozódás gátlásában a TG szintézisének gátlásával és a β-oxidáció elősegítésével [117]. Egy tanulmány kimutatta, hogy a FOXA1 expressziója az egészséges májban magasabb volt a nőknél, mint a férfiaknál, és szintje csökkent az NAFL-ben az egészséges májhoz képest [117]. Ezek az eredmények azt jelzik, hogy a FOXA1 összefüggésbe hozható a nemek közötti egyenlőtlenséggel a NAFLD fejlesztésében. Li és mtsai. kimutatta, hogy a FOXA1/2 meghatározó szerepet játszott a HCC fejlődésének nemi dimorfizmusában azáltal, hogy bemutatta a FOXA1/2 protektív hatását nőstény egerekben a dietil-nitrozamin (DEN) által kiváltott HCC-fejlődésből [113]. A genom egészére kiterjedő elemzés kimutatta, hogy az ERα célgénjei nagyrészt átfedésben vannak az FOXA1/2 génjeivel, és a FOXA1/2 és az ERα kölcsönhatása fontos a HCC-rezisztenciával kapcsolatos gének expressziójának modulálásában. Nincs azonban közvetlen bizonyíték a FOXA1 és az ösztrogének összekapcsolására a NAFLD/NASH patogenezisében, és további vizsgálatokra van szükség.
4. Nemek közötti különbségek a NAFLD/NASH-ban
A NAFLD patogenezise magában foglalja a zsír felhalmozódásától a hepatocita haláláig, a gyulladásig és a fibrózisig terjedő szakaszokat [37,54]. A lipotoxicitás által kiváltott hepatocita-halál a fő jellemzője a NAFL NASH-ban való előrehaladásának [38]. Gyulladásos és fibrotikus válaszhoz is társul [66,69]. Tekintettel a NAFLD nagyobb gyakoriságára a férfiaknál, mint a nőknél, és a menopauza és a menopauza utáni nőknél fokozott kockázatnak [28, 29], úgy tűnik, hogy az ösztradiol megvédi a májat a májkárosodásoktól a lipidek felhalmozódásának, gyulladásának és fibrózisának elnyomásával. Ezért meg kell érteni az ösztrogének hatását a máj sérülésre adott válaszában, hogy feltárja a nemi különbséget a NAFLD/NASH-ban, és kidolgozzon egy nemi alapú terápiás stratégiát. Ebben a szakaszban összefoglaltuk és megvitattuk a nemek, a reproduktív állapot és az ösztradiol hatásait a NAFLD/NASH progressziójára.
4.1. Lipid felhalmozódás és lipotoxicitás
Ha a zsírsavakat vagy túlzott mennyiségben szállítják, vagy károsodik az ártalmatlanításuk, szubsztrátumokként szolgálhatnak az endoplazmatikus retikulum stresszt és hepatocelluláris károsodást kiváltó lipotoxikus fajok előállításához [67]. Így a máj metabolizmusának zavara a toxikus lipidek túlzott felhalmozódásához vezet a hepatocitákban. A lipotoxicitás a májsejtek diszfunkciójának és az azt követő hepatocelluláris halál egyik fő oka, amely a NASH progressziójához vezet [9,68,118]. A felhalmozódó bizonyítékok arra utalnak, hogy a hatalmas hepatocita halál kulcsfontosságú kórokozó tényező, amely hozzájárul a májgyulladáshoz és a fibrogenezishez a NASH progressziója alatt [8,9]. Lipotoxicitás esetén a károsodott vagy haldokló hepatociták sokféle citokint szabadítanak fel, amelyek aktiválják a gyulladásos sejteket és a HSC-ket [8,69]. Ezért a lipotoxicitást és az azt követő hepatocelluláris halált fontos kapcsolatnak tekintik a NAFL és a NASH között [119]. Ezért meg kell tisztázni a nemi különbségeket a lipotoxicitás által kiváltott hepatocelluláris károsodásban és az ösztradiol hepatocita túlélésre gyakorolt hatását, hogy megértsük a NAFLD/NASH nemi különbségeit.
4.2. Májgyulladás
A gyulladás bonyolultan kapcsolódik a hepatocelluláris halálhoz [129]. A lipidfelhalmozódás által okozott sérült hepatociták parakrin ingereket szabadítanak fel a májgyulladás kiváltására, amely a fibrózist kíséri, és végül felgyorsítja az átmenetet a NAFL-ről a NASH-ra [65,66,72,130]. Így a fibrózisos gyulladás a NASH fő jellemzője [131]. A májgyulladás szabályozásában közismerten közreműködő Kupffer-sejtek a NAFLD korai szakaszában gyorsan tágulnak citokinek és kemokinek, például interleukin-1β (IL-1β), interleukin-6 (IL-6), tumor nekrózis faktor kiválasztásával. -α (TNF-a), monocita kemoattraktáns protein-1 (MCP-1) és kemokin (CC motívum) 5 ligandum (CCL5), a gyulladásgátló válasz kiváltásához [70,132,133,134]. A vérből származó monociták és a csontvelőből származó neutrofilek szintén hozzájárulnak a NASH iniciálásához és progressziójához azáltal, hogy elősegítik a gyulladásgátló mediátorok, például az IL-6 és a TNF-a termelését [135].
4.3. Máj fibrózis
5. Nemi alapú terápia a NAFLD/NASH számára
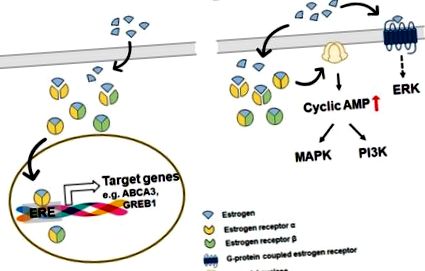
Az ösztrogén májban kifejtett védőhatásainak sematikus ábrázolása. A séma bemutatja az ösztrogén hepatoprotektív hatásait az alkoholmentes zsírmájbetegség (NAFLD) ellen. Az ösztrogének kötődnek a májsejtekben található ösztrogénreceptorokhoz (ER) és transzlokálódnak a célsejtek magjába, ahol szabályozzák a génexpressziót. Hepatocitákban az ERα-hoz kötődő ösztrogén (sárga színnel) enyhíti a lipotoxikus stresszt ezekben a sejtekben azáltal, hogy elnyomja a de novo lipogenezist és elősegíti a β-oxidációt. Az ösztrogén/ERα csökkenti a de novo lipogenezissel kapcsolatos gének, például zsírsavszintetáz (FAS), acetil-CoA karboxiláz (ACC), sztearoil-CoA deszaturáz (SCD) és szterin szabályozó elemet megkötő fehérje (SREBP) expresszióját és növeli a β-oxidációval kapcsolatos gének, például a karnitin-palmitoil-transzferáz 1 (CPT1) expresszióját. Az ösztrogén kötődik az ERα-hoz a Kupffer-sejtekben, amelyek májban rezidens makrofágok. Az ösztrogénhez kötött ERα gátolja az IL-6 termelését és a gyulladásgátló citokinek szekrécióját ezekben a sejtekben, végül csökkentve a gyulladást. HSC-kben az ERβ-hoz kötött ösztrogének az apoptózissal kapcsolatos géneket szabályozzák, és a profibrotikus géneket - például az α-simaizom aktint (α-SMA), a kollagént és a mátrix metallopeptidázokat (MMP)) csökkentik, csökkentve a májfibrózist.
6. Következtetések
Szerző közreműködései
C.L., J.K. és Y.J. hozzájárultak a tanulmány elkészítéséhez és megtervezéséhez, az irodalom áttekintéséhez és elemzéséhez, valamint a kézirat elkészítéséhez és szerkesztéséhez; Y.J. kapott támogatást.
Finanszírozás
Ezt a munkát a Koreai Nemzeti Kutatási Alapítvány (NRF) támogatta, amelyet a koreai kormány (MSIT) (2018R1A2A3075038) finanszírozott Youngmi Jung számára.
Összeférhetetlenség
A szerzők nem jelentenek összeférhetetlenséget.
- A módosított Parkinson-gyógyszer nem alkoholos zsírmájbetegség kezelésében mutatkozik meg
- Mediterrán étrend és alkoholmentes zsírmájbetegség
- Az alkoholmentes zsírmájbetegség és a szív- és érrendszeri betegségek ideje elérkezik a kardiológusokhoz
- A mediterrán étrend és a fizikai alkoholmentes zsírmájbetegség (NAFLD) megelőzési szerepe
- Alkoholmentes zsírmájbetegség (NAFLD) GASTROINTESTINAL; A TIDEWATER MÁJSpecialistái, PLLC