Az oxidatív stressz szerepe a hipoxiának és endotoxinnak kitett újszülött patkányok akut vesekárosodásában
A.N. Belozersky Fizikai-Kémiai Biológiai Intézet, M.V. Lomonoszov Moszkvai Állami Egyetem, Oroszország
V. I. Kulakov Szülészeti, Nőgyógyászati és Perinatológiai Kutatóközpont, Orosz Föderáció Egészségügyi Minisztériuma, Moszkva, Oroszország
Levelezés
E. Y. Plotnikov vagy D. B. Zorov, Lab. A mitokondrium szerkezete és funkciói, A.N. Belozersky Intézet, Lomonoszov Moszkvai Állami Egyetem, Moszkva 119992, Oroszország
Fax: +7 495 939 3180
Tel .: +7 495 939 5944
A.N. Belozersky Fizikai-Kémiai Biológiai Intézet, M.V. Lomonoszov Moszkvai Állami Egyetem, Oroszország
Orosz Kardiológiai Kutató és Termelő Központ, Moszkva, Oroszország
A.N. Belozersky Fizikai-Kémiai Biológiai Intézet, M.V. Lomonoszov Moszkvai Állami Egyetem, Oroszország
V. I. Kulakov Szülészeti, Nőgyógyászati és Perinatológiai Kutatóközpont, Orosz Föderáció Egészségügyi Minisztériuma, Moszkva, Oroszország
A.N. Belozersky Fizikai-Kémiai Biológiai Intézet, M.V. Lomonoszov Moszkvai Állami Egyetem, Oroszország
V. I. Kulakov Szülészeti, Nőgyógyászati és Perinatológiai Kutatóközpont, Orosz Föderáció Egészségügyi Minisztériuma, Moszkva, Oroszország
Nemzetközi Lézerközpont, M.V. Lomonoszov Moszkvai Állami Egyetem, Oroszország
A.N. Belozersky Fizikai-Kémiai Biológiai Intézet, M.V. Lomonoszov Moszkvai Állami Egyetem, Oroszország
A.N. Belozersky Fizikai-Kémiai Biológiai Intézet, M.V. Lomonoszov Moszkvai Állami Egyetem, Oroszország
V. I. Kulakov Szülészeti, Nőgyógyászati és Perinatológiai Kutatóközpont, Orosz Föderáció Egészségügyi Minisztériuma, Moszkva, Oroszország
V. I. Kulakov Szülészeti, Nőgyógyászati és Perinatológiai Kutatóközpont, Orosz Föderáció Egészségügyi Minisztériuma, Moszkva, Oroszország
A.N. Belozersky Fizikai-Kémiai Biológiai Intézet, M.V. Lomonoszov Moszkvai Állami Egyetem, Oroszország
V. I. Kulakov Szülészeti, Nőgyógyászati és Perinatológiai Kutatóközpont, Orosz Föderáció Egészségügyi Minisztériuma, Moszkva, Oroszország
Levelezés
E. Y. Plotnikov vagy D. B. Zorov, Lab. A mitokondrium szerkezete és funkciói, A.N. Belozersky Intézet, Lomonoszov Moszkvai Állami Egyetem, Moszkva 119992, Oroszország
Fax: +7 495 939 3180
Tel .: +7 495 939 5944
A.N. Belozersky Fizikai-Kémiai Biológiai Intézet, M.V. Lomonoszov Moszkvai Állami Egyetem, Oroszország
V. I. Kulakov Szülészeti, Nőgyógyászati és Perinatológiai Kutatóközpont, Orosz Föderáció Egészségügyi Minisztériuma, Moszkva, Oroszország
Levelezés
E. Y. Plotnikov vagy D. B. Zorov, Lab. A mitokondrium szerkezete és funkciói, A.N. Belozersky Intézet, Lomonoszov Moszkvai Állami Egyetem, Moszkva 119992, Oroszország
Fax: +7 495 939 3180
Tel .: +7 495 939 5944
A.N. Belozersky Fizikai-Kémiai Biológiai Intézet, M.V. Lomonoszov Moszkvai Állami Egyetem, Oroszország
Orosz Kardiológiai Kutató és Termelő Központ, Moszkva, Oroszország
A.N. Belozersky Fizikai-Kémiai Biológiai Intézet, M.V. Lomonoszov Moszkvai Állami Egyetem, Oroszország
V. I. Kulakov Szülészeti, Nőgyógyászati és Perinatológiai Kutatóközpont, Orosz Föderáció Egészségügyi Minisztériuma, Moszkva, Oroszország
A.N. Belozersky Fizikai-Kémiai Biológiai Intézet, M.V. Lomonoszov Moszkvai Állami Egyetem, Oroszország
V. I. Kulakov Szülészeti, Nőgyógyászati és Perinatológiai Kutatóközpont, Orosz Föderáció Egészségügyi Minisztériuma, Moszkva, Oroszország
Nemzetközi Lézerközpont, M.V. Lomonoszov Moszkvai Állami Egyetem, Oroszország
A.N. Belozersky Fizikai-Kémiai Biológiai Intézet, M.V. Lomonoszov Moszkvai Állami Egyetem, Oroszország
A.N. Belozersky Fizikai-Kémiai Biológiai Intézet, M.V. Lomonoszov Moszkvai Állami Egyetem, Oroszország
V. I. Kulakov Szülészeti, Nőgyógyászati és Perinatológiai Kutatóközpont, Orosz Föderáció Egészségügyi Minisztériuma, Moszkva, Oroszország
V. I. Kulakov Szülészeti, Nőgyógyászati és Perinatológiai Kutatóközpont, Orosz Föderáció Egészségügyi Minisztériuma, Moszkva, Oroszország
A.N. Belozersky Fizikai-Kémiai Biológiai Intézet, M.V. Lomonoszov Moszkvai Állami Egyetem, Oroszország
V. I. Kulakov Szülészeti, Nőgyógyászati és Perinatológiai Kutatóközpont, Orosz Föderáció Egészségügyi Minisztériuma, Moszkva, Oroszország
Levelezés
E. Y. Plotnikov vagy D. B. Zorov, Lab. A mitokondrium szerkezete és funkciói, A.N. Belozersky Intézet, Lomonoszov Moszkvai Állami Egyetem, Moszkva 119992, Oroszország
Fax: +7 495 939 3180
Tel .: +7 495 939 5944
Absztrakt
Rövidítések
Bevezetés
Az újszülött csecsemők nagyon érzékenyek a vese ischaemiára, és tartós és tartós akut tubuláris vagy kortikális nekrózis alakul ki további parenchymás ödéma és a nekrotikus tubulus hámsejtek csőszerű lumenbe történő elnyúló hatásával [9]. Lehetséges, hogy mindez annak köszönhető, hogy az újszülött vese éretlen a születéskor, és a funkcionális érés folytatódik a posztnatális időszakban [10]. .
Az ischaemia által kiváltott vesekárosodás ezen kóros mechanizmusai univerzálisak, azonban eltérőek lehetnek, ha összehasonlítjuk a hipoxia felnőtt és újszülött patkányok veséjére gyakorolt hatását. Ez utóbbiakról kiderült, hogy reverzibilis sejtkárosodást szenvednek, míg felnőtt patkányokban a vesetubulusok hámja tartósan elveszíti a reabsorpciós funkciót [11]. .
Az újszülöttek normális és patológiás állapotában kialakuló vese működésének sajátosságai különböző követelményeket határoznak meg a károsodás markereivel szemben [12, 13]. Például az élet első napjaiban bekövetkezik a veseműködés kialakulása, és a fiziológiás oliguria elhomályosíthatja az AKI-t. A veseelégtelenség klasszikus markerei a kreatinin és a karbamid csak a sérülés késői markereivé válnak, amelyek nagymértékben függenek az étrendtől, a vázizom funkcióitól és a vese működésének stabilitásától [13]. Az újszülöttek megnövekedett szérum kreatininszintjének megfigyeléséhez a funkcionális nephronok körülbelül 75% -ának elvesztése szükséges (felnőtteknél - 50%), és emelkedése csak 24–48 óra múlva figyelhető meg. Ennek megfelelően az AKI új markerei: a neutrofil zselatinázzal társult lipokalin (NGAL) és a vesekárosodás-molekula-1 (KIM-1) a klinikákon elkezdődött, és alkalmazásuk a neonatológiában ésszerűnek tűnik, ha indokolt [14]. .
Az új markerek vizeletben történő növekedésének specifitása, érzékenysége és időzítése nélkülözhetetlenné teszi őket a klinikai gyakorlatban: az NGAL alkalmazása fokozatosan beépül a rutin diagnosztikai eljárásba kontrasztos nephropathia alatt, de használatuk az újszülöttekben még mindig kísérleti jellegű, és további vizsgálatokra van szükség.
Ebben a tanulmányban felmértük az újszülött patkányok újszülött AKI modellként történő felhasználásának lehetőségét, amelyet az endotoxin [(lipopoliszacharid (LPS)] által okozott hipoxia és szisztémás gyulladás indukál. A cél az volt, hogy betekintést nyerjünk a vesekárosodás mechanizmusaiba kísérleti nephropathiában. oxidatív stressz-relevanciával és antioxidánsok alkalmazásával a nephroprotection érdekében.
Eredmények
Akut vesekárosodás újszülötteknél hipoxia és LPS kezelés után
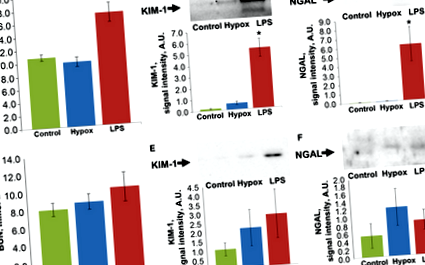
Az LPS injekció és a patkányok teljes oxigénhiánya akut vesekárosodáshoz vezetett. Huszonnégy órával az LPS beadása után a vér karbamid-nitrogénjének (BUN) jelentős növekedését figyelték meg, míg a hipoxia alatt a BUN szintje nem változott (1A. Ábra). Míg ezzel a mutatóval a veseelégtelenséget csak az LPS-nek való kitettség után figyelték meg, a vizeletben kimutatott egyéb karbamid AKI markerek, az NGAL és a KIM-1 kimutatták a vesekárosodás jelenlétét mindkét csoportban (1B, C ábra). Huszonnégy órával a hipoxia után a vizeletben a KIM-1 növekedése kicsi volt, de statisztikailag szignifikánsP ≤ 0,05), míg az LPS bevezetése után az NGAL és a KIM-1 szintje sokszorosára nőtt (P
A veseszövet hisztopatológiai változásai hipoxia és LPS kezelés után
A szövettani vizsgálat feltárta mind a hipoxia, mind az LPS injekció által kiváltott változásokat a vese morfológiájában (2A, B ábra). A vesében a hipoxia és az LPS után 24 órával megfigyelt változások súlyos tubuláris dilatációt jeleznek, amelyet a tubuláris lumen területének növekedéseként (2C. Ábra) és a tubulusok megnövekedett átlagos területének a medullában mérnek (2D ábra). Ezenkívül az LPS és a Hypoxia csoportokban a glomerulusok által elfoglalt terület jelentősen csökkent (2E. Ábra), ami a glomeruláris szklerózis kialakulására utalhat. 72 órával az LPS vagy a hipoxia expozíciója után a kóros változások már kisebb mértékben megnyilvánultak (3. ábra). Jelentős különbségeket csak a medulla tubulusainak területén észleltünk (3D ábra) és csak az LPS-sel kezelt csoportban.
Az LPS kezelés oxidatív stresszt indukál az újszülött vesében
Mivel kiderült, hogy az újszülött patkányok veséjére a legkárosítóbb hatást az LPS indukálta, további kísérleteket hajtottunk végre ezzel a modellel. Megfigyeltük, hogy a reaktív oxigénfajok (ROS) termelése, amelyet DCF fluoreszcencia detektál a kéreg vitális szakaszaiban, szignifikánsan magasabb volt az LPS-nek kitett kölykök veséjében, összehasonlítva a kontrollokkal (4A, B ábra), amely az oxidatív stressz kialakulását bizonyítja.
N‐Acetil-cisztein (NAC) megmenti a vesét az LPS káros hatásaitól
Vita
Ebben a vizsgálatban újszülött patkányokat használtak az újszülött AKI modelljében, amelyet különböző tényezők váltottak ki, amelyek a klinikai gyakorlatban leggyakrabban előfordulnak, nevezetesen a teljes hipoxia (a magzati hipoxia és az újszülöttkori asphyxia analógjaként) és az LPS bevezetése, szimulálva az újszülöttek szepszisét . Nyilvánvaló, hogy az állatokon, és különösen a patkányokon kapott bármely kísérleti adat emberre fordításának alapja a csecsemő ember és patkány veséjének nephrogenesisének és fiziológiájának összehasonlítása, ami végső soron befolyásolja a károsodás és a helyreállítás mechanizmusait. a vese.
A peri- és újszülött patológiák, például a placenta megszakadása, az intrapartum hypoxia, az asphyxia, a szepszis, a véráramlás centralizációjához és végső soron a szervek, például a vese ischaemia/reperfúziós károsodásához vezethetnek. Széles körben elfogadott, hogy a reperfúziós sérülés oxidatív stresszel társul, amelyet elsősorban a mitokondriális diszfunkció okoz [20, 21]. Sőt, a mitokondriális rendszer hasonló károsodása, valamint az ROS és más szabad gyökök hiperprodukciója figyelhető meg a vesében más patológiák, például toxikus myoglobinuria vagy pyelonephritis esetén [22]. Feltételezhetjük, hogy ez a kóros mechanizmus univerzális és jól bevált felnőtt állatok veséjében, de hasonló jelenségeket írtak le patkánykölykök vesekárosodására, például hiperoxiás vesekárosodás esetén, ami fibrózishoz vezet [23] és intrauterin asphyxia okozó AKI [24]. Ha azonban összehasonlítjuk a hipoxia felnőtt és újszülött patkányok veséjére gyakorolt hatását, az utóbbi reverzibilis sejtkárosodást mutatott, míg felnőtt patkányokban a vesetubulusok hámja következetesen elveszíti a visszaszívódási funkciót [11]. .
Az LPS által okozott újszülött vesekárosodás mechanizmusainak további vizsgálata feltárta az oxidatív stressz fő szerepét ebben a folyamatban. Az LPS 3 órás intraperitoneális beadása után megnövekedett ROS termelést detektáltunk a patkányok vese tubulusaiban. Ez azt jelzi, hogy az oxidatív stressz okozhatja a vesekárosodást, míg a vesekárosodás markereit ebben az időszakban még nem lehet kimutatni a vizeletben (az adatokat nem mutatjuk be). Ezek az adatok jól egyeznek az ismert tényekkel az oxidatív vesekárosodás szerepéről a szepszisben és a SIRS-ben felnőtt állatokban [27, 28]. Az oxidatív stressz elsődleges szerepe alapján megkíséreltük az LPS által kiváltott nephropathiát antioxidáns NAC-tal gyógyítani. A NAC a klasszikus antioxidánsok egyike, amelyet a kísérleti vizsgálatok során használnak, és nephroprotektív hatásait számos olyan oxidatív robbanással járó modellben bizonyították, mint például a vese ischaemia [29], rabdomyolysis [30] és gentamicin által kiváltott nephropathia [31] .
Anyagok és metódusok
Állatkísérletek
A munkában kinyújtott fehér patkányokat használtak állattartó létesítményben, 12 órás fényciklussal, állandó hőmérsékleten (22 ± 2 ° C). A kísérleteket a laboratóriumi állatok elhelyezésére és gondozására vonatkozó etikai előírásoknak és ajánlásoknak megfelelően hajtották végre, amelyekre az állatok kísérleti vizsgálatokhoz történő felhasználásáról szóló 2010/63/EU európai közösség tanácsi irányelvek vonatkoznak. Az alomban lévő kölykök száma 9–12 volt. A kísérleteket mindkét nem 7 napos, 9–14 g tömegű kölykein végezték.
Hypoxiás és szeptikus károsodás modellezése
Az azonos alomból származó patkánykölyköket véletlenszerűen három csoportba osztották: Kontroll, ép állatok; Hypoxia, hypoxiás patkányok; LPS, patkányok, akik LPS injekciót kaptak. Minden csoportban összesen 12 állat volt (különböző almokból). A Hypoxia csoportban a patkányokat 2 órán át szisztémás hypoxiának vetettük alá multigazos NewBrunswick inkubátorban, 8% oxigént és 92% nitrogént tartalmazó atmoszférában, 37 ° C hőmérsékleten. Az LPS-csoportba tartozó állatokat intraperitoneálisan injektáltuk Escherichia coli 0127: B8 törzs (Sigma-Aldrich, St. Louis, MO, USA) 4 mg · kg –1 dózisban. Az expozíció után az állatokat visszavitték anyjukhoz, és 24 és 72 óra múlva vér- és vizelet- és vesemintákat vettek Western-blot-vizsgálatra és szövettani vizsgálatra.
Western blottolás
A vesekárosodás, a KIM ‐ 1 és az NGAL markereinek elemzéséhez a kezelés után 24 és 72 órával a kölykökből gyűjtött vizeletet használtuk. A mintavételhez a vizeletet négyszeresére hígítottuk 10% 2-merkaptoetanolt tartalmazó mintapufferben. A mintákat 5 percig forraljuk, és 20 μl mintát helyezünk a gél lyukába.
A sejtproliferáció markerét, a PCNA-t detektálták egy vese homogenizátumában. Az állatot eutanizálták, majd a veséket eltávolították és gyorsan lehűtötték PBS-ben. A veséket töredékekre zúztuk, majd 0,5 ml PBS-ben homogenizáltuk, amely 1 mmol/1 -1 proteáz inhibitor PMSF-t tartalmazott. A kapott homogenizátumot 1500 ° C-on centrifugáltuk g 3 percig a felülúszót összekevertük 4% mintapufferrel, amely 10% 2-merkaptoetanolt tartalmaz, és 5 percig forraljuk. A felülúszó alikvot részét használtuk a teljes fehérje koncentrációjának meghatározására egy bicinchonininsavon alapuló kereskedelmi készlet segítségével (Sigma-Aldrich). A gél minden egyes lyukja azonos mennyiségű fehérjét tartalmazott.
A fehérje elektroforézist poliakrilamid gélen, denaturáló körülmények között, Laemmli végezte. Az elválasztott fehérjéket félszáraz blottolással polivinilidén-difluorid membránra (Amersham Pharmacia Biotech, Rainham, Egyesült Királyság) vittük át. A membránokat 1 órán át 25 ° C-on PBS-ben 5% zsírmentes száraz tejjel és 0,05% Tween-20-tal blokkoltuk, NGAL, KIM-1 (Abcam, Cambridge, Egyesült Királyság) és PCNA (Abcam) elleni primer antitestekkel inkubálva. 1: 1000 hígítás PBS/BSA/Tween-20-ban, majd torma-peroxidázzal konjugált másodlagos antitestekkel, 1: 10000 hígítással PBS/Tween-20-ban. A sávokat kemilumineszcens szubsztrát segítségével detektáltuk a torma peroxidázzal fokozott kemilumineszcencia rendszerhez (ECL; Amersham Pharmacia Biotech). A kemilumineszcenciát ChemiDoc instrument MP Imaging System-rel (Bio-Rad, Hercules, CA, USA) detektáltuk, a kapott képeket a 6.0 image lab szoftver (Bio-Rad) segítségével elemeztük.
Vese szövettana
A vese az állat feláldozása után azonnal izolálásra került, jéghideg foszfáttal pufferolt sóoldattal mossuk, 10% -os pufferolt formalinban rögzítjük, paraffinba ágyazzuk és szövettani vizsgálathoz használjuk. Öt mikrométer vastag metszeteket vágunk, paraffinizálunk, hidratálunk, és hematoxilinnal és eozinnal festjük. A vese metszeteket vak módon vizsgáltuk Axiovert invertált mikroszkóppal (Carl Zeiss Inc., Jena, Németország). Minden vese tárgylemezén legalább 10 mezőt vizsgáltunk, és kóros súlyosságuk alapján pontoztunk. A morfometrikus elemzést imagej szoftver segítségével végeztük (NIH, Bethesda, MD, USA).
Konfokális mikroszkópia
A kísérleteket 20 ° C-on végeztük. A vese szeleteket Vibroslice rezgő mikrotómával (WPI, Sarasota, FL, USA) kaptuk, DMEM-ben mostuk és 10 μm DCF-DA-vel inkubáltuk 10 percig. A maradék DCF kimosása után a szeleteket LSM510 invertált konfokális mikroszkóppal (Carl Zeiss Inc.) készítettük. A fluorokróm beépülésének elemzését üvegfenekű edényekben végeztük gerjesztéssel 488 nm-nél és emissziót gyűjtöttünk 500–530 nm-en. A fotoindukált mitokondrium/sejt károsodásának a relatív fluoreszcencia intenzitáshoz való hozzájárulása minimalizálása érdekében a képelemzést csak az első négy vizsgálat átlagán végezték el. A képeket imageJ szoftver (NIH) segítségével dolgozták fel.
Statisztika
Minden adatot átlag ± SEM-ként adunk meg. A csoportok közötti összehasonlításokat Student's segítségével végeztük t teszttel és Mann – Whitney teszttel a P érték
Köszönetnyilvánítás
Ezt a munkát az RFBR 17-04-01045 támogatása támogatta.
Összeférhetetlenség
A szerzők kijelentik, hogy nincsenek összeférhetetlenségük.
Szerzői hozzájárulások
Az EYP kísérleteket tervezett, konfokális mikroszkópos kísérleteket végzett, elemezte az adatokat és szerkesztette a papírt; A TAP és a DNS állatkísérleteket végzett és elemezte a szövettani adatokat; Az IBP és az LDZ Western blot-ot végzett; A VNM szövettani vizsgálatot végzett; A GTS és a DBZ meghatározta a vizsgálat koncepcióját, felügyelte a kísérleteket, elemezte az irodalmat és megírta a kéziratot.
- A zsigeri hasi zsírmennyiség hatása az oxidatív stresszre és a Pr DMSO-ra
- Teljes kiőrlésű vese diéta - ideje átértékelni szerepüket a FullText - Vértisztítás
- A hüvelyesekkel dúsított terápiás életmódváltási étrend csökkenti az oxidatív stresszt a túlsúlyos 2. típusban
- A glikémiás indexnek van-e szerepe a cukorbetegség kezelésében
- A húgysav, a metabolikus szindróma és a vesebetegség American Society of Nephrology