Az ózonterápiában szerepet játszó hatásmechanizmusok: A gyógyulást enyhe oxidatív stressz indukálja?
Masaru Sagai
1 Tsukuba Egészséges Élet Intézet, Higashi Hiratuka 586-2, Tsukuba, Ibaraki, Japán
Velio Bocci
2 Élettani Tanszék, Viale A. Moro 2, 53100, Sienai Egyetem, Olaszország
Absztrakt
Az ózonterápia lehetséges hatásmechanizmusait ebben a cikkben tekintjük át. Az ózonterápia terápiás hatékonysága részben annak köszönhető, hogy az ózon több biológiai komponenssel történő reakciói által kiváltott szabályozott és mérsékelt oxidatív stressz alakul ki. Az ózon hatékonysága és toxicitása közötti határ az oxidatív stressz erősségétől függhet. A testmozgáshoz hasonlóan köztudott, hogy a mérsékelt testmozgás jót tesz az egészségnek, míg a túlzott testmozgás nem.
A súlyos oxidatív stressz aktiválja a kappa B (NFκB) nukleáris transzkripciós faktort, ami gyulladásos választ és szövetkárosodást eredményez a COX2, PGE2 és citokinek termelése révén. A mérsékelt oxidatív stressz azonban aktivál egy másik nukleáris transzkripciós faktort, a nukleáris faktor-eritroid 2-hez kapcsolódó 2-es faktort (Nrf2). Ezután az Nrf2 indukálja az antioxidáns válaszelemek (ARE) transzkripcióját. Az ARE átírása számos antioxidáns enzim, például SOD, GPx, glutation-s-transzferáz (GSTr), kataláz (CAT), hem-oxigenáz-1 (HO-1), NADPH-kinon-oxidoreduktáz (NQO) termelését eredményezi. -1), a gyógyszer-anyagcsere II. Fázisú enzimjei és a hősokk-fehérjék (HSP). A szabad antioxidánsok és az antioxidáns enzimek nemcsak védik a sejteket az oxidációtól és a gyulladástól, de képesek megfordítani a krónikus oxidatív stresszt. Ezen megfigyelések alapján az ózonterápia mérsékelt oxidatív stressz révén aktiválhatja az Nrf2-t is, és elnyomhatja az NFκB és a gyulladásos reakciókat. Ezenkívül az Nrf2 aktiválása védelmet nyújt a neurodegeneratív betegségek, például az Alzheimer- és a Parkinson-kór ellen. Az enyhe immunválaszokat más nukleáris transzkripciós faktorok indukálják, mint például az aktivált T-sejtek (NFAT) és az aktivált protein-1 (AP-1) nukleáris faktora.
Ezenkívül az ózonterápia hatékonysága érrendszeri megbetegedésekben egy másik nukleáris transzkripciós faktor, a hipoxiában indukálható 1a faktor (HIF-1a) aktiválásával is magyarázható, amelyet szintén mérsékelt oxidatív stressz indukál. A közelmúltban ezek a fogalmak széles körben elfogadottá váltak. Hangsúlyozzák az ózon sokoldalúságát az érrendszeri és degeneratív betegségek, valamint a gyermekek bőrelváltozásainak, herniás lemezének és elsődleges gyökérszuvasodásának kezelésében. További kutatások annak tisztázására, hogy az ózonterápia hatásmechanizmusai tartalmazzák-e a nukleáris transzkripciós faktorokat, például Nrf2, NFAT, AP-1 és HIF-1α.
Bevezetés
Ózonterápia, pontosabban a fő ózonozott autohemoterápia (O3-AHT), majdnem 40 éve használják. Az ózonterápiáról szóló első jelentést Wolff tette közzé 1974-ben [1]. Bár az ózonterápiát ma már az egész világon alkalmazzák, még nem minden országban elfogadták ortodox gyógyszerként.
Körülbelül két évtizeddel ezelőtt mind a nitrogén-oxidot (NO), mind a szén-monoxidot (CO) csak mérgező légszennyezőnek vagy cigarettafüstből származó gáznak tekintették. Ma azonban esszenciális gázoknak tekintik őket, mivel mind a NO, mind a CO felelős a testen belüli nagyon fontos fiziológiai hatásokért [2-4]. Hasonlóképpen, a mérgező gáz hidrogén-szulfidját ma már gyógyszerként használják csontritkulás kezelésében [5,6]. Ezen túlmenően az alacsony dózisú sugárzásnak jótékony hatásai is vannak a sugárzott sejtekben, különösen azáltal, hogy a hormonmechanizmus révén meghosszabbítják a sejtek élettartamát [7]. Így úgy tűnik, hogy a toxikus vegyületek és azok testen belüli hatásainak megértése folyamatosan változik, mivel rájöttünk, hogy a toxicitás teljes mértékben az adagolástól függ.
A testmozgás és a kalóriakorlátozás egyaránt kiváló példa a hormonális hatásra [8]. Köztudott, hogy a mérsékelt testmozgás jótékony hatással van az egészségre. Ezenkívül a kalóriakorlátozás közismerten késlelteti a betegség kialakulását és a mortalitást [9], elősegíti az egészséget és növeli a hosszú élettartamot a sirtuin 1 (SIRT1), a hosszú élettartamért felelős gén kiváltásával [10].
Jelen áttekintés egyik célja hipotézis felvetése az ózon hatásmechanizmusairól az oxidatív stressz és a nukleáris transzkripciós faktorok szempontjából, mivel az oxidatív stressz másodlagos hírvivőként működik a különböző intracelluláris jelátviteli utakban. Ezenkívül a sejtek gyorsan kiválthatják a biológiai reakciókat az oxidatív stressz ellen a biológiai homeosztázis fenntartása és az ilyen stresszekhez való alkalmazkodás érdekében. Néhány nukleáris tényező különféle biológiai reakciókat vált ki az oxidatív stressz ellen.
Az állatkísérletek eredményeit és az ózonterápia klinikai alkalmazásának tanulmányait tartalmazzák. Ezenkívül megvizsgáljuk annak lehetőségét, hogy az ózonterápia hatásmechanizmusa az antioxidáns védelmi rendszerek aktiválásán keresztül valósulhat meg, ahol a mérsékelt oxidatív stressz indukálhatja a nukleáris transzkripciós faktorok aktiválódását, mint például a nukleáris faktor-eritroid 2-hez kapcsolódó faktor 2 (Nrf2), hipoxia által indukálható faktor-1α (HIF-1α), aktivált T-sejtek nukleáris faktora (NFAT) és aktivált protein-1 (AT-1).
1. Az ózonparadoxon: mindig mérgező-e az ózon?
1.1. Reakció ózonnal és biológiai komponensekkel
Pryor és munkatársai [11] korábban leírták az ózon tüdő toxicitásában szerepet játszó mechanizmusokat. Röviden, a belélegzett ózon az alveoláris bélésréteg (ALL) lipidjeiben található többszörösen telítetlen zsírsavakkal (PUFA) reagálva ózonspecifikus termékeket állít elő, amelyeket lipid-ozonációs termékeknek (LOP) neveznek. Az ózon telítetlen zsírsavakkal is reagálva H2O hiányában Criegee-ózonidot képezhet. H2O jelenlétében azonban aldehidek és hidrogén-peroxid (H2O2) keletkezik [11]. Mivel a H2O bőséges a tüdőrendszerben, az ózonnal való fő reakció az aldehid és H2O2 termékek képződése lesz. A nettó reakció a következő:
A LOP-k a valószínűbb fajok, amelyek jelátviteli molekulákként működnek. Ezek a termékek aktiválhatnak specifikus lipázokat, például foszfolipáz A2-t vagy foszfolipáz C-t, hogy felszabadítsák az arachidonsavat (AA). Valójában az AA-szint több mint 10-szeresére növekszik az endobronchialis mosás során, amelyet patkányokból 5 napig 1,1 ppm ózonnak tettek ki [12]. A felszabadult AA ezután más kémiai mediátorokká, például különféle prosztaglandinokká (PG-k) és trombocita-aktiváló tényezőkké (PAF) alakítható át ciklooxigenázokon (COX) és lipoxigenázokon (LOX) keresztül, hogy gyulladásos választ váltson ki. Továbbá beszámoltak arról, hogy a 4-hidroxinonenal (4-HNE), az aldehid legmérgezőbb típusa [13,14] és a H2O2 [15,16] képes részt venni a jelátvitelben.
1.2. Az ózon hatása a légutakra: A légutak hiperreaktivitása és gyulladása
Jó kísérleti [19,20] és klinikai [21] tanulmányok mutatják, hogy a hosszan tartó troposzférikus ózon inhalációs expozíciója károsítja a légzőrendszert és az extra tüdőszerveket. A bőr, ha nagymértékben ki van téve, szintén hozzájárulhat a károsodáshoz [22,23]. Következésképpen az ózon erős reaktivitása, amelynek elektrokémiai potenciálértéke, E ° = + 2,076 V, hozzájárult annak a dogmának a megállapításához, hogy az ózon mindig mérgező, és orvosi alkalmazását meg kell tiltani. Meg fogják mutatni, hogy ezt a dogmát nem támasztja alá az ózon tüdőfelületre gyakorolt hatásának összehasonlítása az emberi vérrel. Nyilvánvalóan el kell mondani, hogy az ózont soha nem szabad belélegezni a klinikán. Úgy tűnik azonban, hogy testünkben ózon termelődik, hasonlóan az NO-hoz, a CO-hoz és a H2S-hez: beszámoltak róla, hogy az antitestek által katalizált víz-oxidációs út további molekuláris fajokat eredményezett, amelyek kémiai jellege az ózoné [24]. Ez a faj az aktivált humán neutrofilek oxidatív robbanása és a gyulladás során is keletkezik [25].
Az alapvető szempontok, amelyeket figyelembe kell venni, a következők: a naponta ózonnak kitett szervek topográfiája, anatómiai és biokémiai jellemzői, szemben a vér erős antioxidáns kapacitásával, amelyet néhány percig kis és pontosan kiszámított ózon dózisnak tesznek ki. Világos, hogy a krónikus oxidatív stressz alatt álló légzőrendszer hogyan képes lassan, de folyamatosan felszabadítani a már említett mérgező vegyületek hatalmas mennyiségét, amelyek képesek lokálisan működni, bejutni a keringésbe és súlyos károkat okozni.
1.3. A tüdőrendszer által az ózon expozíció alatt és után felszabaduló mérgező vegyületek eredete, eloszlása és sorsa
2. Hogyan hat az ózon megfelelő adagja az emberi vérre?
Asztal 1
Az ózonterápia a következő biológiai reakciókat indukálhatja
| a) | Javítja a vérkeringést és az oxigénellátást az iszkémiás szövetekben az NO, CO miatt, és növeli az intra-eritrocita 2, 3-DPG szintjét. |
| b) | Az oxigénellátás javításával fokozza az általános anyagcserét. |
| c) | Felszabályozza a celluláris antioxidáns enzimeket, valamint a HO-1 és a HSP70 indukcióját. |
| d) | Indukálja az immunrendszer enyhe aktiválódását és fokozza a növekedési faktorok felszabadulását. |
| e) | Nem szerez akut vagy késői mellékhatásokat. |
| f) | Meglepő wellness a legtöbb beteg számára, valószínűleg a neuroendokrin rendszer stimulálása révén. |
| g) | Aktiválja a neuroprotektív rendszereket. |
A következő fontos lépés az alkenálok eloszlásának, sorsának és biológiai jelentőségének értékelése volt. Miután 5 percig ex vivo összekeverték a vért a gázkeverékkel, az ózonozott vér kész visszaadni a donor betegbe. Az ózon és a hidrogén-peroxid is kimerült, de az alkenálok adduktokat képeztek vagy a Cyst 34 albuminnal, vagy a GSH-val, és a beteg keringésébe kerülnek. Kölcsönhatásba lépnek az endothelsejtekkel, majd a különféle szervek milliárdjaival [46]. Csak abban az esetben, ha egy járatlan ózonterapeuta túlzott ózondózist használ, oxidálhatja a Cys 34-et szulfénsavvá: RSOH -vá, amely azonban ismét csökkenthető.
a) Hígítás: egy egyszerű számítás azt mutatja, hogy egy 500 μM 4-HNE dózis 10 ml plazmában történő bolusinjekciója 12 ml plazma-extracelluláris folyadék térfogatban hígítva, bármilyen más eljárástól függetlenül, olyan alacsony, mint 0,04 μM.
b) Méregtelenítés a 4-HNE GSH-val és aszkorbáttal történő közvetlen inaktiválása vagy méregtelenítő enzimekkel felruházott sejtmilliárdokkal való kölcsönhatás miatt [42]
c) kiválasztás epével és vizelettel a máj méregtelenítése [67] és a vesén keresztül történő kiválasztása után [60], és
d) A sejtek internalizálása, ez egy döntő és érdekes pont, mert az ebből következő biológiai hatások lehetnek negatívak vagy pozitívak. Több hónapon keresztül belélegzett ózonnak vagy krónikus betegség (érelmeszesedés, cukorbetegség, gyulladás) miatti hosszan tartó oxidatív stressznek való kitettség hatására a 4-HNE plazmaszintje akár 5-20 μM is megemelkedhet, és a folyamatos méregtelenítés ellenére kóros hatások. Érdekes módon az ózon vagy a 4-HNE iránti tolerancia sokkal könnyebben érhető el kis és ismétlődő oxidatív feszültségekkel, mint folyamatos és erős oxidáció után [42.43]. Másrészről a normális endogén 4-HNE szint (0,1–0,7 μM) úgy tűnik, védekező anyagként hat önmagával és más mérgező vegyületekkel szemben. Ebben a szakaszban az alkenálok nagy értéket érnek el, hogy hipotetikusan kiváltsák azokat a molekuláris mechanizmusokat, amelyek toxicitás nélkül kiváltják az orvosi hatékonyságot. Ezt a szempontot a következő szakasz tárgyalja.
3. Oxidatív stressz és nukleáris transzkripciós tényezők a karcinogenezisben
A krónikus gyulladás kritikus szerepet játszik a neoplasztikus növekedésben (átalakulásban), valamint számos más betegségben. A gyulladást különféle gyulladásos tényezők, például LPS és az iNOS-t, COX-2-t és gyulladásos citokineket indukáló gyógyszerekből származó súlyos oxidatív stressz okozza NFκB-aktivációval. Ezek a tényezők indukálják a tumorsejtek túlélését, növekedését és szaporodását, és neopláziát eredményeznek [68]. Ezért az NFκB gátlása fontos cél a rák megelőzésében és kezelésében. Például ismert, hogy az NFκB inhibitorai, például az E-vitamin, a resveratrol, a kurkumin, a katechin és az aszpirin késleltethetik vagy elnyomhatják a tumor növekedését.
3.1. Az Nrf2 antineoplasztikus mechanizmusai
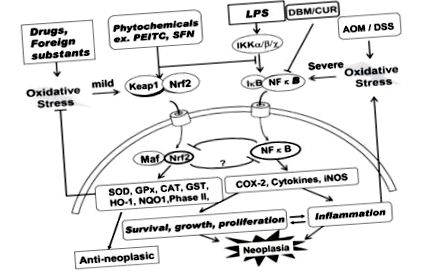
A krónikus gyulladás kritikus szerepet játszik a neoplasztikus növekedésben, valamint számos más gyulladásos betegségben. Ezért az NFkB gátlása fontos cél a rák megelőzésében és esetleg kezelésében. Van-e szerepe az Nrf2-nek az ózonterápiában? Li és mtsai [69] kimutatták, hogy az Nrf2, amely fontos citoprotektív nukleáris transzkripciós faktor, elnyomja az NFκB-aktivációt. Amint az az 1. ábrán látható (balra 1 (bal oldal), az Nrf2 általában a citoszolban Keap-1 fehérjével komplexként van jelen. A kérdés az: képesek-e az alkenálok disszociálni ezt a komplexet? két SH-csoportja van, és az adduktok képződése konformációs változást idézhet elő, amely elősegíti annak disszociációját. Más kísérletezendő utak és egy enyhe oxidatív stressz mellett az Nrf2 felszabadul ebből a komplexből és a magba szállítódik. A szállított Nrf2 új komplexet képez Maf fehérjével, és különféle antioxidáns és II. fázisú méregtelenítő enzimek transzkripcióját indukálja a DNS antioxidáns válasz eleméhez (ARE) kötődve. Az aktivált specifikus antioxidáns enzimek közé tartozik a SOD, a kataláz (CAT), a GSH, a GSH-reduktáz, GPx, GSH-S-transzferáz (GSTr), HO-1, NADPH kinin-oxidoreduktáz 1 (NQO1), hősokk-fehérje 70 (HSP70) és II. Fázisú enzimek. Ezek az enzimek antineoplasztikus hatásokat válthatnak ki.
A brokkoliban található összetevő a szulforafán (SFN) a leggyakoribb fitokémiai anyag, amely az Nrf2 aktiválása révén különféle antioxidáns enzimek transzkripcióját indukálja. Valójában az SFN önmagában is oxidatív stresszként működhet a sejtekben.
3.2. Az antineoplasztikus fitokémiai anyagok nem hatékonyak az Nrf2 knockout egerekben
Az előző részben a fitokemikáliák, például az SFN antineoplasztikus hatásait magyarázták az Nrf2 aktiválásával kapcsolatban. Köztudott, hogy az SFN hatékony kemopreventív hatással rendelkezik azáltal, hogy az Nrf2-n keresztül sejttelenítő/antioxidáns enzimeket indukál [70]. Ha ezeket a hatásokat valóban az Nrf2 közvetíti, akkor az SFN hatásait inaktiválni kell az Nrf2 knockout egerekben, és aktívnak kell lenniük a vad típusú egerekben. Valóban, ezt a megfigyelést Xu és mtsai [68] tették meg, amikor az SFN kemopreventív hatékonyságát vizsgálták Nrf2 vad típusú (+/+) és Nrf2 knockout (-/-) egerekben. A 7,12-dimetil-benz (a) antracén/12-O-tetradekanoil-fenol-13-acetát kezelés előtt 14 napon keresztül napi 100 nmol SFN helyileg történő alkalmazása csökkentette a bőrdaganatok előfordulását az Nrf2-ben ( +/+) egerek a vivőanyaggal kezelt csoporthoz képest. Ennél is fontosabb, hogy az SFN előkezelése nem okozott kemopreventív hatást Nrf2 (-/-) egerekben. Ezek az eredmények együttvéve először mutatják be, hogy az Nrf2 (-/-) egerek érzékenyebbek a bőr tumorgenezisére, és hogy az SFN kemopreventív hatásai az Nrf2 aktivációval közvetülnek.
3.3. A mérsékelt testmozgás által kiváltott oxidatív stressz Nrf2 -aktivációt vált ki
A mérsékelt és súlyos testmozgás ROS termelődését eredményezi mind az izomban, mind a belső szervekben. A ROS nemcsak mérgező, hanem fontos szerepet játszik a sejtjelzésben és a génexpresszió szabályozásában is. A mérsékelt testmozgás köztudottan jót tesz az egészségnek, szemben a súlyos testmozgással. Az edzés közben keletkező ROS hatásmechanizmusait azonban nem teljesen értjük.
A testmozgás során a ROS termelődése elsősorban a mitokondriális elektrontranszport rendszer rendellenességeinek köszönhető, amelyeket az oxigénfogyasztás növekedése, az ischaemia és a belső szervek reperfúziója következtében fellépő NADPH-oxidáz aktivitás emelkedése, valamint a gyulladásos sejtek beszivárgása okoz, mint például a makrofágok és a neutrofilek. A ROS termelési szintje a testmozgás intenzitásától is függ.
Gomez-Cabrera és mtsai [71] arról számoltak be, hogy a mérsékelt testmozgás a MAP kinázok és az NFκB útvonal aktiválódását, következésképpen az eNOS, iNOS és MnSOD expresszióját eredményezi. Érdekes módon mindezen változások megszűntek, amikor a ROS termelést az allopurinollal, egy NADPH-oxidáz inhibitorral gátolták. Ezek a megállapítások arra utalnak, hogy a testmozgás által kiváltott ROS-termelés az antioxidáns enzimek, például az MnSOD és a GPx expresszióját és aktivációját eredményezi, elsősorban az NFκB útvonal aktiválásán keresztül. Az antioxidáns enzimek NFκB útvonalon történő indukciójával kapcsolatos bizonyítékok azonban még mindig hiányoznak. Így nem utasíthatjuk el azt a lehetőséget, hogy az Nrf2 is aktiválódik. Tehát feltételezhető, hogy a mérsékelt gyakorlatok indukálják az antioxidáns enzimek expresszióját, és hogy a ROS-termelés indukálja az NFκB és az Nrf2 aktivációját, de még tisztázni kell.
3.4. Az Nrf2/Keap1/ARE aktiválásával kiváltott biológiai válaszok
Az Nrf2 enyhe oxidatív stressz hatására aktiválódik, és növeli az ARE transzkripcióját [72,73]. Ez lehet egy lehetséges mechanizmus ennek az útnak az antineoplasztikus hatásai mögött. Az Nrf2/Keap1/ARE út aktiválásával kiváltott egyéb lehetséges biológiai válaszokat a 2. táblázat foglalja össze. 2. Az 1–7. Pontot Dinkova-Kostova már megvitatta [74], míg a 8. és 9. pontot a következő szakaszok tárgyalják.
2. táblázat
Az Nrf2/ARE enyhe oxidatív stresszel történő aktiválásával kiváltott biológiai válaszok
- Az orvosi ózonterápia csökkenti az oxidatív stresszt és a bélkárosodást a
- Lymphoma Action Immunglobulin helyettesítő terápia
- A hosszú távú ketogén diéta metabolikus acidózist, vérszegénységet és oxidatív stresszt vált ki az egészséges Wistar-ban
- Naturopátiás Orvosi Hét és az endémiás Quackery problémája, mint az ózonterápia
- Orvosi ózonterápia