Az étkezés utáni plazma metabolitok dinamikus változásai kukorica-szójaliszt vagy kazein-keményítő étrend bevitele után növekvő sertésekben
Absztrakt
Háttér
Az étkezés utáni tápanyagok felhasználása és egy bizonyos étrend anyagcseréje bonyolult folyamat. A sertések metabolikus jellemzői a kukorica-szójabab liszt vagy kazein-keményítő étrend bevétele után nagyrészt ismeretlenek. Ezért ezt a vizsgálatot a plazma metabolikus profiljának étkezés utáni dinamikus változásainak vizsgálatára végezték, növekvő sertésekkel, metabolomikával.
Mód
Huszonnégy növekvő sertést, átlagos kezdeti testtömeggel (BW), körülbelül 30 kg-mal, anyagcsere-ketrecekbe helyeztünk, majd precavalus vénakatéterekkel láttuk el. A sertéseket a kezdeti testtömeg 4% -ával etették naponta. Két kísérleti étrendet vontak be: (i) keményítő-kazein alapú tisztított étrendet (PD) és (ii) közös kukorica-szójabab liszt étrendet (CD). A plazmát etetés előtt és 0,5 óra, 1 óra, 2 óra, 4 óra, 8 óra elteltével gyűjtöttük össze.
Eredmények
Mindkét étrendben az etetés előtt a glükóz, a legtöbb aminosav, a metabolitok, például az 5-amino-pentánsav, a pipekolsav, az ornitin és az 5-hidroxi koncentrációja-L-A triptofán az első órában jelentősen megemelkedett a plazmában, míg a plazma trigliceridek, glutamát, glicin, palmitelaidinsav, 13-HODE és olajsav koncentrációja az első órában csökkent. A PD csoporthoz képest a plazma leucin és az izoleucin koncentrációja 30 perc múlva csökkent a CD csoportban. CD-vel etetett sertésekben a plazma linolsav, a szfingozin és sok dipeptid szignifikánsan magasabb volt.
Következtetés
A legjelentősebb anyagcsere-változások az etetés után az első órában következtek be, majd 2 óra múlva mindkét étrendben viszonylag stabilak lettek. Ezek az eredmények széles körű képet mutatnak a plazma metabolitjainak étkezés utáni változásairól a PD és CD bevétele után, és referenciaként szolgálhatnak a további táplálkozási beavatkozásokhoz, valamint a táplálkozási vizsgálatok megtervezéséhez.
Háttér
A kukorica és a szójabab a legfontosabb növények világszerte. A kukorica az élelmiszerek és takarmányok egyik legfontosabb összetevője, amely fő energiaforrásként működik. A szójabab-lisztet, a szójaolaj melléktermékét, a takarmányban fehérjeforrásként széles körben használják, és specifikus tápanyagokat tartalmaz, beleértve az izoflavont, a szaponinot és a fitoszterint [8]. Ugyanakkor a kazeint és a keményítőt fehérje és energiaforrásként is használják különböző célokra [9]. A kazeinből és a kukoricakeményítő-alapú étrendből származó étrendi aminosavat és energiát hagyományosan tisztított étrendként alkalmazták a tápanyagok bevitelére adott válaszok ellenőrzésére [10].
A metabolom a sejtben, szervben vagy organizmusban keletkező összes kis molekulájú metabolit összegyűjtése és globális elemzése. [11] A metabolomika segíthet nyomon követni a tápanyagok és az anyagcsere közötti kölcsönhatást [12], és jobban megértheti a tápanyagok emésztési és felszívódási kinetikáját étkezés után. A mini disznókon végzett metabolomikai vizsgálat azt mutatta, hogy sok metabolit ellentétes tendenciát mutat az étkezés után, ami kompenzációs mechanizmus lehet a tápanyag beáramlására válaszul [5].
Ezért a jelenlegi vizsgálat fő célja az volt, hogy széles körű képet kapjunk az étkezés utáni metabolitok változásairól a növekvő sertések PD és CD bevétele után, ami növeli az emésztési és abszorpciós kinetika megértését e két klasszikus étrend számára, és alapot ad a szelekcióhoz a különböző célokra felhasznált vérminták időpontjai.
Mód
Diéta, állatok és kísérleti tervezés
Sebészet
Mindegyik sertést katéterrel látták el az elülső vena cava-ban a cefalis vénán keresztül, és a fő műtéti eljárást Takken et al. [13]. Egyszerűen az érzéstelenítést 5 mg/kg Zoletil 50 intramuszkuláris injekcióval indukálták, majd a műtéti hely bőrét (a szegycsont, a jugularis barázda és a fejfenék vénáinak keresztmetszete) szúrta át üreges tűvel vezetőhuzallal, majd húzza ki a tűt és helyezze be a katétert a vezetőhuzal mentén. Húzza ki a vezetőhuzalt és rögzítse a katétert pillangókapoccsal. A katétert heparinoldattal blokkoltuk, és a sertésnek intramuszkuláris antibiotikum-injekciót (cefazolin) adtunk 50 mg/kg dózisban.
Vérvétel
Minden sertésből vérmintákat vettünk d5-nél a kísérleti időszak kezdete után. Az alapmintát 10 perccel a reggeli etetés előtt vettük, majd a vérmintákat 30, 60, 120, 180, 240 és 480 perccel az etetés után. A mintákat 3000x-nél centrifugáltuk (Biofuge22R; Heraeus, Hanau, Németország)g 10 percig, majd a felülúszót más csövekbe helyeztük és folyékony nitrogénben lefagyasztottuk, majd - 80 ° C-on tároltuk a metabolomikai elemzéshez.
Kémiai elemzés
A takarmánymintákat 1 mm-es szitán áthaladtuk, és alaposan összekevertük a kémiai elemzéshez (2. táblázat). Az összes kémiai elemzést két példányban végeztük. Az összetevők és az étrend mintáit szárazanyagra (DM) és nyersfehérjére (CP) elemeztük [14]. A diéták aminosav-összetételét a Hivatalos Analitikai Kémikusok Szövetségének (AOAC) (2000) eljárásaival határoztuk meg. A mintákat 6 mol/l sósavoldattal 24 órán át 110 ° C-on végzett elemzés előtt hidrolizáltuk, és 15 AA-értéket analizáltunk egy automatikus aminosav-analizátorral (L-8900 Hitachi automatikus aminosav-analizátor, Tokió, Japán). Egy éjszakán át tartó hideg periódusos savas oxidáció és 24 órán át 110 ° C-on 7,5 mol/l sósavval végzett hidrolízis után a metionint és a cisztint metionin-szulfonként és ciszteinsavként elemeztük. A triptofánt LiOH hidrolízis után 22 órán át 110 ° C-on nagy teljesítményű folyadékkromatográfiával határoztuk meg (Agilent 1200 sorozat, Santa Clara, Kalifornia, USA) [15].
Biokémiai elemzések
A plazma glükózkoncentrációt ioncserélő kromatográfiával (Agilent 1200) határoztuk meg. Röviden, a mintákat centrifugálással tisztítottuk 12 500x-nál g 10 percig 4 ° C-on, majd a felülúszókat (0,25 ml) vízzel 5 ml-re hígítottuk, és az elemzés előtt hidrofób szűrőpatronon engedtük át. A plazma inzulin koncentrációt sertés inzulin INS ELISA Kit (MSK) alkalmazásával vizsgáltuk. A trigliceridet, a plazma kalciumot, az ALB-t, a HDL-t, az LDL-t és a plazma karbamid-nitrogént Hitachi 7020 Chemistry Analyzer segítségével elemeztük Wang és mtsai. [16].
Az aminosavak profilozása LC-MS/MS alapján
Háromszáz μl plazmát pipettáztunk egy 2 ml-es centrifugacsőbe, 12 μl belső standardot (2,5 mmol/l norleucin) adtunk hozzá, és 1,2 ml jéghideg metanolt adtunk hozzá. Örvényezés után a mintákat 14 000x-nél centrifugáltuk g 10 percig 4 ° C-on (Eppendorf, Hamburg, német). Egy 500 μl felülúszót szárazra pároltunk vákuum-koncentrátorban (Eppendorf, Hamburg, német). A maradékokat 100 μl borátpufferben (AccQ-Tag Ultra Derivatization Kit, Waters, USA) szuszpendáltuk, vortexel kevertük össze és ismét centrifugáltuk 14 000x-nél. g 10 percig 4 ° C-on. Ezután a felülúszó 10 μl-es alikvot részét egy fiolában összekevertük 50 μL borát-pufferrel. Ezután acetonitrilben oldott 20 μL derivatizáló reagenst (AccQ-Tag Ultra Derivatization Kit, Waters, USA) adtunk hozzá. Az ampullákat lezártuk, vortexel összekevertük és 10 percig 55 ° C-ra melegítettük. Szobahőmérsékletre hűtés után az oldatokat mintavevő fiolákba helyeztük LC-MS/MS elemzés céljából. A standard oldatokat ugyanúgy hoztuk létre. Az LC-MS/MS-t a korábbi vizsgálat szerint végeztük [17, 18].
Metabolomikai mérés UPLC-MS alapján
Az egyes kezelések 12 sertéséből származó plazmamintákat 800 μl jéghideg extrakciós keverékkel extraháltuk (acetonitril: metanol, 1: 1)., köt: köt) 1: 4 minta: extrakciós keverék aránynál. 5 perces örvény után a mintákat 18 000x-nél centrifugáltuk g 10 percig 4 ° C-on a fehérjementesítés céljából. Ezután a felülúszó frakciókat összegyűjtjük és vákuum-koncentrátorral (Concentrator plus, Eppendorf) szárazra pároljuk. A kapott száraz maradékokat 200 μl 50% -os metanolban szuszpendáljuk, keverjük össze örvényben, majd ismét centrifugáljuk 18 000x g 10 percig 4 ° C-on. Végül a felülúszó frakciókat 0,1 μm-es membránon (Millipore, USA) átszűrtük és mintavevő fiolákba helyeztük, hogy az LC-MS rendszeren elemezzük őket.
A plazmamintákat egy UPLC-MS rendszerrel (UPLC, Ultra Performance Liquid Chromatography, ACQUITY UPLC H-Class Bio, Waters; MS, Mass Spectrometry, Q-Exactive, Thermo Scientific) analizálták, amely egy fűtött elektrospray ionizációs (HESI) forrással volt felszerelve. Az UPLC elválasztást egy BEH C18 oszlopon végeztük (2,1 mm × 100 mm, 1,7 μm, Waters). A mozgófázis: 0,1% hangyasav vizes oldat; B: 0,1% hangyasav-acetonitril-oldat (minden HPLC minőségű, Thermo Fisher Scientific, NJ, USA). A gradiens program az alábbiak szerint: 95% A 0 percnél 70% A 5 percnél, 5% A 10 percig és 3 percig tartott, majd visszatért a kezdeti állapotba. Az áramlási sebességet 0,3 ml/perc értékre állítottuk be. Az összegyűjtött plazma és a vakok mintáját minden hat minta után injektáltuk a minőség-ellenőrzés érdekében. Az oszlop hőmérsékletét 35 ° C-ra állítottuk be, és az injekció térfogata 5 μl volt.
Az MS elemzést elektrospray ionizációs pozitív módban végeztük. A teljes szkennelési adatokat 70 000-es felbontással gyűjtöttük be a tömegtartományban m/z 67,7–1 000. A teljes pásztázás felvétele mellett a tandem tömegspektrometriás (MS/MS) elemzéseket tömeges felvételi lista felhasználásával végeztük, amely m/z és a megcélzott differenciális metabolitok retenciós ideje, az izolációs ablak 0,8 m/z és 35 000 tömegfelbontást választottak. Az MS/MS elemzéshez az ütközéseket 35 V energián hajtották végre.
A metabolomikai adatok elemzése
A metabolizmus adatfeldolgozásához a SIEVE 2.1 szoftvert (Thermo Scientific) használták. A szoftver egy előre beállított küszöbértéket meghaladó csúcsokat választ ki, kivonja a hátteret és kivonja az összetevőket a nyers adatokból. A vegyületek szűrése CV 1.5 és P Az 1. ábra azt jelzi, hogy a metabolit felfelé volt szabályozva, míg a szeres változás
Eredmények
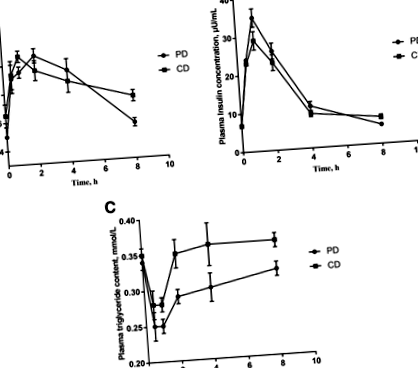
Étkezés utáni energia-anyagcsere
A PD és CD plazma glükózkoncentrációit (étkezés előtt és 0-8 órával étkezés után) az 1a. Ábra mutatja be. A plazma glükózkoncentrációja mindkét étrendben szignifikánsan emelkedett 30 percnél (P 1. ábra
Étkezés utáni aminosav változások
Vizsgáltuk PD és CD plazma nélküli AA-ját. Az összes aminosav (TAA) és az esszenciális aminosav (EAA) koncentrációja a PD bevitele után jelentősen megnőtt és 1 órával tetőzött (P 2. ábra
A plazma egyéb metabolitjai megváltoznak
A MetaboAnalyst 4.0 segítségével generált útelemzés a CD és a PD differenciális metabolitjai alapján. A csomópont sugárának mérete és fontossága (x- tengely) tükrözi az útvonal-hatás értékeket, amelyek a központosság központossága alapján lettek kiszámítva, figyelembe véve a globális hálózati struktúrát és mérve a csomóponton belüli metabolitokon átmenő legrövidebb utak számát. Csomópont színe és iránya (Y-tengely) azonban a számítotton alapul P a dúsítási elemzés értéke. PD: keményítő-kazein alapú tisztított étrend és CD: közös kukorica-szójabab-étrend
Vita
Egy bizonyos étrend bevitelére adott fiziológiai és biokémiai reakció bonyolult folyamat. Az étkezés utáni plazma metabolomák eredményei fontosak a tápanyagok emésztési és felszívódási dinamikájának feltárásában. Jelen munka fő célja a plazma metabolitok étkezés utáni változásainak vizsgálata volt metabolomika alkalmazásával, olyan célzott analitikai megközelítésekkel kombinálva, mint a klasszikus biokémia és a kvantitatív szabad aminosav-profilozás. A PD-t és a CD-t ebben a tanulmányban a két diéta bevétele utáni dinamikus változások vizsgálatára használták.
A klasszikus metabolikus megközelítésekkel kombinálva a metabolomika teljes körű és mélyebb információt nyújt a plazma globális metabolitprofiljáról [32, 33]. Lizin, valin, prolin, triptofán és közvetlen prekurzoraik vagy származékaik, például 5-amino-pentánsav, 4-amino-2-metilén-butánsav és 5-hidroxi-L-A triptofán felfelé volt szabályozva, és mindezek a metabolitok összefüggésben voltak az útvonalakkal, beleértve D-arginin és D-ornitin metabolizmus, arginin és prolin metabolizmus, lizin lebontás, glicin, szerin és treonin metabolizmus. Ezek az eredmények összhangban vannak az aminosav-profilozással. Érdekes, hogy palmitelaidinsav, 13-HODE, 13-L-etetés után a hidroperoxilinolinsav és az olajsav sokkal alacsonyabb volt. A 13-HODE a linolsav oxigénes terméke, amelyet az egyik legerősebb oxilipin-markerként találtak meg [33]. Ezek a metabolitok mind a linolsav-anyagcseréhez kapcsolódtak, és a lassú felszívódás és az erős energia-anyagcsere miatt csökkent szabályozást tehetnek. Az összes azonosított metabolit közül a 4-acetil-piperidinium-klorid, a lizoPE, a lizoPC és az arachidonát koncentrációja minden idõpontban viszonylag stabil szinten maradt, ami azt mutatja, hogy ezek minimalizálhatják az idõvonalbeli hatásokat, mint lehetséges belsõ referenciákat.
Következtetés
A biokémiai paraméterek és a metabolomikai eredmények alapján széles térképet mutattak be arról, hogy az étkezés utáni metabolitok hogyan változtak az idő múlásával a PD és CD bevétele után. A plazma glükóz és a legtöbb aminosav jelentős növekedést mutatott, míg a plazma trigliceridek, glutamát és glicin alacsonyabb volt mindkét étrend bevitele után. A metabolomikai eredmények olyan metabolitokat mutattak ki, mint az 5-amino-pentánsav, a pipekolsav, az ornitin és az 5-hidroxi-L-A triptofán az első órában jelentősen megemelkedett a plazmában, míg a plazma trigliceridek, glutamát, glicin, palmitelaidinsav, 13-HODE és olajsav koncentrációja csökkent. Néhány lipiddel kapcsolatos metabolit lefelé történő szabályozása az étkezés után 1 órával összhangban volt a plazma triglicerid alacsonyabb koncentrációjával, míg a dipeptidek felfelé voltak szabályozva, a plazma leucin és izoleucin koncentrációja pedig csökkent CD-ben. Összefoglalva, ezek az eredmények jobb ismereteket nyújtanak az étkezés utáni táplálkozási biokémiáról és fiziológiáról, és nagy jelentőséggel bírnak a további táplálkozási beavatkozási stratégiák szempontjából.
- A porlasztva szárított állati plazma hatása a macskák táplálékfelvételére és a tápanyagok látszólagos emészthetőségére
- A fehérjetartalmú ételek bevitelének, a szénhidrátmennyiség és -minőség, valamint a hosszú távú testsúly-változás
- Minden, ami a Whole30 indításához szükséges, az étkezéstől az élelmiszerboltok listájáig - ABC News
- A 2-es típusú cukorbetegség-érzékenységi gének és az étrendi zsírbevitel közötti kölcsönhatás bizonyítékai
- Egyszerű 30 napos diéta fogyókúrás étkezési terv - Noom