Circovirus vasculitisben és vérzésben szenvedő kutyák szövetében - 19. kötet, 4. szám - 2013. április -
Egy új kutya cirkovírus (DogCV) teljes genomját jellemeztük egy súlyos vérzéses gasztroenteritisben, vasculitisben és granulomatous lymphadenitisben szenvedő kutya májából. A DogCV-t PCR-rel detektálták 19/168 (11,3%) hasmenéses és 14/204 (6,9%) egészséges kutya székletmintáiban, és 19/409 (3,3%) vérben trombocitopéniában és neutropéniában, ismeretlen lázban eredete, vagy elmúlt kullancscsípés. 13/19 (68%) hasmenésben szenvedő DogCV-pozitív kutya esetében más kutyás kórokozókkal társfertőzést detektáltak. A különböző kutyák DogCV kapszid fehérjéi akár 8% -kal változtak. Az in situ hibridizáció és transzmissziós elektronmikroszkópia 4 kutya nyirokcsomóiban és lépében detektálta a DogCV-t vaszkuláris kompromisszummal és histiocytás gyulladással. A cirkovírus kimutatása kutyák szöveteiben kiterjeszti e vírusok ismert tropizmusát egy második emlős gazdaszervezetre. Eredményeink azt mutatják, hogy a cirkovírus önmagában vagy más kórokozókkal együtt fertőzve hozzájárulhat a kutyák betegségéhez és halálához.
A cirkovírusok nem köpenyes, gömb alakú vírusok, amelyek egyszálú kör alakú DNS-genomja kb2 kb; nemzetségként csoportosulnak a Circoviridae családba, a javasolt Cyclovirus nemzetséggel és a filogenetikailag jobban megkülönböztetett Gyrovirus nemzetséggel együtt (1). A Circovirus nemzetségbe tartozó ismert fajok többsége megfertőzi a madarakat, és olyan tüneteket okoz, mint például az integumentum fejlődési rendellenességei és nekrózisa, lymphoid kimerülés és immunszuppresszió (2).
2012 előtt az emlősök megfertőzéséről csak a 2 szorosan rokon sertéscirkovírus (PCV) számolt be (3). A PCV2 az elsődleges kórokozó, amely a sertések világában leírt sertéscirkovírus-társult betegségeknek nevezett sertésbetegségek spektrumához kapcsolódik. A PCV2-fertőzés súlyos gazdasági veszteségeket okoz a megnövekedett mortalitás és a termelés csökkenése miatt, így ez az egyik gazdaságilag legfontosabb vírus a sertésiparban. A PCV2 fertőzésnek tulajdonítható elváltozások között szerepel a tüdőgyulladás, az enteritis, a lymphadenitis, a vasculitis, a nephritis és a reproduktív betegség (4). Azokban az esetekben, amelyekben a PCV2 ok-okozati tényezőnek számít, az immunhisztokémiai és az in situ hibridizációs (ISH) elemzések nagy mennyiségű PCV2 antigént vagy nukleinsavat mutatnak a makrofágok és a dendritikus sejtek citoplazmájában a limfoid szövetekben lévő kimerült tüszőkben (4,5). A természetesen előforduló sertés-cirkovírushoz társuló betegségeket gyakran felgyorsítják vagy súlyosbítják egyidejű vírusos vagy bakteriális fertőzések, és másodlagos fertőzések gyakran fordulnak elő immunszuppresszió következtében (6).
A véletlenszerű nukleinsav-amplifikáció előzetes dúsítással vagy anélkül a vírusrészecskékkel társított nukleinsavakhoz (7,8), majd mély szekvenálás és in silico hasonlóság-keresés az ismert vírusokhoz kapcsolódó szekvenciákhoz, rendkívül produktív az állati vírusok területén felfedezés (9–11). Ezt a technikát alkalmaztuk az ismeretlen okú betegségekkel rendelkező kísérő állatok vírusszekvenciájának azonosítására az érintett szövetekben. Kutya cirkovírusát azonosítottuk egy olyan kutya májában, amely nekrotizáló vasculitisben és granulomatous lymphadenitisben szenvedett, mindkettőt PCV2-fertőzött sertéseknél írták le (4). Ezt a vírust kutya cirkovírusnak (DogCV) neveztük el kutya cirkovírus helyett, hogy elkerüljük az összetévesztést a kanári cirkovírus (12,13), a kutya kalicivírus (14,15) és a Capsicum chlorosis vírus (16) CaCV jelölésével. A DogCV közeli rokonságú változatát egymástól függetlenül szekvenálták kutya szérum mintákban, és nemrégiben tették közzé (17); a vírussal azonban nem írtak le betegség társulást. Annak eldöntésére, hogy a DogCV összefüggésbe hozható-e a kutya érrendszeri betegségével, további kutyákat azonosítottunk vaszkuláris és granulomatózisos elváltozásokkal, és ISH analízissel megvizsgáltuk a DogCV eloszlását.
Anyagok és metódusok
Állatmintagyűjtemény
Minta előkészítés és nukleinsav extrakció
A májszövet mintáját (~ 25 mg) 1 ml hideg Hank Hank-féle sóoldatba merítettük, és szöveti homogenizátorral 30 másodpercig jégen megszakítottuk. A kapott homogenátumokat száraz jégre helyeztük 5 percre, majd szobahőmérsékleten felolvasztottuk (18). A fagyasztást és a felolvasztást kétszer megismételtük. A mintákat centrifugálással tisztítottuk 10 000 x g sebességgel 3 percig; a felülúszókat ezután leszűrjük, és nukleázkezelésnek vetjük alá őket a leírtak szerint (19). A vírusos nukleinsavakat a QIAamp Viral RNS Mini Kit (QIAGEN, Valencia, CA, USA) segítségével extraháltuk és -80 ° C-on tároltuk.
Könyvtár előkészítése és szekvenálása
Vírus nukleinsav könyvtárakat készítettünk a leírtak szerint (19). Az egyszálú DNS-fragmensek könyvtárát a Genome Sequencer FLX eszköz (Roche, Indianapolis, IN, USA) segítségével szekvenáltuk.
Szekvenciaadatok elemzése
A piroszekvenálás leolvasásait a leírtak szerint rendeztük és vágtuk le (19). Az egyes mintákból leolvasott leolvasásokat de novo módon állítottuk össze a MIRA összeszerelő program (20) felhasználásával,> 95% -os azonosság kritériumával 35 bázispár felett. Az összeállított szekvenciákat és a> 100 bp szingleteket összehasonlítottuk a GenBank nem redundáns nukleotid- és fehérje-adatbázisával (www.ncbi.nlm.nih.gov/genbank) BLASTn és BLASTx alkalmazásával (http: //blast.ncbi.nlm.nih .gov/Blast.cgi). Jelentős találatokkal járó potenciális vírusszekvenciák (E-érték 100 aa-t jósolt a Vector NTI Advance 11 (Invitrogen, Carlsbad, CA, USA). A szár-hurok szerkezetét Mfold (21) alkalmazásával jósoltuk meg.
Filogenetikai elemzés
A teljes hosszúságú replikátum (Rep) fehérjék összehangolt aminosav-szekvenciáin alapuló filogenetikai elemzéseket a MEGA4-ben található szomszédos csatlakozási módszerrel (22) állítottuk elő, aminosav p-távolságok felhasználásával 1000 bootstrap replikátummal. Más faépítési módszereket, köztük a maximális parsimóniát és a maximális valószínűséget alkalmazták a szomszéd csatlakozó fa topológiájának megerősítésére.
A DogCV prevalenciájának vizsgálata mintakohortokban
Valós idejű PCR-t használtunk 2 primer és egy hagyományos hidrolízis szondával, 5 primer 6-FAM és 3 primer TAMRA jelöléssel és TaqMan Universal PCR Master Mix-szel (Applied Biosystems, Foster City, CA, USA). kivonatok 3 kutyaminta-kohorszból: 1) székletminták 204 egészséges kutyából; 2) székletminták 168 hasmenéses kutyától; és 3) vérminták 480 thrombocytopeniában és neutropeniában, ismeretlen eredetű lázban vagy kullancscsípésben szenvedő kutyából. A kutyák cirkovírusának alapozó párjait és próbáit a táblázat tartalmazza. Az összes nukleinsavat a Corbett X-Tractor Gene platform (QIAGEN) alkalmazásával extraháltuk. A valós idejű PCR-t a valós idejű LightCycler 480 (Roche, Indianapolis, IN, USA) PCR készülék alkalmazásával végeztük, ilyen körülmények között: 50 ° C 2 percig, majd 95 ° C 10 percig, majd 40 ciklus 95 ° C 15 másodpercig és 60 ° C 1 percig. A megfelelő régiók szintetikus DNS-fragmenseit (~ 150 bp) felhasználva standard molekula görbét és 10 molekula analitikai érzékenységét állítottuk elő.
ISH elemzés
A negyedik minta kohorsz 21 olyan boncolási eset szövetmintáiból állt, amelyek kutyáinak klinikai tünetei vagy mikroszkópos elváltozásai megfeleltek az őrszem állatának (azaz vérzéses hasmenés, vasculitis és/vagy granulomatózus betegség); ezeket a mintákat az anatómiai patológia szövetarchívumából választottuk ki az UC Davis Állatorvosi Orvosi Oktató Kórházban. A kontroll szöveteket 5 kutyától nyertük, akiknek halálának oka nem volt összefüggésben az érrendszeri betegségekkel. Az elemzésre kiválasztott szövetrészek részben esettől függtek, mivel a vasculitis vagy gyulladás jelenléte ezekben az esetekben nem korlátozódott egyetlen szövettípusra. A lépet, a nyirokcsomót, a jejunumot és az ileumot minden esetben megvizsgáltuk; a többi vizsgált szövet a vese, az agy, a mellékvese, a hasnyálmirigy, a nyombél, a szív és a tüdő volt. Az elemzésbe az őrszemkutya szöveteit is bevontuk.
Elektronmikroszkópia
Az őrszem kutyájából kiválasztott formalinnal rögzített nyirokcsomó szövetrészeket 2,0% glutáraldehidben rögzítettük, majd rutinszerűen feldolgoztuk és epoxigyantába ágyazottuk (Eponate12 kit; Ted Pella, Inc., Redding, CA, USA). A kiválasztott vastag metszeteket toluidinkékkel festettük, amint azt leírtuk (26). A nyirokcsomó kiválasztott területeiről származó ultravékony metszeteket Zeiss (Gottingen, Németország) 906E transzmissziós elektronmikroszkóppal vizsgáltuk.
A kutya cirkovírus metagenomikus azonosítása
~ 10 000 leolvasott szekvencia közül 5 folytatás és szingulett, amelyek a májszövetből 52 leolvasott szekvenciából állnak, jelentős hasonlóságot mutatnak a cirkovírusok Rep fehérjéjével (E-érték -10). Két bocavírus szekvenciát is kimutattak. Mivel a cirkovírusok körkörös genommal rendelkeznek, a teljes vírusgenomot ezután inverz beágyazott PCR-rel amplifikálták, és az amplikont primer járással szekvenálták. Az összeállított genomot DogCV UCD1 törzsnek (DogCV-UCD1) nevezték el.
Eredmények
Genomelemzés és filogenetikai kapcsolat
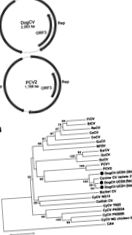
1.ábra. . . A) A kutya cirkovírus (DogCV) és a sertés cirkovírus 2 (PCV2) genomszerveződése. B) DogCV törzsek (UCD1–3, szövetből, székletből, illetve vérből izolált) filogenetikai elemzése a.
A DogCV-UCD1 teljes körkörös genomja 2063 nt volt (GenBank csatlakozási szám: KC241982). A genomszekvencia elemzése kimutatta a cirkovírusokra jellemző jellemzőket, köztük egy ambiszensz szerveződést 2 fő, inverz elrendezésű ORF-sel, amely a feltételezett replikációhoz társult (Rep, 303 aa) és kapszid (Cap, 270 aa) fehérjéket kódolja. A konzerválódott nonanukleotid motívummal (5′-TAGTATTAC-3 ′, hasonlóan a madár- és sertéscirovírusok konszenzusához) jellemző szár-hurok struktúrát találtunk az 5′-intergenikus régióban is (135 nt, a 2 fő ORF). A DogCV-UCD1 3′-intergenikus régiója a 2 fő ORF stopkodonja között 203 nt volt (1. ábra, A panel) (27).
Egy másik DogCV törzs (DogCV-UCD2, GenBank csatlakozási szám: KC241984) teljes genomját amplifikálták és szekvenálták egy menhelyen elhelyezett kutya székletmintájából, amelynek hányása és hasmenése volt. Ez a törzs 95% -os teljes genom-nukleotid-azonosságot mutatott a DogCV-UCD1-gyel, és mindkét törzs 96–97% -os nukleotid-azonosságot mutatott a közelmúltban közölt kutya cirkovírus 214-es izolátummal szemben a vérből (17).
A DogCV-UCD1 feltételezett Rep fehérjéi 42–54% aminosav-azonosságot mutattak a sertés és a madár cirkovírusok Rep fehérjeivel, a PCV1-hez legközelebb eső azonossággal. A DogCV-UCD1 kapszid 0,05-et mutatott χ 2 teszttel). A 19 hasmenéses kutyából, akiknél a székletmintákban kimutatták a DogCV-t, 13-at (68%)> 1 egyéb kórokozóval, köztük kutya enterális koronavírussal, Cryptosporidium spp., C. perfringens α toxinnal, Giardia spp., Salmonella spp-vel együttfertőzöttek. ., Campylobacter jejuni és Campylobacter coli (PCR-rel tesztelve).
A DogCV előfordulása a thrombocytopeniában és neutropéniában, ismeretlen eredetű lázban vagy korábbi kullancscsípésben szenvedő kutyák kohorszából származó vérmintákban 3,3% (16/480) volt, hasonlóan a kutyaszérum mintáknál (2,9%, 6/205) ) (17). A részleges Rep és/vagy Cap fehérje régiókat (~ 350 bp) amplifikáltuk 11/16 mintából. Mindegyik> 96% nukleotid azonosságot mutatott, kivéve 1 amplikonot, amelynek ebből a 3 jelből> 2 volt: vasculitis, vérzés vagy granulomatous betegség. Az érintett szövetek széles spektruma képviseltette magát ebben a csoportban; Összehasonlító szöveteket is megvizsgáltunk 5 kontroll kutyától, amelyeknél ezek a jelek nem voltak jelen. Az őrszemkutya (1. kutya) és 3 másik kutya (2–4. Kutya) mintái ISH-analízissel pozitívak voltak a DogCV-re. A kontroll kutyák összes többi szövetmintája negatív volt ISH analízissel. Az ISH által meghatározott klinikai tüneteket, bruttó és szövettani eredményeket, valamint a vírus DNS eloszlását alkalmazták a DogCV lehetséges ok-okozati szerepének vizsgálatára.
Az 1. kutya egy hím beagle volt, akinek hányása és vérzéses hasmenése volt. A 2. kutya 5 éves, nőstény ivartalanított bostoni terrier volt, aki hányt és hasmenett. A 3-as kutya egyéves, nőstény, ivartalanított ökölvívó volt, 5 napos kórtörténettel és bénasággal és progresszív tetraparézissel. A 4. kutya egy 2 éves agár volt, akit kétoldali vérzéssel holtan találtak; vérkenet és a PCR kimutatta, hogy ez a kutya együtt fertőzött a Babesia conradae-val.
2. ábra. . . Az őrszemes kutya (1. kutya) és 2 másik kutya (2. és 3. kutya) szervszövetei, amelyek in situ hibridizációs (ISH) elemzéssel pozitívak voltak kutya cirkovírus (DogCV) szempontjából. A).
ISH-analízissel bőséges citoplazmatikus vírusos nukleinsavat detektáltak mind a 4 kutya mesenterialis nyirokcsomóinak csíraközpontjaiban, valamint a mesenterialis nyirokcsomók subcapsularis és medulláris sinusaiban lévő makrofágokban (2. ábra, H panel), 2 kutya mandibularis nyirokcsomóiban, az összes ileal Peyer foltban 4 kutya (2. ábra, D, F panelek), a lép ellipszoidjai (terminális arteriolái) 1 kutyának és a germinális központok lép fehér fehér pépben 2 kutyának. Bár a retikuláris hálózat bőségesen pozitív volt az 1. kutyánál (2. ábra, H panel), a közös mintázat a lymphoid vagy Peyer patch follikulusok központjaiba történő lokalizáció volt (2. ábra, D, F panelek), amely megfelel a dendritikus morfológiának és eloszlásnak sejtek. A Peyer-foltok fölötti, mellékvese kéreg vagy béllamina propria kis ereket bélelő hosszúkás sejtek (feltételezett endothelium) ritka magjai 2 kutyánál pozitívak voltak. ISH-analízissel más szövetekben nem detektáltak nukleinsavat, függetlenül a gyulladás jellegétől vagy intenzitásától. Az 5 kontroll kutya egyike sem mutatott ISC által DogCV DNS-t.
Transzmissziós elektronmikroszkópos elemzés
3. ábra. . Nyirokcsomó őrszem kutyából, amelyből kutya cirkovírust azonosítottak. A) A toluolidin kék folt több makrofágot mutat a medulláris sinuson belül, amely vakuolákat tartalmaz, és különálló, hosszúkás-kerek.
Az 1. kutyából származó mesenterialis nyirokcsomó ultrakonstrukturális elemzése nagyszámú intracitoplazmatikus zárványokkal terhelt makrofágokat tárt fel (3. ábra, A panel). A zárványok kerekek, hosszúkásak vagy szabálytalanok voltak; voltak
Vita
Egy új cirkovírust, a DogCV-t azonosítottunk egy olyan kutya májában, amely nekrotizáló vasculitisben és granulomatous lymphadenitisben szenved. Jellemeztük több DogCV törzs genomját, meghatároztuk a DogCV prevalenciáját a kutya ürülék- és plazmamintáiban, valamint a szövetek eloszlását fertőzött állatokban, és parakristályos tömböket detektáltunk a makrofágok zárványtesteiben. A valós idejű PCR-elemzés 11,3% -os, illetve 6,9% -os prevalenciát mutatott hasmenéses kutyák és egészséges kutyák székletmintáiban. A DogCV DNS-t a thrombocytopeniában és neutropeniában, ismeretlen eredetű lázban és korábbi kullancscsípésben szenvedő kutyák vérmintáinak 3,3% -ában találták, ami megközelítőleg ugyanannyi, mint korábban beszámoltak róla (17).
Az őrszemes kutya és a múltbeli boncolásokból retrospektív módon kiválasztott további 21 kutya ISH-analízise 4 kutyában, köztük az őrszem-kutyában detektált vírusos nukleinsavat, valamint értékelték a kutyák szövetmintáiban a vírus hisztopatológiai jellemzőit és eloszlását. Az érintett szervek még ebben a kis állatcsoportban is változatosak voltak, de minden kutyának nekrotizáló vasculitis és vérzése volt, és 1 kivételével mindegyiknek lymphadenitis és granulomatosus betegsége volt. Mivel a tesztelt retrospektív állatokat úgy választottuk meg, hogy megfeleljenek az őrszem esetének, mintavételünk elfogult, és a vírussal összefüggő betegségek spektruma szélesebb lehet, mint amit észleltünk. Az ISH szempontjából pozitív kutyák között a betegség jelei változatosak voltak, és a klinikai, bruttó és mikroszkópos jellemzők a betegség egyes szindrómáiban hasonlóak voltak a PCV2 fertőzéshez társítottakhoz (4,5). Különösen a sertés dermatitisz és a nephropathia szindróma osztja a DogCV-pozitív kutyáknál tapasztalt szövettani jellemzőket (28, 29), és a PCV2-ről beszámoltak, hogy nekrotizáló nyirokcsomó-gyulladást, vasculitist vagy neurológiai betegséget okoz (4, 30, 31). Az ISH elemzéssel értékelve a víruseloszlás szintén hasonló a DogCV és a PCV2 között.
A vírus DNS-t következetesen kimutatták a fertőzött kutyák limfoid szövetében lévő makrofágok és monociták citoplazmájában. A PCV2-vel fertőzött sertésekben a víruseloszlás a következetesebben a nyirokszöveten belül történik, a többi vírusban szórványosan jelentenek vírust (4,23,32,33). Például dermatitiszes és nephropathiás szindrómában szenvedő sertéseknél általában a vesék granulomatosus gyulladásáról számolnak be; azonban a vírust csak néhány esetben észlelik a vese szövetében bármilyen módszerrel. Vizsgálatunk során a DogCV DNS-t kimutatták a limfoid szövetekben, beleértve a Peyer-foltokat, még a 3. és a 4. kutya esetében is, ahol nem volt kimutatható klinikai vagy szövettani enterális elváltozás. A DogCV DNS-t a béllamina propria és a mellékvesekéreg kicsi, end-kapilláris endotheliális csatornáiban is megtalálták; ezeknek a sejteknek endotheliálisként történő megerősítése azonban további vizsgálatot igényel.
A PCV2 fertőzés két különféle szövettani jellemzője a vírus zárványok és a többmagos nukleáris óriássejtek képződése (34), melyeket a rutinszerű szövettan nem mutatta ki a DogCV fertőzött kutyákban. Elektronmikroszkóppal azonban a nyirokcsomó makrofágjai rengeteg citoplazmatikus víruszárványt tartalmaztak, amelyek sűrű szemcsés vagy parakristályos elrendezésű vírusból álltak. Az érintett sejteket mind a vizsgált mesenterialis nyirokcsomó sinusában, mind a medulláris zsinórjában megtalálták. Az ultrakonstruktív zárványok hasonlóak voltak a citoplazmatikus zárványok egy részéhez, amelyeket PCV2-vel fertőzött szövetekben írtak le (35,36).
Számos kísérleti és természetes betegség vizsgálata azt mutatta, hogy a PCV2 fertőzés leggyakrabban klinikai betegségekhez vezet más sertés kórokozókkal társfertőzés jelenlétében. A PCV2 fokozza a vírusos (pl. Sertés parvovírus, sertés reproduktív és légzőszervi szindróma vírus), bakteriális, protozoa, metazoális és gombás fertőzéseket sertésekben (6). Vizsgálatunkban hasmenéses kutyák közül a DogCV-re pozitívak többségének (68%)> 1 enterális kórokozóval volt együttes fertőzése. Továbbá, azon kis esetek esetében, amelyekben in situ azonosítottuk a vírust, 1 kutyát társfertőzött egy kutya bocavírus, egyet pedig Babesia conradae. Az együttfertőzés szerepe a betegség patogenezisében ezekben az esetekben nem egyértelmű.
Összefoglalva: a DogCV-t mérlegelni kell megmagyarázhatatlan vasculitis esetén kutyákban, bár további vizsgálatokra lesz szükség annak megállapításához, hogy a DogCV okoz-e betegséget és mikor. A DogCV egyéb kutyák fertőző betegségei esetében is bonyolító tényező lehet, csakúgy, mint a PCV2 esetében, amely más kórokozókkal együtt fertőzött sertéseknél a legveszélyesebb. A DogCV betegségekhez való hozzájárulásának jövőbeni kutatásakor alaposan mérlegelni kell ezeket a lehetséges vírusos és gazda tényezőket.
Dr. Li a Vérrendszer Kutató Intézet és a Laboratóriumi Orvostudományi Tanszék munkatársa, Kalifornia Egyetem, San Francisco, USA. Kutatási területe a vírusos felfedezés és a vírusos fertőző betegségek.
Köszönetnyilvánítás
Köszönetet mondunk Scott Fish-nek és a kaliforniai állategészségügyi élelmiszer-biztonsági laboratóriumnak Davisben az elektronmikroszkópos feldolgozásért és a szakértelemért.
- Élelmiszer-korlátozások - 2013. április - BabyCenter India
- A húgyúti fertőzéseket okozó Escherichia coli tápláléktartálya - 16. kötet, 1. szám - január
- ÉTLETI HATÁSOK AZ ANEMIÁRA ÉS HIPOPROTEINÉMIÁRA KUTYÁKBAN Journal of Experimental Medicine Rockefeller
- FreeTrial) Volume Diet fogyás Optimális étrend fogyás esetén az Acai Fiber jó a fogyáshoz
- Diétás fehérje intolerancia kutyáknál - tünetek, okok, diagnózis, kezelés, helyreállítás, kezelés