DNS-szervetlen hibrid nanovakcinák rák immunterápiára
Guizhi Zhu
Molekuláris képalkotás és nanomedicina laboratóriuma, Országos Biomedicinális Képalkotási és Biomérnöki Intézet (NIBIB), Nemzeti Egészségügyi Intézet (NIH), Bethesda, MD 20892; Tel .: (+1) 301-451-4246
Yijing Liu
Molekuláris képalkotás és nanomedicina laboratóriuma, Országos Biomedicinális Képalkotási és Biomérnöki Intézet (NIBIB), Nemzeti Egészségügyi Intézet (NIH), Bethesda, MD 20892; Tel .: (+1) 301-451-4246
Xiangyu Yang
Molekuláris képalkotás és nanomedicina laboratóriuma, Országos Biomedicinális Képalkotási és Biomérnöki Intézet (NIBIB), Nemzeti Egészségügyi Intézet (NIH), Bethesda, MD 20892; Tel .: (+1) 301-451-4246
Fiatal-Hwa Kim
Molekuláris képalkotás és nanomedicina laboratóriuma, Országos Biomedicinális Képalkotási és Biomérnöki Intézet (NIBIB), Nemzeti Egészségügyi Intézet (NIH), Bethesda, MD 20892; Tel .: (+1) 301-451-4246
Huimin Zhang
Molekuláris képalkotás és nanomedicina laboratóriuma, Országos Biomedicinális Képalkotási és Biomérnöki Intézet (NIBIB), Nemzeti Egészségügyi Intézet (NIH), Bethesda, MD 20892; Tel .: (+1) 301-451-4246
Rui Jia
b Az intracelluláris fehérje kereskedelem, a sejtbiológiai és anyagcsere program rész, Nemzeti Gyermekegészségügyi és Emberi Fejlesztési Intézet, NIH, Bethesda, MD 20892
Hsien-Shun Liao
c Sejtes képalkotó és makromolekuláris biofizikai laboratórium, NIBIB, NIH, Bethesda, MD 20892
Albert Jin
c Sejtes képalkotó és makromolekuláris biofizikai laboratórium, NIBIB, NIH, Bethesda, MD 20892
Jing Lin
c Sejtes képalkotó és makromolekuláris biofizikai laboratórium, NIBIB, NIH, Bethesda, MD 20892
Maria Aronova
c Sejtes képalkotó és makromolekuláris biofizikai laboratórium, NIBIB, NIH, Bethesda, MD 20892
Richard Leapman
c Sejtes képalkotó és makromolekuláris biofizikai laboratórium, NIBIB, NIH, Bethesda, MD 20892
Zhihong Nie
d Kémiai és Biokémiai Tanszék, Marylandi Egyetem, College Park, MD 20742
Gang Niu
Molekuláris képalkotás és nanomedicina laboratóriuma, Országos Biomedicinális Képalkotási és Biomérnöki Intézet (NIBIB), Nemzeti Egészségügyi Intézet (NIH), Bethesda, MD 20892; Tel .: (+1) 301-451-4246
Xiaoyuan Chen
Molekuláris képalkotás és nanomedicina laboratóriuma, Országos Biomedicinális Képalkotási és Biomérnöki Intézet (NIBIB), Nemzeti Egészségügyi Intézet (NIH), Bethesda, MD 20892; Tel .: (+1) 301-451-4246
Társított adatok
Absztrakt
Bevezetés
Az immunrendszer átfogó védelmi hálózattá fejlődik, amely megvédi a gazdaszervezetet a különféle betegségektől, beleértve a rákot is. Az immunrendszert azonban rákos betegeknél gyakran veszélyezteti az immunszuppresszív tumor mikrokörnyezet 1, amelyből hiányzik a daganatellenes citotoxikus CD8 + T sejtek, és amely feleslegben tartalmaz tumorba beszivárgó limfocitákat (TIL), például szabályozó T sejteket és mieloid eredetű szuppresszor sejteket. Következésképpen ezek a szövődmények elnyomják a rákellenes immunválaszokat, és elősegítik az immunmegkerülést és az onkogenezist 2. A jelenlegi primer rákkezelés, például a műtét, a kemoterápia és a sugárterápia azonban korlátozott hatékonysággal képes megoldani ezeket a szövődményeket. Alternatív megoldásként a rák immunterápiája megkísérli normalizálni és kiaknázni az immunrendszert a rák elleni küzdelem érdekében.
Ennek ellenére a CpG-alapú rák immunterápia számos kihívással szembesült, elsősorban a kedvezőtlen farmakokinetikával, a szisztémás mellékhatásokkal és az APC-kbe történő nem hatékony intracelluláris bejuttatással 13, 14. Például belső negatív töltéssel a szintetikus molekuláris CpG-k hatékonysága korlátozott ahhoz, hogy a TLR9 felismerés céljából APC-kbe beépítsék őket; ennek ellenére a TLR9 evolúcióban expresszálódik a sejtekben (endolizoszóma membránokon) az intracelluláris „idegen” molekulák, például a kórokozó DNS kimutatására. Ezenkívül a hagyományos molekuláris CpG-k csak ideiglenes immunválaszokat képesek kiváltani, a gyors kiürülés, a rövid szöveti retenciós idő, a nukleázérzékenység és a CpG-k által kiváltott, eredetileg átmeneti veleszületett immunválaszok miatt. Sőt, a szisztémás keringésbe szivárgott CpG-k stimulálhatják a B-sejteket és a plazmacitoid dendritikus sejteket a gyulladás előtti mediátorok expresszálására és mellékhatásokat okozhatnak. E kihívások kezelésére a jelenlegi megközelítések magukban foglalják a CpG 15–17 kémiai módosítását vagy a CpG 18–25 beépítését nanohordozókba. Különösen a nanohordozók képesek meghosszabbítani a terhelt terápiás szerek szöveti retenciós idejét és csökkenteni a CpG expozícióját a szisztémás keringésben.
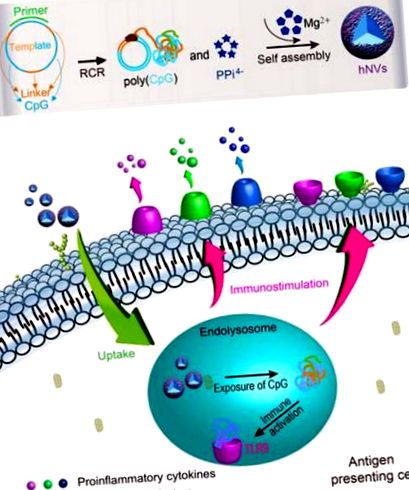
Itt mutatjuk be a fenti szövődmények megoldását ígérő DNS-szervetlen hibrid nanovakcinák (hNV) kifejlesztését. Ezeket a hNV-ket eredetileg CpG-analógokkal és protektív Mg2PPi-vel ültették be a rák immunterápiájára (az 1. ábra szerinti séma). Kimutattuk a hNV-k hatékony sejtfelvételét az APC-k két fő típusába, a dendritikus sejtekbe és a makrofágokba, és a CpG-analógokat az endolizoszómában felvett hNV-kből tettük ki, ami potens immunstimulációhoz vezetett, amit a proinflammatorikus faktorok drámai emelkedett szekréciója és ko-stimuláló tényezők bizonyítanak. . Az in vivo farmakokinetikai képalkotás bizonyította, hogy az egerekben a hNV-k elhúzódó tumor-visszatartása volt megfigyelhető, és a hNV-k további szisztémás toxicitást mutattak, mint a molekuláris CpG-megfelelői. A tumor immunterápiás tanulmány kimutatta a hNV-k hatékony rák immunterápiás hatékonyságát. Ezenkívül a hNV-k magas CpG-analógok terhelhetőségével és magas stabilitással rendelkeznek, ami a CpG-analógok Mg2PPi általi biomineralizációjából ered. Ezek a tulajdonságok együttesen ígéretesek a hNV-k számára a hatékony rák immunterápiában.
Saját összeállított hNV-k illusztrációja a rák immunterápiájához. A gömb alakú hNV-ket a konkatemer DNS CpG-analógjainak és a vízben oldhatatlan Mg2PPi komplexképzéséből állítják össze önmagában egylépéses enzimatikus reakció révén: RCR. Körkörös DNS-templát segítségével az RCR egyidejűleg nagy mennyiségű concatemer CpG-analógot és pirofoszfát-ionokat (PPi4-) állít elő, amelyek utóbbiak azután pufferban Mg2 + -val egyesülve Mg2PPi-t képeznek. A CpG-analógokat és az Mg2PPi-t ezután együtt kicsapják, hogy hNV-kké váljanak össze. A hNV-k könnyen felvehetők az APC-kbe, beleértve a dendritikus sejteket és a makrofágokat, és kiváltják ezen immunsejtek immunaktiválódását és érését, ami a gyulladásgátló citokinek szekréciójához és az érési markerek felpörgetéséhez vezet a sejtfelületeken. A molekuláris CpG-hez képest a hNV-k meghosszabbítják a szövetek retenciós idejét és csökkentik a mellékhatásokat. Melanóma egér modellben a hNV-k hatékonyan gátolják a tumor progresszióját.
Eredmények és vita
A hNV-k felépítése és jellemzése
A hNV-k mérete könnyen beállítható a reakcióidő egyszerű szabályozásával (S1 ábra). Amint azt pásztázó elektronmikroszkóppal (SEM) használtuk, a 8 h RCR-ből képződött hNV-k átlagos átmérője
1 μm-t (2A. Ábra), amelyet dinamikus fényszórás (DLS) (2B. Ábra) és atomerő-mikroszkópos (AFM) mérések (S2 ábra) segítségével igazoltak. Az 1 μm átmérőjű részecskéket hatékonyan képesek felvenni az APC-k, például a makrofágok és a dendritikus sejtek (DC). Az ilyen méretű részecskék valóban gyakoriak az oldhatatlan alumíniumsókban, amelyek a klinikai alkalmazásban a leggyakoribb adjuvánsok 30. Ezért a további tanulmányozáshoz 8-h RCR-ből készített hNV-ket választottunk. Ugyanezt a módszert alkalmazva a GpC-t, amely elveszíti az immunstimulációs képességet azáltal, hogy a CpG-1826-ban található két CG-dinukleotidot két GC-dinukleotiddá mutálja (lásd az S1. Táblázat szekvenciáit), beépítettük a GpC DNS-szervetlen hibrid nanovirágokba (GpC-NFs, S3. Ábra). ) kontrollként.
A hNV-k szerkezeti jellemzése. (A) SEM képek, amelyek 8 órán keresztül RCR reakcióból önállóan összeállított hNV-ket mutatnak. (B) DLS-eredmény, amely a hNV-k méretét mutatja. (C) A hNV-k fluoroforokkal (felső) és konfokális mikroszkópos felvételek vázlatos leírása, az Alexa488-jelölt hNV-ket mutatva RCR reakcióból 10 órán át (alsó). (D) EDX grafikon, amely a hNV-k elemprofilját mutatja. Az Inset az elem tömegének (%) felsorolása hNV-ban. Az Mg-csúcs és a P-csúcs közötti két csúcs a SEM/EDX-ben használt szilícium-szubsztrát elemeiből származik.
A hNV-k nagy stabilitása
A nanovakcinák magas stabilitása nemcsak tárolásuk vagy szállításuk, hanem az oltási hatékonyság fenntartása szempontjából is megköveteli. A hNV-k stabilitását száraz képletként értékeltük magas hőmérsékleten, és a DNase kezelésével, amely mindenütt jelen van az intersticiális folyadékban, amelynek oltások vagy adjuvánsok gyakran vannak kitéve. Különösen a száraz hNV port 37 ° C-ra, 60 ° C-ra és 80 ° C-ra melegítettük 1 órán át. A SEM megfigyelése azt mutatta, hogy a fent kezelt hNV-k morfológiája majdnem ép volt (S7A. Ábra). A hNV-k szerkezeti integritása a hNV-k magas hőstabilitására utal, mivel mind a DNS elsődleges szerkezete (szekvenciája), mind az Mg2PPi magas hőmérsékleten nagyon stabil. Ezenkívül a hNV-k biostabilitását DNáz I kezelésével értékeltük, amely várhatóan nagyjából utánozta az interstitialis folyadék fiziológiai környezetét. 35 SEM eredmények (S7B. Ábra) azt mutatták, hogy a hNV-k morfológiája majdnem sértetlen maradt a fenti kezelés alatt 1 órán át tartó inkubálás után, ami a hNV-k magas biostabilitását jelzi a utánzott fiziológiai környezetben. A hNV-k stabilitása várhatóan fenntartja az oltás hatékonyságát, növeli az oltás eltarthatóságát, és egyszerűsíti az oltás tárolását és szállítását.
A hNV-k hatékony sejtfelvétele APC-kbe és az APC-k hatékony immunstimulációja
Hosszan tartó tumor visszatartás és a hNV-k csökkent mellékhatásai a molekuláris CpG-hez képest
A hNV-k farmakokinetikai vizsgálata a hNV-k elhúzódó tumor-visszatartási idejét jelzi a molekuláris CpG-vel összehasonlítva. (A) IR800-jelölt hNV-ket és CpG-t (PS gerinc) injektáltunk szubkután B16F10 tumorokba egérenként 1 nmol CpG ekvivalens dózisban. A hNV-k vagy a CpG farmakokinetikáját a jelzett időpontokban optikai képalkotással figyeltük meg. A fluoreszcencia intenzitások különbsége a CpG-csoportban és a hNV-csoportban ugyanabban az időpontban az injektált IR800 különböző mennyiségének volt köszönhető, amikor a CpG-mennyiség ekvivalens volt a molekuláris CpG-ben és a hNV-kben (az IR800 mennyisége CpG-ben 45-szerese volt a hNV-kben mért mennyiségének, mert hNV-kben egy IR800-jelölt primert kapcsoltunk egy RCR DNS-termékkel, amely integrálva volt 45 CpG ekvivalenssel). Alul láthatóak az egerek és a fluoreszcencia reprezentatív képei. (B) A normalizált átlagos fluoreszcencia intenzitások számszerűsítése az (A) ábrán látható képeken. Az adatok az átlag ± s.e.m értéket képviselik.
A rövid szöveti visszatartással összhangban a hagyományos molekuláris CpG másik hátránya a szisztémás keringésbe engedett CpG által okozott többszörös szisztémás mellékhatásokkal társul 13, 14. E mellékhatások egyike az extramedulláris haematopoiesissel járó splenomegalia 14. A mellékhatás hNV értékének értékeléséhez hNV-ket és molekuláris CpG-t szubkután injektáltunk egerekbe, majd meghatároztuk a lép méretét és tömegét a splenomegalia felmérése érdekében. Az eredmények azt mutatták, hogy a hNV-k nagymértékben csökkentették a splenomegaliát a molekuláris CpG-társaikkal összehasonlítva, ami egyértelműen jelzi a szisztémás mellékhatások hNV-k általi csökkenését (5. ábra). Továbbá a lépek H&E festése oltott egerekben tovább erősítette a hNV-k biokompatibilitását (S14. Ábra).
hNVs által közvetített rák immunterápia B16F10 melanoma egér modellben. (A) PBS-sel, molekuláris CpG-vel, kontroll GpC-NF-ekkel vagy hNV-kkel kezelt egerek daganatmennyiségei egérenként 2 nmol CpG ekvivalens dózisban intratumorális injekcióval a tumor beoltását követő 6. és 12. napon. A csillagok szignifikáns különbségeket mutatnak a daganatok térfogata között a megfelelő különböző rezsimekkel kezelt egerekben (*** p5 B16F10 sejteket szubkután oltottunk egerekbe. A beoltás utáni 10. napon az egereket intratumorálisan beadtuk IR800-jelölt CpG-vel vagy IR800-jelölt hNV-kkel. 1 nmol/egér CpG vagy CpG ekvivalens dózisban hNV-kben A kapott egerek fluoreszcenciáját Maestro II in vivo képalkotó rendszeren (Caliper Life Sciences, Hopkinton, MA) rögzítettük az injekció beadását követően meghatározott időpontokban. Az érdeklődés (ROI) felhívta a fluoreszcens régiókat és a ROI átlagos fluoreszcencia intenzitását elemeztük a számszerűsítés érdekében.
Rák immunterápia
A C57BL/6J egereket (The Jackson Laboratory) kórokozóktól mentes körülmények között egy állattartó létesítményben helyezték el. A hNV-alapú immunterápia vizsgálatához xenograft B16F10 melanoma tumor modellt alkalmaztunk. Pontosabban 5x105 B16F10 sejtet oltottunk szubkután egerekbe. Az egereket meghatározott módszerrel kezeltük az inokuláció utáni 5. és 10. napon 2 nmol/egér CpG vagy ennek megfelelő ekvivalens (5 egér/csoport) intratumorális injekciójával. Az egér súlyát és a tumor méretét folyamatosan figyeltük. A tumor térfogatát a következő képlet segítségével számoltuk ki:
Az egereket elöltük, amikor a daganat bármely mérete meghaladta a 2 cm-t, vagy amikor a daganat nekrózist vagy fekélyt alakított ki. Minden állatmunkát az NIH állatgondozási és -használati útmutatójának megfelelően végeztünk az NIH Klinikai Központ Állatgondozási és Felhasználási Bizottságának jóváhagyott protokolljai alapján. Az eredményeket a GraphPad Prism 4 (La Jolla, Kalifornia) segítségével elemeztük.
Kiegészítő anyag
Kiegészítő információk
Köszönetnyilvánítás
Ezt a munkát az Országos Biomedicinális Képalkotási és Biomérnöki Intézet (NIBIB), a Nemzeti Egészségügyi Intézet (NIH) intramurális kutatási programja támogatta.
- Az arca felét elvesztő daganatos betegeket az úttörő The Independent sebész rekonstruálta
- Rák elleni tintahaláta saláta Nem csak olívaolaj mediterrán étrend receptek az egészséges hosszú életért
- A rák megelőzése Az étrend, a testmozgás és a súlycsatlakozás Cancer UT Southwestern Medical Center
- A rák mellékhatásainak kezelése - diéta és testmozgás
- A Chaga gomba (Inonotus obliquus) vizes kivonatának folyamatos bevitele elnyomja a rákot