Dr. Hiromi Wada - Javíthatja-e az alkáli étrend a rák eredményeit?
Állat- és emberkutatásokból számos bizonyíték áll rendelkezésre, amelyek azt mutatják, hogy a daganatokkal összefüggő sejtek savas külső mikrokörnyezete (lokális környezete) jelentős szerepet játszik a rákos megbetegedések előrehaladásában és vándorlásában. Patkánymodellben a savas pH-szintet csökkentő szisztémás pufferelés a rák progresszióját és a gyógyszerrezisztenciát egyaránt csökkenti. Dr. Hiromi Wada a japán rákgyulladás- és anyagcsere-társaságban és munkatársai az alkáli étrendnek a tumor mikrokörnyezetre gyakorolt hatását és annak lehetőségét vizsgálják a rákellenes kezelések hatékonyságának fokozásában.
A diéta hatása
Azt javasolták, hogy az alkalikus étrend előnyökkel járhat a rák hagyományos kezelésében, azon alapulva, hogy képes módosítani a tumor mikrokörnyezet pH-ját. A lúgos ételek közé tartoznak a gyümölcsök, zöldségek, hüvelyesek, diófélék és magvak. Jelenleg azonban hiányzik a szilárd klinikai bizonyíték az étrend és a rák kialakulása és progressziója közötti kapcsolatról.
Pontosabban, azok a prospektív kohorsz vizsgálatok, amelyekben egyének csoportjait figyelték meg bizonyos időtartamok alatt, nem bizonyították összefüggést a gyümölcs- és zöldségfélék étrendi fogyasztása és a rák megelőzése között. A megfigyelési esettanulmány-tanulmányok azonban érdekes összefüggéseket javasolnak. A megállapítások ezen eltérései a módszertani különbségeknek és a vizsgálatok közötti zavaró változóknak tudhatók be, mint például a betegek elégtelen nyomon követése.
Alkáli étrend és fejlett nem kissejtes tüdőrák (NSCLC)
Az alkáli étrend és a rák kapcsolatának jobb megértése érdekében Dr. Hiromi Wada a japán rákgyulladás- és anyagcsere-társaságban és munkatársai tizenegy olyan beteg retrospektív értékelését végezték el, akiknél előrehaladott stádiumú vagy visszatérő NSCLC volt diagnosztizálva epidermális növekedési faktor receptorral (EGFR). ) mutáció - vagyis egy DNS-mutáció az e fehérjét kódoló génekben, amely fontos a sejtosztódás és a túlélés szempontjából.
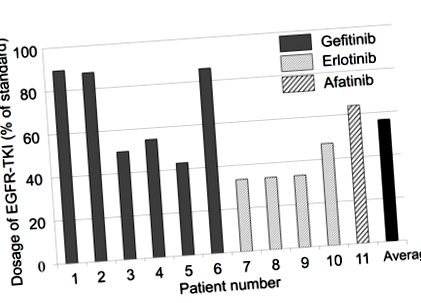
A betegeket tirozin-kináz-gátlóval (TKI) kezelték, amely fehérje a mutált EGF-receptorokat célozza meg, és emellett lúgos ételekben gazdag étrend fogyasztására irányították őket.
A lúgos étrend betartását a vizelet pH-analízise igazolta. A csoport megállapította, hogy bizonyos esetekben a TKI-kezelés a szokásos kezelési dózis majdnem felére csökkent (1. ábra). A hasonló vizsgálatokhoz képest az eredményül kapott progressziómentes túlélés (PFS; a kezelés alatt és után a kezelés időtartama, amely alatt a beteg továbbra is betegségben szenved, de nem súlyosbodott) 13 hónapról 19 hónapra nőtt. Ezenkívül a teljes túlélés 22,8 hónapról 28,5 hónapra nőtt.
Míg Dr. Wada és kollégái elismerik, hogy ebben a tanulmányban nem volt közvetlen összehasonlító csoport, a meglévő szakirodalommal figyelembe véve az eredmények alátámasztják fontos javaslatukat, miszerint egy lúgos étrend alacsonyabb dózisú EGFR-TKI kezeléssel történő kombinálása csökkentheti a toxikus mellékhatásokat a kezelés PFS-jének kiterjesztése mellett.
1. ábra: Az EGFR-TKI adagolása (Anticancer Research, 2017, 37, 5141–45).
Alkalizációs terápia és IV. Stádiumú metasztatikus vagy visszatérő hasnyálmirigyrák
A hasnyálmirigyrák erősen agresszív, és rendkívül rossz eredménnyel jár együttes kombinált kemoterápiás kezelések mellett is. Egy másik klinikai vizsgálatban Dr. Wada és kollégái kiegészítették az előrehaladott hasnyálmirigyrák kemoterápiás kezelését lúgos étrend előírásával, amely napi legalább 400 gramm gyümölcsöt és zöldséget tartalmaz, a hús és tejtermékek teljes kizárásával, valamint napi orális nátrium-hidrogén-karbonát-oldat. A 28 résztvevő betegnél mért vizsgálati eredmények a vizelet pH-ja és a mortalitás voltak.
A lúgosító terápiát követően az átlagos vizelet pH-értéke szignifikánsan magasabb volt, mint a vizsgálat megkezdésekor, és a kutatócsoport megállapította, hogy a magasabb vizelet-pH-értékű (azaz lúgosabb) betegek magasabb teljes túlélési (OS) aránya magasabb, mint az alacsonyabb ( savasabb) vizelet pH-ja. Ezeknek a betegeknek az OS-aránya 16,1 hónap volt, szemben a savasabb vizelettel rendelkező betegeknél csak 4,7 hónappal (2A. Ábra). Hasonlóképpen, azoknak a betegeknek is nagyobb volt az OS-je, akiknél a vizelet pH-értéke nagyobb volt (> 1) az alkalizálás előtti és a poszt-poszt-terápia között. Ezekben az esetekben az operációs rendszer 16,1 hónap volt a 4,3-hoz képest (2B. Ábra).
Intra- és extracelluláris pH: Hatások a tumor fiziológiájára és patológiájára
Általánosságban a rákos sejtek elmozdulást mutatnak a lúgosság felé az intracelluláris környezetben. Más szavakkal, a rákos sejtekben a citoplazma lúgos (pH> 7), és a megfelelő extracelluláris környezet savas.
A ráksejteken belüli lúgosítás kulcsfontosságú a rosszindulatú daganat megindulásában és a daganat előrehaladásában, egyes kutatók egyes kulcsfontosságú daganatos folyamatokkal kapcsolatos összefüggésekről számolnak be, ideértve a több gyógyszer elleni rezisztencia kiváltását és a programozott sejthalál (apoptózis) gátlását.
A nátrium/hidrogén transzporter (1. izoform) NHE1
Az NHE1 felelős a sav/lúg egyensúly fenntartásáért a normál sejtekben. Tipikus („beállított pont”) 6,9–7,1 szint mellett ez a transzporter állandó állapotban nagyrészt inaktív. A transzformált sejtekben azonban az NHE1 transzporternek megváltozott az alapértéke, és aktív marad a pH 7,2-7,7 tartományban. Következésképpen ez lúgos környezethez és a sejteket közvetlenül körülvevő savas környezethez vezet.
Az alkalizálás elmélete a daganatos sejteket körülvevő környezet pH-jának megváltoztatásán alapul, oly módon, hogy a savas környezet pH-jának növelése a daganatsejtek belsejéhez (pH 7,2–7,7) közel legyen, megakadályozza a sejtek transzportját. NHE1 és megakadályozza a rákos sejtek önvezérelt szaporodását.
NHE1: Daganatproliferáció és metasztázis
Más kutatók megerősítették az összefüggést az NHE1, a tumor proliferáció és a megnövekedett belső sejt-pH között azáltal, hogy blokkolják a sejtek proliferációját vagy a transzporter hatását, és meghatározzák az intracelluláris pH-t.
Ezenkívül az lúgos belső környezet, amely az NHE1 transzporter működéséből adódik, elősegíti azoknak a tényezőknek a termelését, amelyek viszont angiogenezist, új erek képződését indukálják, ami szükséges a metasztatikus daganatok elterjedéséhez. Ezenkívül a savas külső pH számos olyan tényező hatását segíti elő, amelyek támogatják a tumorsejtek szaporodását és mobilizálódását.
Az NHE1 működésének egyik legjelentősebb aspektusa, hogy működésének stimulálásához nincs szükség növekedési faktorra. Ez azt jelenti, hogy a sejtek közötti szaporodáshoz vezető állapotok kiváltásához csak a sejtek közötti pH változásra van szükség.
Lúgosítás és a rák immunterápiákra gyakorolt hatása
A kemoterápiák mellett antitest terápiákat is alkalmaznak terápiaként egyes rákos kezeléseknél. A nyelőcső-csomópont adenokarcinóma kezelését, a Nivolumabot alkalizálták egy idős betegnél. Dr. Wada és munkatársai pozitív eredményekről számoltak be ebben az esettanulmányban, ahol a beteg lúgos étrendet fogyasztott orális nátrium-hidrogén-karbonáttal kombinálva. Kimutatták, hogy a daganat markerek a kezelés előtt a rendkívül magas értékekről normális szintre álltak vissza, és a számítógépes tomográfiai vizsgálat a kezelés után 12 hónappal az esophagogastricus junction tumor és a máj metasztázisainak zsugorodását állapította meg.
Dr. Wada és csoportja megjegyzi, hogy ez az első ilyen jellegű esettanulmány rávilágít a tumor mikrokörnyezet lúgosítása és az antitest-terápia pozitív eredményei közötti lehetséges összefüggésre azokban az esetekben, amelyekben nem mutattak hasznot több más terápia.
2. ábra Összefüggés a fejlett hasnyálmirigyrákos betegek túlélése és a vizelet pH (A) vagy vizelet ΔpH (B) között
(rákellenes kutatásból, 2020, 40, 873–80 ’).
Kemoterápiás rezisztencia és diéta
Ismeretes, hogy a legtöbb rák belső (citoplazmatikus) pH-értéke lúgos, és egyes kutatók kimutatták, hogy ez a kemoterápiás rezisztencia központi szempontja. Konkrétan lúgos környezetben kimutatták, hogy egyes kemoterápiás gyógyszerek alacsonyabb koncentrációban vannak jelen a daganatos sejtekben lúgos körülmények között, mint savas (alacsonyabb pH) körülmények között.
Ez azt jelenti, hogy amikor az NHE1 aktív és az intercelluláris pH emelkedik, a kemoterápiás kezelések lényegesen kevésbé hatékonyak, és a daganatsejtek rezisztenssé válnak a gyógyszerek hatásaival szemben. Mivel a kezelés nem ölti le az összes rákos sejtet - a legtöbb helyzetben gyakori -, a fennmaradó sejtek belső pH-ja tovább nő, és a sejtek ellenállóbbá válnak a gyógyszerekkel szemben. A gyógyszerek nem tudnak apoptózist kiváltani, és a tumor előrehalad.
Néhány tenyésztett sejtvonalat használó tesztben kimutatták, hogy a legfontosabb kemoterápiás gyógyszerekkel szembeni rezisztencia majdnem 2000-szeresére növekszik, válaszul a megnövekedett sejtközi pH-ra (0,44).
Dr. Wada és munkatársai azzal érvelnek, hogy az agresszív, késői stádiumú, gyakran kemoterápiával szemben rezisztenssé váló betegeknél megfigyelt jótékony eredmények alátámasztják elképzelésüket, miszerint a daganat mikrokörnyezetének lúgosítása az étrend manipulálásával és az orális nátrium-hidrogén-karbonát oldat fogyasztásával csökkent pH a belső sejtes környezetben. Végső soron a pH ezen manipulálása a helyi tumoros környezetben növelheti a tumorsejtek érzékenységét a kemoterápiás szerekkel szemben.
A jövő
Dr. Wada és munkatársai megvitatják munkájuk eddigi korlátait, amelyeket a késői stádiumú daganatok kezelésének jellege követel meg. A késői stádiumú vagy áttétes daganatokban szenvedő betegek lúgosítással kapcsolatos megállapításai (étrenddel és bizonyos esetekben orális nátrium-hidrogén-karbonáttal történő kiegészítéssel érhetők el) a betegek jobb kimenetelére utalnak. Ide tartozik az OS, a PFS, a tumor és az áttét csökkentése, valamint a daganatok fokozott érzékenysége a kemoterápiás és antitestalapú gyógyszerekkel szemben. Az egyik esetben Dr. Wada és csapata még az alkalizációs terápia javult eredményeiről is beszámolt egy olyan gyógyszer esetében, akinek többféle gyógyszerrezisztens daganata volt.
Lenyűgöző klinikai eredményeik mellett Dr. Wada és csapata világos mechanizmust mutat be a rákos megbetegedések patológiájához és fiziológiájához savas, külső és lúgos intracelluláris környezettel társulva, bemutatva ezzel, hogy a pH-egyensúly hogyan eredményez sejtszaporodást, angiogenezist és képződést áttétes daganatok.
Dr. Wada és csapata a mentális jólét, valamint a rák kialakulása és progressziója iránt is érdekelt, és azt hangoztatja, hogy a hipotalamusz-agyalapi mirigy-tengely, a szervezet központi stressz-reakció rendszerének túlzott aktivációjának elnyomása a rákkezelést megelőzően kézzelfogható előnyökkel jár a beteg számára . Az ember érzelmei közvetlen hatással vannak az agyalapi mirigyre, ami stresszhez kapcsolódó hormonok termeléséhez vezet, megzavarja a szervezet hormonjait és csillapítja az immunválaszt. Mint ilyen, Dr. Wada egy olyan kezelési megközelítést is támogat, amelynek célja a stressz minimalizálása és a rákos beavatkozások előnyeinek növelése.
Referencia
https://doi.org/10.33548/SCIENTIA483
Találkozzon a kutatóval
Dr. Hiromi Wada, PhD
Emeritus professzor
Mellkassebészeti Osztály
Orvosi kar
Kiotói Egyetem
Japán
Dr. Hiromi Wada orvosként diplomázott a japán Kiotói Egyetem orvosi karán. Ezután a Kiotói Egyetem Mellkasi Betegségkutató Intézetében és a Határtani Orvostudomány Intézetében dolgozott, majd a mellkasi sebészeti tanszék professzorává vált, amely szintén a Kiotói Egyetemen van. Dr. Wada jelenleg a Kiotói Egyetem emeritus professzora, a Karasuma Wada Klinika igazgatója és a Japán Rákgyulladás és Metabolizmus Társaságának képviselője.
KAPCSOLATBA LÉPNI
Dr. Hiromasa Morikawa, MD, PhD
Karasuma Wada Klinika
Kiotó
Japán
Dr. Hiromasa Morikawa 2001-ben orvosát a japán Kiotói Egyetem Orvostudományi Karán szerezte. Mellkassebészként végzett munkája után PhD fokozatot kapott a T-sejt immunológia kutatásáért, amelyet Dr. Shimon Sakaguchi laboratóriumában folytattak. Miután ott tanársegédként dolgozott, a svédországi Karolinska Institutetbe költözött, számítógépes orvoslás és immunológia területén dolgozott Dr. Jesper Tegner laboratóriumában Vinnmer-Marie Curie ösztöndíjasként. Jelenleg a japán Karasuma Wada Klinikán dolgozik, és a Japán Mellsebészeti Szövetség igazgatósági tagja.
KAPCSOLATBA LÉPNI
Dr. Reo Hamaguchi, orvos
Japán Rákgyulladás és Metabolizmus Társaság
Kiotó
Japán
Dr. Reo Hamaguchi a Kanazawa Egyetemi Orvostudományi Karon végzett, és jelenleg a Tokiói Egyetem Orvostudományi Karán folytat posztgraduális tanulmányokat. Okleveles belgyógyász a Japán Belgyógyászati Társaságnál, a mellkasgyógyász szakorvosa és okleveles onkológus. Dr. Hamaguchi a tokai Myogadani-i Mirai Orvosi Klinika főorvosa. Pályafutása során pulmonológusként dolgozott általános belgyógyászati betegségekben, valamint rákban szenvedő betegek kezelésében. Jelenleg Dr. Wada felügyelete alatt tanul, és az étrend javításával és az immunitás fokozásával kezeli a rákos betegeket, figyelembe véve a rákos megbetegedések gyulladását és anyagcseréjét.
KAPCSOLATBA LÉPNI
Dr. Ryoko Narui, MD
Japán Rákgyulladás és Metabolizmus Társaság
Kiotó
Japán
KAPCSOLATBA LÉPNI
Creative Commons License
(CC BY 4.0)
Ez a munka Creative Commons Nevezd meg! 4.0 nemzetközi licenc alatt van licencelve.
Mit is jelent ez?
Ossza meg: Az anyagot bármilyen médiumban vagy formátumban másolhatja és terjesztheti
Alkalmazkodni: Bármely célra megváltoztathatja az anyagot, és építhet rá, akár kereskedelemben is.
Hitel: Meg kell adnia a megfelelő hitelt, meg kell adnia egy linket a licenchez, és jeleznie kell, hogy történtek-e változtatások.
- Az étrend változásai javíthatják a merevedési zavarok kapcsolt urológusait
- A csecsemőkori táplálkozási szokások a gyermek étrendjéhez és a 6 évesnél jelentkező testsúlyhoz kapcsolódnak - PubMed
- Határok A kombinált farmakoterápia lehetséges szerepe a gyermekkori eredmények javításában
- Az étrend bevitele és az étrend minősége rák kezelésében részesülő gyermekeknél - PubMed
- E-könyv) ABCD Diet Book A-Z útmutató a legjobb rákellenes ételekhez - Beat Cancer Beat Cancer