Elhízás: Autonóm áramkörök az etetéssel szemben
Absztrakt
Az etetés központi idegi szabályozása és az autonóm kiáramlás nem mindig párhuzamos az energia homeosztázisban, és a táplálkozási viselkedés helyett az autonóm idegi áramkörök diszfunkciója lehet az elhízás elsődleges okozó tényezője.
Az USA-ban a 20 éves és annál idősebb férfiak és nők több mint fele túlsúlyosnak számít, és csaknem egynegyede klinikailag elhízott. A szakértők vitatják, hogy mindenkinek, aki túlsúlyos, meg kell-e veszítenie a felesleges fontokat az egészség megőrzése érdekében. Mivel az elhízás az esetek többségében a túlevéshez kapcsolódik, sok kutatás foglalkozott a táplálkozási magatartás központi idegi mechanizmusaival. Az elhízás a megnövekedett energiafogyasztás és a csökkent energiafelhasználás következménye. A központi idegrendszer (CNS) szabályozza az energia homeosztázisát és a testsúlyát az étkezés és az autonóm idegrendszer szabályozásával.
A leptin egy hormon, amely részt vesz a táplálékfelvétel központi idegrendszeri szabályozásában és az autonóm kiáramlásban. A termék LEP gén (más néven ob), A leptin fehér zsírszövetben és alacsonyabb szinten, a gyomor hámjában és a placentában expresszálódik 1. Nemrégiben történt felfedezése óta javasolják a leptinnek, hogy jelezze a központi idegrendszer számára az élelmiszer-bevitel csökkentését (1. ábra), a szimpatikus kiáramlás növelését és az energiafogyasztás növelését is, ami súlycsökkenéshez vezet (katabolikus hatások). A leptin szekréciójának és jelzésének zavarai fokozott táplálékfelvételt (1. ábra), parasimpatikus kiáramlást és energiatárolást okoznak, és súlygyarapodáshoz (anabolikus hatások) vezetnek. Az elhízás fő patogenezisében tehát szerepet játszhat az elégtelen leptin-szekréció és a leptin-rezisztencia. .
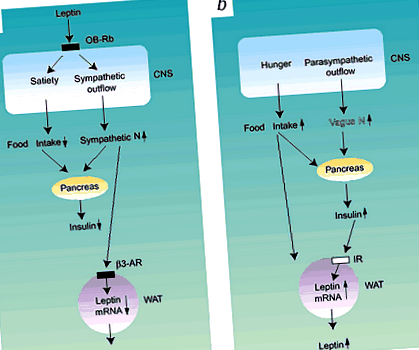
a, a Leptin fokozza a szimpatikus idegaktivitást, amely gátolja az inzulin és a leptin szekrécióját (autonóm áramkörök), és gátolja az etetést (tápláló áramkörök). b, A megnövekedett táplálékfelvétel és a vagális idegaktivitás serkenti a hasnyálmirigy inzulin szekrécióját, ami a fehér zsírszövet által fokozott leptin expressziót és szekréciót eredményezhet. CNS, központi idegrendszer; N, idegrendszer; OB-Rb, b leptin receptor; IR, inzulinreceptor; β3-AR, β3-adrenerg receptor, WAT, fehér zsírszövet.
A leptin receptor (LEPR) a hipotalamusz azon régióiban fejeződik ki, amelyek részt vesznek az energia-anyagcsere szabályozásában. Habár a CNS-ben a leptin hatását közvetítő összekapcsolt utak összetettek, a központi idegrendszerben az energia-anyagcsere szabályozásának be- és kikapcsolása ezen elképzelés valószínűleg összhangban áll az energiaegyensúly idegi szabályozásának klasszikus elméleteivel: a hipotalamusz jóllakottság központjának aktiválása csökkenti az élelmet bevitele és növeli a szimpatikus idegi kiáramlást, ami katabolikus hatásokhoz vezet, míg az éhségközpont aktiválása növeli az ételbevitelt és a paraszimpatikus idegi kiáramlást, ami anabolikus hatásokat eredményez 3,4 (1. ábra). A táplálást és az autonóm idegrendszer működését szabályozó központi idegi mechanizmusok párhuzamosan fordulnak elő. A túlevés ellenére azonban egyesek képesek fenntartani a normális testsúlyt, vagy akár csökkenteni is a testsúlyt, ami azt jelzi, hogy az etetési magatartás változásai nem mindig korrelálnak a testtömeg változásával, és az etetési magatartáson kívül más tényezők is szerepet játszhatnak a testtömeg szabályozásában. Tehát a központi idegrendszer hasonlóan továbbítja az ételbevitel és az autonóm idegrendszer stimulációjának jeleit?
A keringő leptin először jelzi a központi idegrendszer számára, hogy gyorsan növelje a szimpatikus kiáramlást, majd gátolja az 5 táplálékfelvételt (1. ábraa). A szimpatikus idegrendszer fokozza a lipolízist, a termogenezist és az energiafelhasználást, miközben elnyomja a hasnyálmirigy inzulin szekrécióját 4 és a leptin expresszióját a fehér zsírszövetben a 6 β3 adrenerg receptoron keresztül (1. ábraa). Tehát negatív visszacsatolási rendszer van a szimpatikus idegrendszeri stimuláció és a leptin termelés között (1. ábraa). Azok az egerek (ob/ob), amelyekben a leptin gén megbomlott, és az egerek (db/db) és a patkányok (fa/fa), akiknél a leptin receptor szignalizációjának genetikai zavara volt, hiperfágiát, hiperinsulinémiát és csökkent szimpatikus kiáramlást mutatnak, ami az élet korai szakaszában elhízáshoz vezet 1,2,3 .
Az inzulin szabályozása szintén fontos a testsúly szabályozásában. A hasnyálmirigy-szigetek β-sejtjeiből kiválasztott inzulin az étel bevitelére fokozza az üzemanyagok, például glükóz és trigliceridek zsírsejtekbe történő szállítását. Az inzulinhiányos állapotok valószínűleg csökkentik az intracelluláris üzemanyag-felhasználást, ami a zsírtömeg csökkenéséhez vezet. Ezért a csökkent inzulin szekréció az 1-es típusú cukorbetegségben és a súlyos 2-es típusú cukorbetegségben súlyvesztéshez vezet, a hyperphagia ellenére. Az 1-es típusú cukorbetegség sztreptozotozin-modelljében, amelyben az inzulinszekretáló β-sejtek megsemmisülnek, a fogyás annak ellenére következik be, hogy hiperfágia társul a plazma leptinszintjének csökkenésével és az Y neuropeptid, az orexigén peptid fokozott expressziójával a hipotalamuszban 10, 11. Ez ellentétben áll az ob/ob egerekkel, amelyek hiperinsulinémiával és hyperphagiával járó elhízással, csökkent plazma leptinszinttel és megnövekedett neuropeptid Y mRNS expresszióval rendelkeznek az 1,2,3 hipotalamuszban. A hyperphagia és a plazma leptin alacsony szintje ezért nem mindig társul a testtömeg növekedésével.
Az ételbevitel szabályozása mellett az autonóm idegrendszer fontos a hasnyálmirigy β sejtjeinek inzulintermelésének szabályozásában. A hasnyálmirigyet szimpatikus és parasimpatikus idegsejtek innerválják, és a hasnyálmirigybe irányuló fokozott paraszimpatikus kiáramlás (a vagus ideg közvetítésével) stimulálja az inzulin szekréciót a muszkarin acetilkolin 3,4,9 receptorain keresztül (1. ábrab). A hiperinsulinémia, amelyet nem a hyperphagia, hanem a fokozott vagális idegaktivitás közvetít, lehet az elhízás elsődleges oka a ventromediális hipotalamusz elektromos elváltozásai, az Y neuropeptid krónikus intracerebroventrikuláris injekciója, valamint fa/fa patkányok és ob/ob egerek 3 által okozott elhízásnak, 12. A hiperfágikus fiatal felnőtt 5-HT2c receptorhiányos egerek normál bazális plazma inzulinszintje és testtömege azonban azt jelzi, hogy hiperfágia az inzulinszekréció idegi stimulálása nélkül jelentkezik 8. A későn megjelenő hiperinsulinémia elhízott 5-HT2c receptorhiányos egerekben a mutáció másodlagos következménye. Ezek a megállapítások azt mutatják, hogy a vagus ideg által stimulált hasnyálmirigy inzulin szekréció fontos, de összetett szerepet játszik az elhízás kialakulásában.
Az adipociták expresszálják az adrenerg receptorokat, ezért őket a szimpatikus stimuláció befolyásolja, a paraszimpatikus rendszer azonban nem. A paraszimpatikus idegrendszer zsíranyagcserére gyakorolt hatásait azonban az inzulin közvetítheti, amely anabolikus hatást fejt ki az energia-anyagcserére (1. ábra b). Az inzulin a leptin expressziójának és szekréciójának fokozását is szolgálja a fehér zsírszövet által 13,14,15. Ezután a leptin növeli a szimpatikus kiáramlást és az energiafelhasználást.
Így a táplálékbevitel és az energia-anyagcsere szabályozásában részt vevő, jól tanulmányozott molekulák mellett az autonóm idegi áramköröknek is megfelelően kell működniük ahhoz, hogy a megnövekedett energiafogyasztást a megnövekedett energiafelhasználás kompenzálja. Az autonóm idegi áramkörök diszfunkcióját az etetési magatartás mellett a központi idegrendszer által közvetített elhízás elsődleges okaként kell figyelembe venni.
Hivatkozások
Friedman, J. M. és Halaas, J. L. Leptin és a testtömeg szabályozása emlősökben. Természet 395, 763–770 (1998).
Elimquist, J. K., Maratos-Flier, E., Saper C. B. és Flier, J. S. A leptinre adott válaszok hátterében álló központi idegrendszeri utak feltárása. Természet Neurosci. 1, 445–450 (1998).
Bray, G.A. & York, D.A. Hipotalamusz és genetikai elhízás kísérleti állatokban: Autonóm és endokrin hipotézis. Physiol. Fordulat. 59, 791–809 (1979).
Shimazu, T. A máj glükóz metabolizmusának idegszabályozása emlősökben. Diabetes Metab. Fordulat. 3, 185–206 (1987).
Collins, S. et al. A leptin szerepe a zsírszabályozásban. Természet 380, 677 (1996).
Mantzoros, C.S., et al. A β3 adrenerg receptorok aktiválása elnyomja a leptin expresszióját és közvetíti az egerek táplálékfelvételének leptin-független gátlását. Cukorbetegség 45, 909–914 (1996).
Curzon, G., Gibson, E.L. & Qluyomi, A.Q. Az általánosan használt gyógyszerek étvágycsökkentése az 5-HT receptoroktól függ, de nem az 5-HT elérhetőségétől. Trends Pharmacol. Sci. 18., 21–25 (1997).
Nonogaki, K., Strack, A.M., Dallman, M.F. & Tecott, L. H. Leptin-független hyperphagia és 2-es típusú cukorbetegség mutáns szerotonin-5-HT2c receptor génnel rendelkező egerekben. Nature Med. 4, 1152–1156 (1998).
Nonogaki, K. & Iguchi, A. Stressz, akut hiperglikémia és hiperlipidémia: az autonóm idegrendszer és a citokinek szerepe. Trendek Endocr. Metab. 8., 192–197 (1997).
Havel, P.J. et al. A keringő leptin markáns és gyors csökkenése streptozotocin diabéteszes patkányokban: inzulin általi megfordítás. Am. J. Physiol. 274, R1482 – R1491 (1998).
Malabu, U.H. et al. A krónikus vanadát adagolásának hatásai az STZ által kiváltott diabéteszes patkányokban. Cukorbetegség 43, 9–15. (1994).
Sainsbury, A. et al. Krónikus központi neuropeptid Y infúzió normál patkányokban: a hipotalamo-hipofízis-mellékvese tengely állapota és a hyperinsulinemia vagális mediációja. Diabetologia 40, 1269–1277 (1997).
Saladin, R. et al. Az elhízott gén expressziójának átmeneti növekedése étkezés vagy inzulin beadása után. Természet 377, 527–529 (1995).
Biden, G., Chen, X., Kolaczynski, J.W. & Polansky, M. Az elhúzódó hiperinsulinémia hatása a szérum leptinre normális emberi alanyokban. J. Clin. Invest. 100, 1107–1113 (1997).
Barr, V.A. et al. Az inzulin mind a leptin szekrécióját, mind a patkány fehér zsírszövetének termelését serkenti. Endokrinológia 138, 4463–4472 (1997).
Szerzői információk
Hovatartozások
Kaliforniai Pszichiátriai Egyetem Neurobiológiai és Pszichiátriai Tanszékének központja, San Francisco, 401 Parnassus Avenue, San Francisco, 94143-0984, Kalifornia, USA
A PubMed Google Scholar alkalmazásban is kereshet erre a szerzőre
- Elhízás és genetika - természet - ápolás - elhízás-egészségügyi szövetség
- Stressz, étrend és hasi elhízás Y Nature Medicine
- Alvási apnoe és elhízás - Obesity Medicine Association
- Új CDC-jelentés az elhízásról A rossz hírek és a jó hírek Stony Brook Medicine
- Tehát mi az az elhízás-orvos szakorvos a Bariatric Times-ban