Fehérje
Az LRP egy fehérjecsaládba tartozik, amely magában foglalja az LDL-receptort, a megalint (más néven gp330), a VLDL-receptort és a vitellogenin-receptort (Krieger és Herz, 1994).
Kapcsolódó kifejezések:
- Szénhidrát
- Etanol
- Hippocampus
- Alzheimer kór
- Axon
- Dopamin
- Genomika
- Neuronok
- Neurotranszmitterek
- Oxidatív stressz
Letöltés PDF formátumban
Erről az oldalról
Táplálkozási menedzsment a terhességi cukorbetegség szempontjából
6. FEHÉRJE
Az étkezésekbe és harapnivalókba történő fehérjebevitel nem befolyásolja jelentősen a vércukorszintet, így további energiát nyújthat a szénhidrát helyett. A vércukorszint-monitorozás meghatározza, hogy a fehérje hasznos-e egy adott ember vércukorszintjének szabályozásában. Általában a szénhidrát és a fehérje étkezéskor és lefekvéskor történő párosítása jobb étkezés utáni vércukorszintet biztosít a fehérje és a zsír által okozott késleltetett szénhidrát felszívódás miatt. A terhesség alatt a fehérje ajánlott étrendi mennyisége (RDA) 60 g/nap [23]. A fehérje RDA-ja könnyen teljesíthető a GDM étkezési terveiben, mivel a fehérje általában 20-25% energiát tartalmaz.
Az 1a (CRIP1a) és a Cannabinoid 1 receptor kölcsönhatásban lévő kannabinoidreceptor fehérje – fehérje kölcsönhatásai: A molekuláris mechanizmus vizsgálata integrált molekuláris modellezési megközelítésen keresztül
CRIP1a másodlagos szerkezet predikció
A szövetmérnöki és a regeneratív orvoslás szerves, polimer és biopolimer felületeinél precízen ellenőrzött fehérjék
Streptavidin a biomolekuláris orientáció ellenőrzéséhez
A streptavidin fehérje számos előnnyel jár, mint a fehérjék orientálásának és a fehérjékből származó jelek továbbításának eszköze. Szimmetrikus négyértékűsége számos lehetőséget kínál a felületi megkötéshez, a fehérje megkötéséhez és a molekuláris orientációhoz. A sztreptavidin robusztus, kivételesen magas biotinkötési affinitással rendelkezik (Ka = 1014), és nem túl nagy, ami csökkenti a szterikus aggodalmakat (53 kDa). A 31.7B ábra szemlélteti a sztreptavidin alkalmazásának egyik lehetőségét a megfelelő orientált fehérjékből származó jelek továbbítására. Számos publikáció áll rendelkezésre a sztreptavidin más fehérjék immobilizálására és orientációjuk szabályozására történő felhasználásáról [47–49] .
Táplálkozás és élelmiszer-biztonság
Theodore H. Tulchinsky MD, MPH, Elena A. Varavikova MD, MPH, PhD, a The New Public Health (harmadik kiadás), 2014
Fehérjék
A fehérjék nagy aminosavakból álló molekulák, amelyeket az emésztési folyamat összetevő egységeikre bont (1 g fehérje 4 kcal-t eredményez). A test számára szükséges biológiai anyagokban 20 általános aminosav található. Az emberek nem képesek kilenc ilyen aminosavat szintetizálni, ezért elengedhetetlen az állati eredetű fehérjék vagy az élelmiszer-kombinációk, például hüvelyesek és gabonafélék fehérje fogyasztásával történő megszerzése. A kisgyermekek és serdülők fehérjére van szükségük növekedésükhöz. A fehérjék a testben a sejtek és szövetek szerkezeti komponenseiként működnek, enzimek, amelyek a kémiai reakciók katalizátoraként működnek, és hormonok, amelyek kémiai hírvivőként működnek. A fehérje és a kalória hiányát az étrendben fehérje-energia alultápláltságnak (PEM) nevezzük.
Az anyagcsere veleszületett hibái
K. Energia
A fehérje és az energiaigény összefonódik. Ha az étrend nem biztosít elegendő energiát, a szervezet a fehérjét energiaforrásként használja fel az alapvető energiaigények kielégítésére. Ha a fehérjét energiaforrásként használják, akkor nem lehet beépíteni fehérjét tartalmazó anyagokba, például izomba, enzimekbe és hormonokba. A fehérje katabolizmusnak jelentős metabolikus következményei lehetnek egyes anyagcserezavarokban, például a szerves sav és a karbamid ciklus rendellenességeiben, ahol a katabolizmus problematikus.
Az anyagcserezavarral küzdő csecsemők és gyermekek energiaigénye megnő, csecsemőkorban gyakran 120–140 kcal/kg [14]. Az energiaigény rendellenességenként és gyermekenként változó. Ezért elengedhetetlen a növekedés, a biokémiai paraméterek és a tápanyagbevitel körültekintő figyelemmel kísérése a kezelés megfelelőségének értékelése érdekében.
A további fehérjamentes energiaforrások fontos kiegészítői az anyagcsere-rendellenességek étrendi kezelésének. Azok az ételek, amelyek módosítása alacsony fehérjetartalomra vonatkozik, mint például lisztek, tészták és sütemények, megfelelő és szükséges energia- és változatosságot jelentenek az étrendben. A forrásokat a 10. táblázat sorolja fel .
Neurotoxinok
Erwann P. Loret,. Hervé Rochat, in Methods in Neurosciences, 1992
Általános elvek
A rovarokon aktív fehérjéket Észak-Afrikában és a Közel-Keleten (3, 7, 11, 19–22), valamint Kínában (23) gyűjtött skorpiómérgekből tisztították. Különböző módszerek alkalmazhatók a toxikus fehérjék tisztítására egy nyers skorpióméregből. A különböző tisztítási lépéseket kvantitatív toxicitási vizsgálattal kell ellenőrizni. A skorpion toxinok három tulajdonság szerint tisztíthatók: a molekulatömeg, az elektromos töltés és a hidrofóbitás. A skorpió toxinok tisztításában a hidrofób tulajdonság a leghatékonyabban hasznosítható, de a skorpióméregben jelen lévő fehérjék nagy száma miatt általában mindhárom jellemzőt meg kell követelni. A skorpióméreg bonyolultsága megnő, amikor elektromos stimuláció után összegyűjtik. A manuális stimuláció áll a legközelebb a természetes kiválasztási feltételhez, és méreganyagokban gazdag mérget biztosít, összehasonlítva az „elektromos” mérgekkel, amelyek sok inaktív fehérjét tartalmaznak.
Capsicum: Természetes fájdalom-modulátor
rövidítések listája
Kalcitonin génnel kapcsolatos fehérje
Központi idegrendszer
A háti gyökér ganglionjai
Humán immunhiány vírus
Humán immunhiányos vírus által segített neuropathia
Humán immunhiányos vírus-disztális szenzoros polineuropátia
Nemzetközi Fájdalomkutató Szövetség
Numerikus fájdalomérték-skála
Periacqueductalis szürke terület
Rostralis elülső cinguláris kéreg terület
Elterjedt idegkárosodás
Subnucleus reticularis dorsalis
Átmeneti receptor potenciál
Tumorfekrózis-alfa
Egyesült Államok Élelmiszer- és Gyógyszerügyi Hivatala
Szállítási technológiák alkalmazása a protein-kináz aktivitás modulálására
Bevezetés
A fehérjék különféle élettani folyamatokban vesznek részt, a sejtek fenntartásától az öregedésig. Ilyen például a fehérje-deacetilázok, az Sir2 fehérjék, amelyek - bár ellentmondásos módon - összefüggenek a kalória-korlátozás által közvetített hosszú élettartammal [1,2]. További példák: TSC1/2 [3], Rheb [4], riboszomális RNS feldolgozási faktorok [3,5], Raptor [6] és S6 kináz 1 [7]. Ezek a fehérjék alkotják a TOR útvonal jelátadó magját vagy jelátviteli kimenetét. Itt érdemes megjegyezni, hogy ami a „fehérjéket” és a „peptideket” illeti, egyelőre nincs egyértelmű határ a két kifejezés között, a tudományos közösség nem ért egyetértéssel e két kifejezés használatával kapcsolatban. A könyv vitáihoz a szilárd fázisú rutin peptidszintézis felső határát vesszük alapul. Ezért úgy gondolják, hogy a „peptid” olyan, amely legfeljebb 50 aminosavat tartalmaz; míg a „fehérje” nagyobb méretű. Mivel a fehérjék a makromolekulák nagyon nagy csoportja, nagyon eltérő 3D-s szerkezettel, lehetetlen lefedni az összes fehérjét kizárólag egy fejezetben. Ezért a protein-kinázokat alkalmazzuk példaként annak bemutatására, hogy miként lehet a beavatkozásokat megtervezni a fiziológiai modulációhoz.
Fiziológiailag a protein-kinázok olyan enzimek, amelyek katalizálják a y-foszfát adenozin-trifoszfátból (ATP) a treonin, szerin vagy tirozin szubsztrátfehérje oldalláncához való kovalens kapcsolódását. A katalitikus domén szerkezete alapján a protein-kinázok több csoportba sorolhatók, ideértve az AGC-kinázokat, a tirozin-kináz-szerű kinázokat, a tirozin-kinázokat, a kalcium/kalmodulin-függő protein-kinázokat (CAMK), az I. típusú kazein-kinázokat, a CMGC-kinázokat, és STE kinázok [8]. Ezenkívül az általuk foszforilezett aminosav alapján a protein-kinázok nagyjából két csoportra oszthatók: szerin/treonin kinázokra és tirozin kinázokra [8]. Mivel a protein-kinázok különböző szubsztrátfehérjékre képesek hatni, a transzkripciós faktoroktól (pl. C-Jun) egészen más enzimekig (pl. Glikogénszintáz), modulálni tudják a fehérjepartnerek tulajdonságait (pl. Szubcelluláris lokalizáció és enzimatikus aktivitások) jel kaszkádok. Emiatt a protein-kinázok fontos szerepet játszanak a génexpresszióban és számos más fiziológiai folyamatban (például az energia-anyagcserében, a sejtciklus progressziójában és az apoptózisban). Célként szolgálhatnak, amelyek antiaging célokra manipulálhatók.
Szelektív autofágia a Parkinson-kór patogenezisében
Susmita Kaushik,. Ana Maria Cuervo, Parkinson-kór, 2008
Autofágia és fehérje zárványok
Az inklúzió kialakulása egy aktív folyamat, amely a mikroaggregátumok mikrotubulusok mentén történő transzportjára támaszkodva perinukleáris zárványokat képez (Iwata et al., 2005). Ezért csábító azt sugallni, hogy a zárványképződés lehet egy aktív folyamat, amelyet a sejtek felhasználnak a proteazomális terhelés autofág utak felé terelésére. Alternatív megoldásként felmerült, hogy a makroautofágia nem tisztítja közvetlenül az aggregátumokat, hanem az aggregátum prekurzorokat (Rubinsztein, 2006). Az ilyen prekurzorok eltávolítása elmozdíthatja az egyensúlyt az aggregátum képződésétől, ezáltal csökkentve a fehérje zárványok méretét és számát.
Fehérje homeosztázis és öregedés
Az autofágia típusai
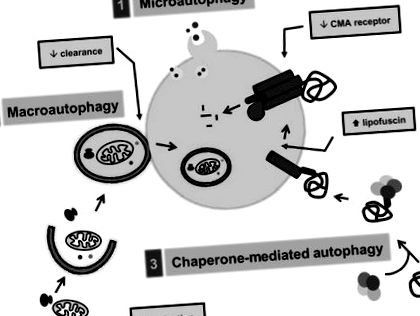
A fehérjék lebomlás céljából a lizoszomális lumenbe különféle utakon juthatnak el, nevezetesen a makroautofágia, a mikroautofágia és a chaperone által közvetített autofágia útján (He & Klionsky, 2009; Mizushima et al., 2008). Ezen autofág utak mindegyikének dedikált molekulakomponensei vannak, differenciálisan szabályozottak és egyedülálló további feladatokat tudnak végrehajtani (13.3. Ábra).
13.3. Ábra Az intracelluláris autofág útvonalak és az életkor előrehaladtával bekövetkező változások (szürke dobozokban). Három különböző mechanizmus járul hozzá a citoszolos rakomány lizoszómákba juttatásához: (1) mikroautofágia, (2) makroautofágia és (3) chaperone-mediált autofágia (CMA).
A fehérjék más kettős membrános vezikulákban vagy autofagosómákban lévő citoszolos komponensekkel együtt makroofofágia útján is elkülöníthetők. Az autofagoszóma a lizoszómákkal való fúzió révén szerzi be a lumintartalmuk lebontásához szükséges enzimeket. Az autofagoszómák kialakulásához egy fehérje egy részcsoportjának konjugálása szükséges más fehérjékhez vagy lipidmolekulákhoz, hogy létrehozzunk egy korlátozó membránt, amely lezárja magát és körülveszi a lebontandó rakományt (Ohsumi és Mizushima, 2004). Majdnem 35 különböző fehérje, általában autofágia-rokon fehérje, vagy Atg, vesz részt a makroautofágiában (Klionsky et al., 2003). Az autofagoszóma képződésében szerepet játszó fehérjekonjugációs kaszkádok mellett más Atg-k is a makroautofágia indukciójához szükséges komplexek részét képezik, mint például a beclin/Vps34 komplex (Itakura et al., 2008). Más fehérjekomplexek megakadályozzák a makroautofágia aktiválódását, konkrétan az mTOR kináz komplex (Noda & Ohsumi, 1998).
A specifikus Atg-k részt vesznek az autofagoszóma/lizoszóma fúziójában, az autofagoszóma-alkatrészek újrafeldolgozásában, sőt a rakomány kiválasztásában is - mint például az Atg32 esetében, amelyről kiderült, hogy szükséges a mitokondriális autofágia szempontjából (Tolkovsky, 2009). A rakomány felismerése valójában az intenzív vizsgálatnak alávetett makroautofágia egyik aspektusa. Különböző rakomány-felismerő fehérjéket azonosítottak. Ezek képesek egyidejűleg megkötni a szubsztrátumban lévő komponenseket és az autofág mechanizmus alkatrészeit (Tolkovsky, 2009). Így ezek a molekulák az autofág mechanizmust el tudják vinni a rakományba, és in situ autofagosómákat képezhetnek. Az első ilyen jellegű fehérje a p62 volt, amelyről kezdetben kimutatták, hogy közvetíti a fehérje-aggregátumok lebomlását a citoszolban (Bjorkoy et al., 2005), és nemrégiben kiderült, hogy segít felismerni az organellákat lebomlás céljából (Kim és mtsai, 2008). Úgy tűnik, hogy más rakományt felismerő fehérjék, például az NBR1, eddig csak a fehérje aggregátumok felismerésére korlátozódnak (Waters et al., 2009).
A citoszolos rakomány lebontáshoz hasonló elkülönítése zajlik a mikroautofágia során, de ebben az esetben a rakomány membránjának invaginációi révén közvetlenül a lizoszómákba kerül (Marzella és mtsai., 1981; Mortimore és mtsai., 1988) (13.3. Ábra). Élesztőben végzett vizsgálatok kimutatták, hogy a mikroautofágia egyes összetevőket oszt meg a makroautofágiával, de ehhez a folyamatra specifikus fehérjék egy részére is szükség van. Noha a mikroautofágia kezdetben emlősökben volt azonosítva, ennek az útnak a molekuláris disszekciójában az élesztő legtöbb előrehaladása történt (Dubouloz et al., 2005). A mikroautofágiában részt vevő élesztőgének emlős homológjait azonban eddig nem sikerült azonosítani. Ez korlátozta az emlősök mikroautofágia megértését, mert jelenleg nincsenek rendelkezésre álló módszerek a folyamat számszerűsítésére emlősökben.
Az emlősöknél leírt harmadik típusú autofágia, a chaperone-mediált autofágia (CMA) gyökeresen különbözik a mikro- és makroautofágiatól. A CMA-ban az egyes oldható citoszolos fehérjéket a lebontás célozza meg, de elválasztásuk helyett a lizoszomális membránon átjutnak, hogy hozzáférjenek a luminalis proteázokhoz (Cuervo, 2009; Dice, 2007) (13.3. Ábra). Csak olyan fehérjéket lehet felismerni, amelyek aminosav-szekvenciájukban specifikus motívumot tartalmaznak (Dice, 1990), a citoszolos chaperone, a Hsc70, amely a szubsztrátot a lizoszomális membránhoz juttatja (Chiang et al., 1989). A szubsztrát egy lizoszómás receptorhoz kötődik, a 2A típusú lizoszómához társuló membránfehérjéhez (LAMP-2A) (Cuervo & Dice, 1996), és kibontakozása után (Salvador et al., 2000) a szubsztrát transzlálódik a segített lizoszomális lumenbe. lizoszómában rezidens chaperone által (Agarraberes et al., 1997). Az élesztőtől az emlősökig konzervált más autofág útvonalakkal ellentétben a CMA nem fordul elő élesztőben, mivel ennek az útnak a korlátozó komponense, a LAMP-2A nincs ott.
- Hasnyálmirigy hormon - áttekintés a ScienceDirect témákról
- Nutraceutical - áttekintés a ScienceDirect témákról
- Ápolási folyamat - áttekintés a ScienceDirect témákról
- Tejzsírszázalék - áttekintés a ScienceDirect témákról
- Fogszabályozás - áttekintés a ScienceDirect témákról