Mészpát
A kalcit kezdetben kimerül, ezt követi a dolomit-ankerit és a sziderit (Blowes és Ptacek, 1994).
Kapcsolódó kifejezések:
- Kálcium-karbonát
- Pusztulás
- Földpát
- Talajvíz
- Gipsz
- Érc
- Kicsapódik
- Pirit
- Kvarc
- Szilikát
Letöltés PDF formátumban
Erről az oldalról
A biomineralizáció szilárdtest-NMR-vizsgálataival kapcsolatos legújabb haladás
Tim W.T. Tsai, Jerry C.C. Chan, az NMR spektroszkópia éves jelentéseiben, 2011
3.1.1 Kalcium-karbonát
A kalcit a kalcium-karbonát legstabilabb formája. 13 C-dúsított kalcit mintáját Phillips és munkatársai tanulmányozták. 74 A 13 C CPMAS jel variációja az érintkezési idő függvényében szorosan hasonlít az elvárt 13 C – 1 H spinpárra, és ezért a kivont belső nukleáris távolság (1,9 ± 0,1 Å) erős bizonyítékot szolgáltat a jelenlétre hidrogén-karbonát hibák. Érdekes módon mind a 13 C < 1 H>A CPMAS spektrum (érintkezési ideje 0,3 ms) és a 13 C Bloch bomlási spektrum egyetlen rezonanciát mutat 168,7 ppm-nél, de a hozzájuk kapcsolódó, 1 kHz-es centrifugálási sebességgel forgó oldalsáv-minták meglehetősen eltérőek. Nyilvánvaló, hogy az izotrop 13 C kémiai eltolódás nem jó spektrumkészítő a kalcit karbonátcsoportok és bikarbonát hibák megkülönböztetésére. A 13 C-tól < 1 H>A HETCOR-mérés, az 1 H jel 7,4 ppm mellett, amely az 1 H MAS spektrumban is megfigyelhető, a kalcit bikarbonát hibáihoz van hozzárendelve. 74 Ez a viszonylag éles csúcs, 7,4 ppm mellett a természetes kalcit minták 1 H MAS spektrumában is megfigyelhető. 74 Ideiglenesen megjegyezzük, hogy a K2CO3 és a KHCO3 13 C kémiai eltolódásai és CSA-ja nagyban különbözik a kalcittól, feltehetően a hidrogénkötés erősségében mutatkozó különbségek miatt. 74–76
Felszíni és talajvíz, időjárás és talaj
7.2.8.4.4 Pirit oxidáció kalcit oldással és semlegesítéssel
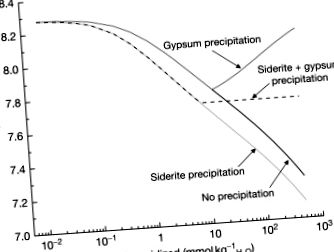
Az ásványosított területeken a kalcit gyakran található a pirittel együtt. A mészkövet az AMD semlegesítésére is használják. Ezen okok miatt a következő modellezendő reakciókészlet a pirit és a kalcit keveréke lenne, de dönteni kell ezen ásványi anyagok arányáról és arról, hogy milyen ásványi anyagokat szabad kicsapni másodlagos fázisként. A legegyszerűbb eset anoxiás körülmények között történne, így a Fe (II) nem oxidálódik, a kalcit feleslege lehetővé tenné a gipsz és a sziderit kicsapódását. Ezt a szimulációt a 10. ábra, másodlagos ásványok kicsapódásával és anélkül, és mindig nyitott rendszerben. Bár a pH másodlagos ásványok képződése nélkül csökken, ez elsősorban a kalcit és a pirit oldódásának relatív arányának köszönhető. Ezzel szemben a gipsz kicsapódásának a hatása növeli a pH-t, mert az egyensúly fenntartásához nagyobb mennyiségű kalcitnak kell feloldódnia a gipszes kicsapással eltávolított kalcium helyettesítésére. Sziderit és gipsz kicsapással a pH pufferolva van, mert az egyensúlyi reakcióban nem képződnek és nem fogynak el protonok:
10. ábra A pH változása a bőséges kalcit jelenlétében oxidált pirit függvényében olyan vonalakkal, amelyek az (i) másodlagos ásványi kicsapódás, (ii) csak a gipsz kicsapásának, (iii) csak a siderit kicsapásának és (iv) kicsapásának hatásait mutatják gipszből és szideritből.
Ezenkívül mind a gipsz, mind a sziderit kicsapódása azonos körülmények között következik be, miután körülbelül 10 mmol kg pirit H2O - 1 oxidálódott (vagy csaknem 550 mg l - 1 oldott vas és 2000 mg l - 1 oldott szulfát). Oxigén körülmények között hasonló tendencia figyelhető meg pH = 7,72 mellett, gipsz és ferrihidrit csapadék esetén is.
11. ábra a) A pH változása az oxidált pirit függvényében, és a kalcit/pirit molarányának 0,5 és 2 közötti változásához viszonyítva, az oldott vas oxidációja nélkül. Legalább 1: 1 mólarányra van szükség a pH semleges közeli pufferezéséhez, de ha a másodlagos fázisokat (gipsz és sziderit) kicsapódni hagyják, nagyobb, körülbelül 2-es arányra van szükség. (b) A pH változása az oxidált pirit függvényében és a kalcit/pirit mólarányának 0,5 és 2 közötti változásához viszonyítva az oldott vas oxidációjával. Ez a diagram azt jelzi, hogy 2-nél nagyobb mólarányokra van szükség a pirit oxidációjából származó savasság megfelelő semlegesítéséhez.
Kálcium-karbonát
5.1 Kristályfázis transzformáció
A kalcit, a CaCO 3 stabil, vízmentes formája, növekvő nyomással több strukturális átmeneten megy keresztül a sűrűbb II – IV kalcit fázisok felé [108,110,111]. A fent említett kalcit formák mellett létezik egy sűrűbb formájú kalcit VI is, amely sokktömörítési kísérletek segítségével kialakítható [112]. Még magasabb nyomáson (> 100 kbar) a kalcitról ismert, hogy még egy fázisátmeneten megy keresztül, amelyet IV kalcitnak neveznek [114–116]. A monohidrokalcit, a kalcit hidrátformája azonban termodinamikailag nem stabil, és a kristályos víz (pl. Kalcit és aragonit) elvesztése esetén más kristályfázisokká alakul át [78, 240]. Ezenkívül az alacsony Mg-tartalom vizes oldatban környezeti hőmérsékleten 25 nap alatt aragonittá alakul át [373,374] .
Az aragonit, a CaCO3 metastabil vízmentes formája, száraz körülmények között, 400 ° C alatti hőmérsékleten több tízmillió évig változatlan marad. Ha azonban víz van jelen, az aragonit a vízben való nagyobb oldhatósága miatt néhány hónap alatt kalcittá alakul. Az oldhatóság különbsége az egyik oka annak, hogy az aragonit nem olyan gyakori a geológiai ágyakban, és ritkán található meg szervesen ellenőrzött rendszereken kívül [225]. Normál hőmérsékleten és nyomáson az aragonit termodinamikailag instabil és hajlamos a kalcittá változni [375]. Nagy nyomáson stabil fázissá válik [117]. A CaCO3-ban 40 GPa nyomáson posztaragonit fázist és számos energetikailag versengő struktúrát (stabil I fázis és metastable II – IV fázis) azonosítottak [118]. 137 GPa felett az I fázis piroxén típusú szerkezettel, CO4 4 - tetraéderláncokkal stabilabbá válik, mint a posztaragonit.
A vaterit a CaCO3 metastabil, vízmentes formája a környezeti körülmények között is, és miután víznek van kitéve, aragonittá vagy kalcittá alakul [376]. A geológiai körülmények között ritka ásvány, bár fontos előanyaga lehet számos karbonátképző folyamatnak [238] .
A CaCO3 amorf formája instabil szilárd fázis, amely gyorsan átalakul stabilabb vízmentes formákká, míg a két hidratált forma monohidrokalcit és ikait néhány napig változatlanul 0 ° C alatti hőmérsékleten tartható, mielőtt kalcittá alakulna át. Ennek eredményeként az ikait előállítását - 10 ° C alatti hőmérsékleten hajtották végre [62]. A magnéziumionok észrevették, hogy tovább fokozzák az amorf CaCO3 aragonittá történő átalakulását [128]. Bentov és mtsai. javította az amorf CaCO3 stabilitását foszfátban gazdag szerves mátrixfehérjék és egyetlen foszfoaminosavak segítségével [377]. Az ilyen stabil forma javította az oldhatóságot és a biológiai hozzáférhetőséget a kristályos formához képest [378,379] .
Az ikait, a CaCO3 hidrátformája, mérsékelt nyomáson termodinamikailag stabil, a föld felszíne közelében. Megtalálták a mélytengeri és a kontinentális talapzat üledékeiben, valamint a tavakban, a jeges környezetben, a part menti vizekben és a tengeri jégben a talajvíz kibocsátási helyeken [380–383]. Gyorsan lebomlik, ha elveszíti víztartalmának nagy részét, miután eltávolította a fagyáshoz közeli vízből [239]. Az amorf és az ikait formák egyaránt áttételesek a környezetben, és könnyen átállnak a stabilabb kalcit formára [223,375] .
Olajmező ásványi skála ellenőrzése
Ping Zhang,. Mason B. Tomson, Ásványmérlegek és betétek, 2015
24.2.1. Karbonát mérlegek
Dolomit. A dolomit a Ca0,5Mg0,5 (CO3) ásványi neve. A dolomit geológiai képződményekben idővel keletkezhet kalcitból, de a termelő létesítményekben nem figyelhető meg.
Felületszintézis az ömlesztett szigetelő kalcit (10.4) felületén
Mészpát
A kalcit a kalcium-karbonát (CaCO 3) legstabilabb módosulata. Mint ilyen, fontos kőzetalkotó ásványi anyag és a földkéregben a leggyakoribb karbonát. 18 Számos geokémiai, biológiai és ipari folyamatban játszik nagy szerepet. A kalcit részt vesz a föld karbonát körforgásában, és így például kulcsfontosságú az antropogén szén-dioxid tárolásához is. Az aragonit és a vaterit termodinamikai kevésbé stabil módosításai mellett a kalcit számos biominerálban fontos összetevő, és emellett jól ismert a kettős törése miatt ( 1A. Ábra )
1. ábra . (A) Kalcitkristály fényképe, (B) a (10.4) hasítási sík modellje az egységcellával, amelyet téglalap jelöl, és (C) a kalcit (10.4) AFM képe UHV-ban.
A kalcit egy 6 eV körüli sávréssel rendelkező szigetelő, amely R-vel trigonális rendszerben kristályosodik3c szimmetria. A primitív egységsejt egy rombohedron, amelyet „szerkezeti egységsejtként” is emlegetnek. A szerkezeti egység sejtjének romboéderes tengelyeit felhasználva a legstabilabb hasítási sík a (211) sík. Ugyanakkor a hatszögletű egységcellát ehelyett gyakran használják az irodalomban. Ebben a hatszögletű rendszerben a legstabilabb hasítási síkot a (1014) sík - gyakran rövidítve írásban (10.4), ahol a pont segít jelezni a hatszögletű egység cellát, amely referencia.
A (10.4) hasítási síknak van egy téglalap alakú egységsejtje, amelynek méretei 0,50 nm × 0,81 nm. 1B. Ábra . Az egységsejt két kalciumiont és két karbonátcsoportot tartalmaz. Az utóbbiak oxigénatomja a szénatomok által meghatározott síkon belül, felett és alatt helyezkedik el. Az egységcellában lévő két karbonátcsoportot egymáshoz képest forgatják. Az UHV alatt szobahőmérsékleten nyert kalcit (10.4) reprezentatív nagyfelbontású AFM képét reprodukáljuk 1C. Ábra .
Dislokációk az ásványokban
2.4 Karbonátok
A kalcit és a dolomit az üledékes kőzetek jelentős részét képviseli. A kalcit CaCO 3 trigonális szimmetriával rendelkezik, bár általában hatszögletű tengelyekben írják le. 1 3. 02. 2. 1. < 1 1 ¯ 04 >az előnyös csúszórendszer kalcitban széles hőmérsékleti tartományban (Wenk et al. 1983). 500 ° C felett a kalcit 1 3 by 11 2 ¯ 0〉 (0001) csúszással és 1 3 〈01 1 ¯ 0〉 deformálódhat is. < 1 1 ¯ 02 >(De Bresser és Spiers 1997). Alacsony hőmérsékleten az 1 3 〈02 2 ¯ 1〉 diszlokációk nemcsak tovább csúsznak < 1 1 ¯ 04 >, hanem tovább < 1 1 ¯ 02 >(bár ez utóbbi csúszórendszer magasabb kritikus megoldott nyírófeszültséggel (CRSS) rendelkezik; De Bresser és Spiers 1997). A mechanikus testvérvárosi kapcsolat fontos deformációs mechanizmus a kalcitban. A leggyakoribb deformációs testvérvárosi törvény érvényben van < 01 1 ¯ 8 >, amelyeknél a nyírási elmozdulás pozitív értelemben a 〈0 2 ¯ 21〉 irányba mutat (Barber és Wenk 1979). Kisebb deformáció ikerintézmény a < 1 1 ¯ 04 >és < 1 1 ¯ 02 >repülőgépekről is beszámoltak.
- Atkins Diet - áttekintés a ScienceDirect témákról
- Atrófiás gyomorhurut - áttekintés a ScienceDirect témákról
- Fekete kömény - áttekintés a ScienceDirect témákról
- Auriculoterápia - áttekintés a ScienceDirect témákról
- Az űrgyógyászat áttekintése - ScienceDirect