Kalóriák, szénhidrátok és rákterápia sugárzással: az öt R kiaknázása étrendi manipulációval
Rainer J. Klement
Sugárterápia és Sugár Onkológiai Osztály, Leopoldina Kórház Schweinfurt, Gustav-Adolf-Straße 8, 97422 Schweinfurt, Németország
Colin E. Champ
Sugár onkológiai tanszék, Pittsburghi Egyetem Rák Intézet, Pittsburgh, Pennsylvania, USA
Absztrakt
Háttér
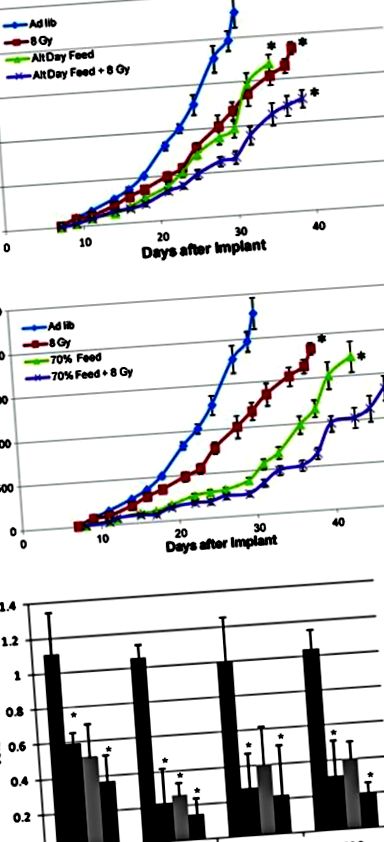
Tápanyaghiány alternatív böjtöléssel (a) vagy az általános kalória-korlátozás (b) szinergikusan működnek a sugárterápiával, hogy jelentősen lassítsák a daganatok növekedését és számos kulcsút lefelé történő szabályozását (c). AL ad libitum táplálás, CR kalória-korlátozás (Saleh et al. [21] engedélyével készült)
Ennek a felülvizsgálatnak a célja tehát a CR és a KD potenciális előnyeinek tudatosítása a rákos betegek kezelésének kiegészítéseként az RT alatt, és az erős preklinikai adatok azt mutatják, hogy ezek a módok javíthatják az RT hatékonyságát. Ezek az előnyök a sejtszinttől a globális anyagcseréig terjednek, és hangsúlyozzák a tumorsejtek metabolizmusa és a gazdaszervezet közötti kapcsolatot. A hangsúly ezen étrendi módosítások közös vonásain és különbségein is szerepel, amelyeket figyelembe kell venni a kiegészítő étrendi kezelési stratégiák kidolgozása során.
Kalória vagy szénhidrát? A kalória-korlátozás és a ketogén étrend hasonló metabolikus hatásai
A CR-t általában az alultápláltság nélküli energiafogyasztás 30–50% -os csökkentésének definiálják az ad libitum etetéshez képest. A kalóriadeficit kiváltható akár szakaszos böjtöléssel (IF), amelynek legszélsőbb formája a csak vizet tartalmazó rövid távú éhezés (STF), vagy a krónikus napi energiakorlátozás (DER). Mivel azonban a preklinikai adatokat extrapolálják az emberre a klinikai kutatás tervezéséhez, fontos kiemelni, hogy az egerekben a DER megfelel az emberek terápiás STF-jének. E vonalak mentén az egér 1 napos koplalása nagyjából összehasonlítható egy héten át csak vízzel történő böjtöléssel embernél [23].
A kalória-korlátozás (CR) és a ketogén étrend (KD) ugyanazokat a molekuláris utakat célozza meg, amelyeket a gyógyszerek egyenként is megcéloznak a rákkezelés eredményeinek javítása érdekében. A nyilak az aktiválást, a csonka vonalak gátlását jelzik. A szénhidrát (CHO) korlátozása fokozza a zsírsavak oxidációját és a ketogenezist (hasznos a normál szövetek számára), és rontja a glikolízist és a glutaminolízist (káros a daganatsejtekre). További részletekért lásd a 2. szakaszt
Hogyan befolyásolhatja a kalória- és szénhidrátkorlátozás a sugárterápiára adott választ
A tipikus tumor kontroll valószínűségének (folytonos kék vonal) és a normális szöveti szövődmény valószínűségének (piros folytonos vonal) görbéjének ábrája a daganatba juttatott teljes dózis függvényében. Azt állítjuk, hogy a CR és esetleg a KD növelheti a terápiás ablakot, kedvezően befolyásolva mindkét görbét, azaz a tumor és a normál szövet közötti differenciális választ
A radiobiológia öt R-je
DNS károsodás helyrehozása
Az ionizáló sugárzás kölcsönhatása a szövetben lévő molekulákkal szabad elektronok termelődéséhez vezet, és gyöknek nevezett töltetlen molekulákat hagy maga után párosítatlan vegyértékű elektronokkal. A víz radiolízise a DNS-en kívüli leggyakoribb ionizációs esemény, amely reaktív oxigénfajok (ROS) képződéséhez vezet, beleértve a hidroxilgyököt (OH •) és annak oxigénnel, hidrogén-peroxiddal (H2O2) reagált termékét. A ROS képes diffundálni és oxidálni a DNS-t különböző helyeken, beleértve a cukor-foszfát gerincet is, ami egy- (SSB-k) és kettős szálú törésekhez (DSB-k) vezet. Míg egyetlen elváltozás általában helyrehozható és szubletálisnak tekinthető, a subletalis elváltozások felhalmozódása a növekvő dózis mellett kölcsönhatásukhoz és halálos elváltozásokká való átalakuláshoz vezethet. A daganatok és a normál szövetek közötti különbségek a szubletális károsodások helyrehozásának képességében ezért fontos okai a frakcionált RT-nek.
Ezzel szemben lehetséges, hogy a CR károsítja a daganatsejtek DSB-javulását, és ezáltal hozzájárul a megnövekedett sejthalálhoz. Chen és mtsai. kimutatta, hogy a rapamicin vagy everolimusz általi mTOR-gátlás károsítja a HRR-t és az NHEJ-t MCF7 emlőrákos sejtekben, anélkül, hogy számos fontos DNS-helyreállító fehérjében jelentős változások történnének [60]. Fontos, hogy a CR dózisfüggő hatását az AMPK által közvetített mTOR gátlásra egy emlőrák patkánymodelljén is megfigyelték [61], ami arra utal, hogy az éhezés hasonlóan negatív hatással lehet az emlődaganatok DNS-helyreállító képességére, mint a rapamicin. Song és mtsai. inkubált egér fibrosarcoma sejteket 5 mM metforminnal 24 órán keresztül a besugárzás előtt és után [62]. A kezelt sejtek meredekebb túlélési görbét mutatnak, keskenyebb vállukkal, ami a subletalis elváltozások fokozott felhalmozódását jelzi egy adott dózisnál, és arra utal, hogy a DNS javulása károsodott.
Összefoglalva, a CR kimutatták, hogy a normál szövetekben fokozza a különféle DNS-helyreállítási mechanizmusokat, beleértve a HRR-t és az NHEJ-t, amelyek elengedhetetlenek az RT által indukált DSB-javításhoz. Ezzel szemben a rákos sejtek javulóképessége a CR-n keresztül érintetlen maradhat, vagy akár gyengülhet. Úgy tűnik, hogy a normál és a rákos sejtek kemoterápiás gyógyszerekkel szembeni differenciális stressz-rezisztenciáját legalább részben a csökkent glükózszint és a szabad IGF-1 szint közvetíti [47, 50]; ezért feltételezhető, hogy a KD hasonló hatásokat érhet el, bár ezt a későbbi tanulmányokban meg kell vizsgálni.
A tumorsejtek újratelepítése
Összegzésképpen elmondható, hogy a CR és a KD szignifikáns gátló hatást mutatott a tumor növekedésére állatkísérletekben, amelyek a TCP görbe bal oldali eltolódását jósolják (3. ábra). A mechanisztikus felismerések alapján, hogy az IGF-1/inzulin – PI3K – Akt – mTORC1 út és a glikolízis kulcsfontosságú szerepet játszik a tumorsejtek proliferációjában, és kis betegvizsgálatok pozitív bizonyítékaival alátámasztva feltételezzük, hogy a CR és a KD támogató stratégiákként használható megcélzott tumorsejtek újratelepítése az RT alatt.
Újrafelosztás a sejtciklusban
A normál sejtek megszakítják a sejtek tipikus ciklusát az ionizáló sugárzásnak való kitettség után, hogy elegendő időt biztosítsanak a DNS helyreállítására, vagy szélsőséges vagy helyrehozhatatlan károsodás esetén készüljenek fel a sejtek pusztulására vagy öregedésére. A ciklus egyik fázisából a másikba történő átmenetet egy, a ciklinfüggő kináznak (CDK) nevezett kinázcsalád szabályozza, amelynek aktivitását három mechanizmus szabályozza: (1) asszociáció fázisfüggő fehérjékkel, ún. Ciklinekkel; (2) foszforilezés és foszforilezés; (3) gátlás CDK inhibitorokkal, például p21. A sejtek a replikáció és a mitózis során a legérzékenyebbek a DNS károsodására, vagyis a ciklus S és M fázisára. Ezért a mitózist megelőző fázisok különböző molekuláris útvonalakat használnak, amelyeket ellenőrző pontként használnak annak biztosítására, hogy a fázishoz szükséges lépések befejeződjenek, és hogy ne maradjon súlyos DNS-károsodás. A daganatos sejtekben az ellenőrzési pontokat gyakran felülírják a proliferatív szignalizáció onkogén aktiválása PI3K-Akt útján [79, 80] és/vagy a kapuőr gének, például a TP53 funkcióvesztése. Ebből következik, hogy az RT frakciószám növekedésével az ionizáló sugárzás a normál sejtek frakciójának csökkenéséhez vezet az érzékeny S és M fázisokban, míg a tumorsejteket az újraelosztás többnyire nem befolyásolja.
Ezzel szemben a normál sejtekben a CR által kiváltott mitogén ingerek csökkenése és talán kisebb mértékben a KD az újraelosztást nem osztódó állapotba kedvez annak érdekében, hogy megőrizzék és újraeloszlassák a sejtvédő mechanizmusok energiáját [50]. Ez a megállapítás klinikailag kihasználható azáltal, hogy a betegeket minden RT-kezelés és/vagy kemoterápiás ciklus előtt gyorsnak tartják [48, 49]. Safdie és mtsai. számoltak be arról, hogy a kemoterápia előtti és/vagy utáni böjt csökkentette a gyengeség és a fáradtság tüneteit, ugyanakkor csökkentette a gyomor-bélrendszeri mellékhatásokat, összehasonlítva a szokásos étrenddel hat rákos betegnél, akik négy kemoterápiás ciklus mediánján esnek át [48]. A C57BL/6J egerekben a CR FOXO1-függő módon szabályozta a Gadd45a-t és a p21-et [57]. Azonban a hiperaktív PI3K – Akt szignalizáció miatt FOXO inaktivált daganatok képtelenek lennének részesülni a CR által kiváltott sejtciklus-sugárzásból sugárzás alatt, további lehetőséget kínálva a terápiás ablak kibővítésére.
Összefoglalva: a CR megszervezi a normális sejtek újraelosztását a sejtciklusban, potenciálisan megvédve őket a későbbi DNS-károsító sértésektől, például az RT-től. A tumorsejtek helyzete teljesen ellentétesnek tűnik. Úgy tűnik, hogy az éhezés elősegíti a sejtciklus progresszióját, az M fázis felhalmozódását és az energiafelhasználást, ily módon szintetikusan sebezhetővé téve az ilyen sejteket a tápanyag-korlátozás RT-vel vagy kemoterápiával való kombinációja ellen.
Reoxigenálás
Az RT szempontjából nagy kihívást jelent a hipoxiás területek jelenléte a szilárd daganatokban. Az oxigénmolekulák hiánya ezeken a területeken gátolja a H2O2 képződését az OH • -ból, ezáltal csökken a DNS-károsodás gyakorisága és súlyossága. A besugárzás egyetlen része előnyösen megöli a jól oxigénnel kezelt sejteket, de a frakcionált kezelés során részben a tumor zsugorodása következtében a hipoxiás területek újra oxigénellátása következik be. A hipoxia megkönnyíti a DNS helyreállítását, és stabilizálódáshoz vezet a hipoxia-indukálható faktor (HIF) -1 α-alegységének stabilizálásához, amely transzkripciós faktor az mTOR-tól lefelé fekszik, és szabályozza a glikolízist [84]. Az Akt – mTOR útvonal a besugárzás után szabályozza a HIF-1α mRNS transzlációját glükóz- és reoxigenizáció-függő módon [85].
A daganatok rendellenes erek heterogén hálózatával rendelkeznek, amelyet kaotikus anatómiai elrendezés, zsákutcák és fokozott szivárgás jellemez, ami megnöveli az intersticiális folyadéknyomást [86]. Ennek eredményeként krónikus és akut hipoxiában szenvedő területek következnek be, az előbbi akkor fordul elő, ahol az oxigénellátást a proximális erekből történő diffúzió korlátozza, az utóbbi pedig a perfúziót átmenetileg összehúzza. A kóros érrendszert a pro-angiogén jelátvitel feleslege okozza, főként a vaszkuláris endoteliális növekedési faktor 2 (VEGF) következtében. A VEGF a HIF-1α másik célpontja, de transzkripcióját gyulladásos citokinek, növekedési faktorok és nemi hormonok epigenetikus modulációja révén is fokozzák. Ellentétben azzal, amit a VEGF és ezért az új erek képződésének gátlásától elvárhatunk, bizonyítékok gyűltek össze azzal a hipotézissel, hogy az anti-VEGF terápia valóban csökkenti a hipoxiát és megkönnyíti a kemoterápiás gyógyszerek rákos sejtekbe juttatását az érrendszer normalizálásával, ami viszont normalizálja a mikrokörnyezetet [86].
Mivel a VEGF az Akt – mTOR – HIF-1α szignalizáció következtében fel van szabályozva, feltételezhető, hogy bármely stratégia, amely ezt az utat gátolja, csökkenti a VEGF expresszióját és a tumor progresszióját. Mukherjee, Seyfried és munkatársai arról számoltak be, hogy a CR lebontja a VEGF-et és normalizálja a vaszkularizációt számos rágcsáló- és emberi prosztata- és agydaganat tartományában [87–89]. A CT-2A egér asztrocitómában a CR növelte az erek perivaszkuláris sejtbevonatát, ezzel csökkentve a szivárgást, csökkentve az intersticiális folyadéknyomást és jobb gyógyszerellátást a daganatba [89].
A hiperbarikus oxigénterápia (HBOT) egy másik megközelítés a hipoxia leküzdésére. A HBOT elve magában foglalja a hiperbarikus oxigén légzését a besugárzás során a hipoxiás rákos sejtek oxigenizálása és radioszenzitizálása érdekében. Egy nemrégiben végzett Cochrane-értékelés arra a következtetésre jutott, hogy a HBOT RT-vel kombinálva javíthatja a fej-, nyak- és a méhnyakrák helyi kontrollját, de a jelentős káros hatások kárára [90]. Nemrégiben Poff és mtsai. értékelte a HBOT és a KD kombinációját az egér metasztatikus rák egér VM-M3 modelljében, amely szorosan utánozza számos agresszív emberi rákot [91]. Érdekes, hogy az ad libitum etetés ellenére a KD-n lévő egerek testtömegének körülbelül 10% -át vesztették, ami arra utal, hogy önkéntelen alulevés. Míg a KD önmagában az átlagos túlélési időt 57% -kal növelte, a HBOT + KD kombinációja 78% -kal növelte a túlélési időt a szokásos étrendhez képest. Ezen eredmények klinikai gyakorlatba történő átültetése továbbra is nyitott kérdés. Legalábbis feltételezhető, hogy a ketontestek további oxidatív stresszt csillapíthatnak a normál szövetekben [92–94], de nem azokat a rákos sejteket, amelyek képtelenek metabolizálni őket [95–98].
Belső radioszenzitivitás
Úgy tűnik, hogy a Warburg-effektus a radiorezisztens rákos sejtek jellemzője. A tumorok általi FDG-felvétel negatív előrejelzője a helyi kontrollnak [7, 8] és a túlélésnek [9], és arra szolgál, hogy irányítsa a különösen radiorezisztens területek kontúrozását a dózis emeléséhez [10]. Úgy tűnik, hogy a magas glikolitikus sebesség megvédi a rákos sejteket a ROS által kiváltott DNS károsodástól azáltal, hogy nagy mennyiségű redukciós ekvivalenssel látja el a hatóanyagot, mint például a piruvát, a laktát, a glutation és a NAD (P) H, amelyek elszívják a ROS-molekulákat. A laktát mennyiségi meghatározása biolumineszcens képalkotással több mint 1000 egyedi humán HNSCC xenografton, Sattler és munkatársai kimutatták, hogy a tumoron belüli laktátkoncentrációk szignifikánsan fordítottan korreláltak a tumor kontrolljával 6 hetes RT-s kezelést követően [99]. A piruvát esetében azonban nem találtak ilyen összefüggést, ami azzal magyarázható, hogy koncentrációja a daganatokban sokkal alacsonyabb, mint a laktáté.
A rák őssejtjei rendelkeznek a legmagasabb belső radioszenzitivitással, és szerepet játszanak abban, hogy nem sikerül elérni a lokális kontrollt, azonban a metabolikus fenotípusukat jellemző vizsgálatok ritkák. Vlashi és munkatársai nemrégiben készült tanulmánya. azt sugallja, hogy az ilyen sejtek nagy metabolikus rugalmassággal rendelkeznek, és könnyen válthatnak a glikolízis és az oxidatív foszforiláció között, ha ezen utak közül csak az egyiket célozzák meg [100]. Ez azt jelezheti, hogy - legalábbis bizonyos gliomák esetében - a CR vagy a KD önmagában nem elegendő a rákos őssejtek ATP-tartalmának és radiorezisztenciájának csökkentésére.
Klinikai megvalósítás
Az étrendi stratégiák, amelyek a táplálékbevitel csökkentésével járnak a rákkezelés során, reszketést okoznak a kezelőorvosnak, mivel az adatok azt mutatták, hogy a kezelés során történő fogyás gyengébb eredményekhez vezet [101]. Míg a CR okozta jelentős súlyvesztés aggodalomra ad okot, a túlsúlyos betegek zsírvesztése a kezelés alatt és után javuló eredményhez vezethet, mivel az emlődaganatos betegek túlzott zsírszövete segíthet a daganatos sejtek táplálásában [102]. A legfrissebb adatok azonban azt mutatják, hogy a CHO-korlátozott vagy KD nagyobb hatással lehet az RT megnövekedett kudarcarányával járó metabolikus tényezők csillapítására, miközben elkerüli az orvos és a beteg aggodalmát a kalóriák szigorú korlátozása miatt [103].
Az állatokon végzett legtöbb CR-vizsgálatban a kalória 30% -kal vagy ennél nagyobb mértékben csökken, és amint azt korábban említettük, az ilyen korlátozás az egerekben nagyjából összehasonlítható az 1 hetes vízzel történő gyors böjtöléssel embernél [23], mindkét lehetőség nem ésszerű. a rákos beteg számára. Ezt a kérdést minimálisra lehet csökkenteni az RT-kezelések körüli IF-vel, mivel ez kevesebb súlycsökkenést eredményez, ha 2-3 hónapig alkalmazzák [51], hasonlóan az RT-kezelési időkhöz. További releváns kérdések közé tartozik a CR lehetséges toxicitása, mivel a krónikus CR csökkentheti az immunfunkciót [104] és károsíthatja a sebgyógyulást [105], mind a posztoperatív, mind az immunhiányos betegek számára. A KD-ben szenvedő betegeket szintén szorosan ellenőrizni kell annak biztosítása érdekében, hogy elegendő vitamin és tápanyag fogyjon az immunvédelemhez és a megfelelő gyógyuláshoz.
- Emlőrák hormonterápiás emlékmű Sloan Kettering Rákközpont
- Az étrendi sóbevitel és a gyomorrák előfordulásának prospektív vizsgálata meghatározott japánoknál
- Cancer i-100629 001Mi a lényege a Nikolay Sevcsenko terápiájának - recept, ütemezés
- Autológ dendritikus sejtek és aktivált citotoxikus T-sejtek az emlőrák kombinációs terápiájaként
- Akut krónikus veseelégtelenség esetén, akut krónikus vese sérülés esetén - rákterápiás tanácsadó