Alacsony dózisú sugárterhelés 56 MnO2 porral megváltoztatja a herék és a prosztata gén expresszióját
Nariaki Fujimoto
1 Sugárbiológiai és Orvostudományi Kutatóintézet, Hirosima Egyetem, Hirosima 7340037, Japán
Gaukhar Amantajeva
Nailya Chaizhunussova
Dariya Shabdarbayeva
Zhaslan Abishev
Bakhyt Ruslanova
Yersin Zhunussov
Almas Azhimkhanov
3 a Kazah Köztársaság Nemzeti Nukleáris Központja, Kurchatov 071100, Kazahsztán; zk.cnn@vonahmiza
Kasszim Zsumadilov
4 L.N. Gumiljov Eurázsiai Nemzeti Egyetem, Nur-Sultan 010000, Kazahsztán; moc.liamg@kvolidamuhz
Alekszej Petukhov
5 A. Tsyb Orvosi Radiológiai Kutatóközpont - Országos Radiológiai Orvosi Kutatóközpont, Orosz Föderáció Egészségügyi Minisztériuma, 249031 Obninsk, Oroszország; moc.liamg@8656namxela (A.P.); moc.oohay@sfirelav (V.S.)
Valerij Sztyepanenko
5 A. Tsyb Orvosi Radiológiai Kutatóközpont - Országos Radiológiai Orvosi Kutatóközpont, Orosz Föderáció Egészségügyi Minisztériuma, 249031 Obninsk, Oroszország; moc.liamg@8656namxela (A.P.); moc.oohay@sfirelav (V.S.)
Masaharu Hoshi
6 A Béke Központja, Hirosima Egyetem, Hirosima 7300053, Japán; pj.ca.u-amihsorih@ihsohm
Absztrakt
1. Bemutatkozás
A hirosimai és nagaszaki atombombázások kezdeti sugárzásának hatása ellenére aggályok merültek fel a maradék radioaktív por potenciálisan jelentős hatásával az expozícióban részt vevők egészségére. Azok a személyek, akik rövid időre a detonáció után költöztek ezekbe a városokba, csak maradék sugárzásnak voltak kitéve, valószínűleg radioaktív por belélegzésével, és állítólag akut sugárzási szindrómákban szenvedtek [1]. A maradék sugárzás elsődleges forrása 56 Mn volt, egy radioizotóp, amelyet a talajban egy atombomba-robbanás neutronnyalábja termelt [2]. Vizsgáltuk a neutron által aktivált 56 MnO2 por biológiai hatásait Wistar patkányokban, hogy jobban megértsük a maradék sugárzás jelentőségét [3,4,5]. Dózismérési adataink azt mutatják, hogy a belső sugárzásból származó legnagyobb abszorbeált dózisokat a gyomor-bél traktusban, a bőrben és a tüdőben találták, míg a legnagyobb egész test dózisa 100 mGy volt. Érdekes módon ezeknél az alacsony sugárzási dózisoknál az 56 MnO2 belső expozíciója jelentősen megemelte a szérum alanin-aminotranszferáz (ALT) szintjét [3]. A vékonybélben és a tüdőben is megfigyeltek hisztopatológiai változásokat [4].
2. Eredmények
2.1. A belső besugárzás becsült dózisa
Az egyes szervekben az 56 MnO2-től származó belső besugárzás becsült felhalmozódott dózisait korábban leírtuk [3]. A belső besugárzás teljes testdózisa 41 ± 8, 91 ± 3 és 100 ± 10 mGy volt Mn56 × 1, Mn56 × 2 és Mn56 × 3 csoportokban. A magasabb abszorpciós dózisokat a vastagbélben (90 ± 61, 520 ± 110 és 760 ± 170 mGy) és a bőrben (71 ± 23, 110 ± 2,3 és 140 ± 170 mGy) találtuk az Mn56 × 1, Mn56 × 2 és Mn56 × 3 csoportok. A herék és a prosztata számított abszorbeált dózisa kevesebb volt, mint 0,3 mGy (Mn56 × 1 csoport), 0,6 mGy (Mn56 × 2 csoport) és 1,0 mGy (Mn56 × 3 csoport).
2.2. A test és a herék súlya és a szérum tesztoszteron szintje
A testtömeg és a herák relatív súlya az expozíció utáni 3. és 61. napon az 1. táblázatban található. A herék tömegében egyik nap sem volt szignifikáns különbség. A szérum tesztoszteronszint szignifikánsan csökkent az Mn56 × 2 és a Co-60 csoportokban a 61. napon postexpozícióval.
Asztal 1
A test és a herék súlya és a szérum tesztoszteron 56 MnO2, 60 Co γ-sugaraknak és hideg MnO2-nek kitett patkányokban.
| 3. nap | Ellenőrzés | 248 ± 16 | 10,5 ± 1,1 | 1,2 ± 0,30 |
| Hideg Mn | 235 ± 14 | 11,4 ± 0,7 | 0,94 ± 0,13 | |
| Mn56 × 1 | 235 ± 11 | 11,7 ± 0,6 | 0,7 ± 0,24 | |
| Mn56 × 2 | 245 ± 16 | 11,3 ± 0,6 | 0,8 ± 0,17 | |
| Mn56 × 3 | 237 ± 12 | 12,2 ± 0,6 | nem meghatározott | |
| Co-60 | 234 ± 14 | 11,5 ± 0,8 | 1,15 ± 0,33 | |
| 61. nap | Ellenőrzés | 330 ± 17 | 9,3 ± 0,7 | 1,45 ± 0,35 |
| Hideg Mn | 337 ± 19 | 9,8 ± 0,4 | 1,3 ± 0,14 | |
| Mn56 × 1 | 371 ± 21 | 9,2 ± 0,6 | 1,42 ± 0,14 | |
| Mn56 × 2 | 337 ± 17 | 9,1 ± 0,5 | 0,68 ± 0,26 * | |
| Mn56 × 3 | 353 ± 17 | 9,1 ± 0,5 | 0,75 ± 0,23 | |
| Co-60 | 328 ± 23 | 9,4 ± 0,5 | 0,59 ± 0,11 * |
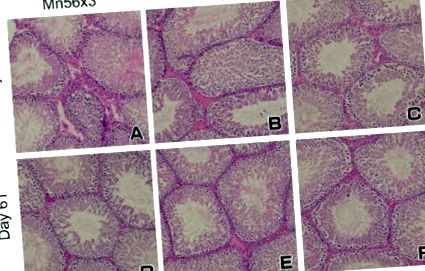
Patkányok heréi a 3. napon (A-C) és a 61. nap (D-F) 56 MnO2 por vagy 60 Co-γ expozíció után. A herékben nem volt szignifikáns szövettani váltás a csoportok között: Mn56 × 3 (A,D); Co-60 (B,E); és a vezérlés (C,F). HE festés, eredeti nagyítás 20 ×.
2.4. Hatások a Leydig sejt-specifikus szteroidogenezissel kapcsolatos gének mRNS expressziós szintjeire
A szteroidogenezissel kapcsolatos gének, a Cyp11a1, Cyp17a, Hsd3b1 és StAR relatív mRNS-expresszióját az egyes csoportokban a 2. ábra mutatja be. A posztexpozíció 3. napján a Cyp17a és Hsd3b1 mRNS expressziója szignifikánsan csökkent az Mn56 csoportokban. A 61. napon a postexpozíció során a Cyp11a1 mRNS szintje szignifikánsan alacsony lett az Mn56 × 3 csoportban, míg a StAR mRNS szint csökkent a Co-60 csoportban. Ezen mRNS-szintek egyike sem módosult szignifikánsan a hideg Mn-csoportban.
A Cld11, Clu, Spag4 és Zpbp gének relatív mRNS expressziós szintje a patkányok heréiben a 3. napon (tetejére) és a 61. nap (alsó) 56 MnO2 pornak (Mn56 × 1, Mn56 × 2 és Mn56 × 3), hideg MnO2 pornak (Cold Mn) vagy 60 Co-γ expozíciónak (Co-60) való expozíciót követően. * p 2. táblázat). Meghatároztuk a dorsolaterális prosztata szekréciós fehérjét, a PSP94-et kódoló gén expresszióját is. A KS3 mRNS szintje csökkent a Co-60, Mn56 × 2 és Mn56 × 3, míg a CPR1 mRNS szintje csökkent a Co-60 és az Mn56 × 2 esetében. Csak a Mn56 × 3 csoportban a PSP94 génexpresszió szignifikánsan a felére esett vissza a kontroll értékéből.
2. táblázat
A szekréciós fehérje gének mRNS szintje a prosztatában.
| Ellenőrzés | 651 ± 45 | 158 ± 22 | 20 ± 2,6 | 103 ± 7,3 |
| Hideg Mn | 566 ± 38 | 168 ± 26 | 13,5 ± 2,2 | 83 ± 11,2 |
| Mn56 × 1 | 716 ± 82 | 206 ± 34 | 18,3 ± 2,9 | 86 ± 33,8 |
| Mn56 × 2 | 611 ± 103 | 77 ± 14 * | 8,3 ± 1,6 ** | 75 ± 9,0 |
| Mn56 × 3 | 453 ± 24 | 91 ± 10 | 9,8 ± 2,8 * | 49 ± 10,7 * |
| Co-60 | 557 ± 79 | 79 ± 19 * | 11,8 ± 2,6 * | 71 ± 9,4 |
A prosztata szövetmintákat összegyűjtöttük és csak a 61. napon utóhatásnak vetettük alá. Minden érték az átlag ± SEM értéket mutatja (n = 6 vagy 7, mindegyik csoport). * p 56 MnO2 por, és megállapította, hogy ennek a radioaktív pornak a belső expozíciója nagyobb biológiai hatással bír, mint a külső besugárzás [3,4]. Jelen tanulmányban az 56 MnO2 pornak a férfi reproduktív funkciójára gyakorolt belső expozíciójának hatásait vizsgáltuk a herék, valamint a prosztata génexpressziós változásainak meghatározásával. Noha a here sugárzási dózisa kevesebb volt, mint 110 mGy, számos szteroidogenezissel kapcsolatos gén mRNS szintjét befolyásolta a 3. és a 61. nap postexpozíciója, mivel a prosztata fehérje gén expresszióját a 61. napon a postexpozíció is csökkentette. Eredményeink azt sugallják, hogy az 56 MnO2 pornak való kitettség az alacsony sugárzási dózis ellenére jelentősen befolyásolta a hím reproduktív funkcióját, amely a herék és a prosztata csökkent gén expressziójával jár.
Az 56 MnO2 férfi reproduktív funkcióra gyakorolt hatásának további értékeléséhez a prosztata aktivitásait vizsgáltuk. A rágcsáló prosztata morfológiailag elválasztott ventrális, dorsolaterális és elülső (koaguláló mirigy) részekből áll, amelyek mindegyike különféle fehérjéket választ ki, amelyek a prosztata fejlődését és aktivitását jelentik [20]. Meghatároztuk a ventrális prosztata szekretált fehérjék, az prstC3, a CRP1 és a KS3, valamint a dorsolaterális prosztata fehérje, a PSP94 mRNS szintjét. Ezek az mRNS expressziók szignifikánsan csökkentek az Mn56 × 3 csoportban a 61. nap postexpozíciójában, ami arra utal, hogy az 56 MnO2 expozíció a prosztata funkcióját okozta, valószínűleg a szérum tesztoszteron szintjének csökkenése révén.
Az alacsony belső sugárzási dózis (kevesebb, mint 1 mGy) ellenére a Mn56 csoportokban a herékben és a prosztatában a génexpresszió jelentősen megváltozott. E tekintetben meg kell jegyezni, hogy az egyes szervek belső besugárzásának becslése a szervek mért radioaktivitásán alapult. Azonban azoknál a heréknél, amelyek anatómiailag a testen kívül helyezkedtek el, és amelyek nem voltak visszahúzódva, mivel az állatok az expozíciós időszak alatt aludtak, ezen felül a 56 MnO2 porral közvetlenül érintkező, szomszédos bőrből származó besugárzásnak vetették alá őket. Figyelembe véve az 56 Mn-ből származó, körülbelül 4 mm-es tartományban lévő β-sugarak maximális 2,85 MeV energiáját a szövetben, a további heredózisnak az Mn56 × 3 csoportban 110 mGy-nak kellett volna lennie a korábban számolt módszer szerint [21] . Ez azonban nem volt így a prosztatában, egy belső szervben. A prosztata fehérjék mRNS-szintjének csökkenése valószínűleg a szérum tesztoszteron szintjének csökkenése volt.
Bizonyos radionuklidok eloszlása a belső expozíciót követően azok specifikus kémiai természetétől függ [22, 23]. Ha a patkányokat stabil és oldhatatlan molekuláknak, például MnO2-nak teszik ki, ezek a molekulák a gyomor-bél traktusba, a bőrbe és a tüdőbe kerülnek. Úgy gondolják, hogy a radioaktív részecskékből történő besugárzás kevésbé veszélyes lehet a karcinogenezis szempontjából, mint ugyanaz az aktivitás egyenletesen elosztva [24]. A radioaktív részecskék azonban erősebb biológiai hatásokat indukálhatnak a „célszervekben”, mivel korábban 56 MnO2 pornak kitett patkányokban találtunk hisztológiai változásokat a tüdőben és a vékonybélben [24]. Jelen tanulmány ismét jelezte, hogy a radioaktív részecskék magas biológiai hatást gyakorolnak bizonyos célszervekre. A herék gén expressziójára gyakorolt 56 MnO2 hatás nyilvánvalóan magasabb volt, mint a 2 Gy külső γ besugárzás által okozott hatások.
4. Anyagok és módszerek
4.1. Állatok
4.2. Besugárzás és dozimetria
4.3. Az mRNS-szintek mérése kvantitatív RT-PCR-rel
A teljes RNS-t az Isogen II (Nippon Gene Co., Tokió, Japán) alkalmazásával állítottuk elő a herék és az RNS Save oldatban tárolt prosztata szövet metszeteiből. Az első szálú cDNS-t úgy szintetizáltuk, hogy 3 µg teljes RNS-t inkubáltunk 100 E ReverTra Ace reverz transzkriptázzal (Toyobo Co., Osaka, Japán) 20 pmol pdN6 random hexamerek és 5 pmol oligo-dT (15) primerek (Takara) keverékével. Bio Inc., Kusatsu, Japán). Kvantitatív PCR-eszközt, a StepOnePlus-t (Applied Biosystems/Life Technologies Co., Carlsbad, Kalifornia, USA) alkalmaztunk a cDNS mérésére KAPA SYBR Fast qPCR Kit segítségével (Kapa Biosystems, Inc., Woburn, MA, USA). A kvantitatív elemzés előtt a PCR termékeket külön-külön előállítottuk és gélelektroforézissel tisztítottuk. A DNS-szekvenciákat a Fasmac Co., Ltd. (Atsugi, Japán) igazolta. A kivont fragmenseket használtuk standardként a mennyiségi meghatározáshoz. A PCR-körülmények 30 másodperces kezdeti denaturációt követnek, amelyet 40 ciklus követ, 5 másodpercig 95 ° C-on és 35 másodpercig 60 ° C-on. A mért mRNS szinteket a β-aktin mRNS szintjéhez viszonyítva normalizáltuk. A here gének specifikus primerkészleteit a 3. táblázat tartalmazza. A prosztata szekréciós fehérjék Q-PCR primereit korábban leírták [30].
- Hogyan lehet fogyni 10 fontot - 11 apró változás nagy fogyáshoz
- Hogyan lehet lefogyni 15 fontból - apró változások a fogyásban
- Hogyan lehet lefogyni 5 kg-ból 4 változtatás, amelyet el kell végeznie a fogyókúrás férfiak számára; s Health Magazine Australia
- Hogyan tud egy szoptató anya fogyni biztonságosan Tejpor szoptató fehérje por
- A megnövekedett keringő kolin, L-karnitin és TMAO szint összefügg az adipozitás változásával