Kukoricaszárított desztilláló szemek oldható anyagokkal (cDDGS) a sertések étrendjében megváltoztatják a metabolikus és szív- és érrendszeri betegségek potenciális terápiás célpontjának számító zsírgének expresszióját
Absztrakt
Háttér
A kukoricában szárított desztilláló oldható szemek (cDDGS) a bioüzemanyagok és az alkoholtermelés melléktermékei. A cDDGS-t sok éve használják a sertéstakarmányban, mert könnyen hozzáférhetők, fehérjében, rostban, telítetlen zsírsavakban és fitoszterolokban gazdagok. A túl magas cDDGS-tartalmú takarmánykeverékek azonban a háttérzsír minőségének romlását eredményezik. Különböző táplálékkal etetett keresztezett sertések hátsó zsírának RNS-szekvenálási elemzését végeztük. A diéták izoenergetikusak voltak, de különböző mennyiségű cDDGS-t és különböző zsírforrásokat tartalmaztak. Az állatokat a két hónapos kísérlet során négy táplálkozási csoportra osztottuk: I. csoport (kontroll (-cDDGS + repceolaj)), II. Csoport (+ cDDGS + repceolaj), III. Csoport (+ cDDGS + marhafaggyú) és csoport IV (+ cDDGS + kókuszolaj). A jelen kísérlet célja az volt, hogy értékelje az izoenergetikus étrendet fogyasztó sertések hátulzsír-transzkriptómjában bekövetkezett változásokat, amelyek különböznek a cDDGS jelenlétében.
Eredmények
A DESeq2 szoftver segítségével 93 differenciálisan expresszált gént (DEG) azonosítottunk az I. és II. Csoport között, 13-at az I. és a III., Valamint 125-et az I és a IV. Csoport között. Az I. csoport (-cDDGS + repceolaj) és a II. Csoport (+ cDDGS + repceolaj) között azonosított DEG-k több KEGG-útvonalon túlreprezentáltak voltak: metabolikus utak (FDR
Háttér
A haszonállatok optimális takarmányozási stratégiája a hústermelés jövedelmezőségének egyik alapvető tényezője. A cDDGS-t (kukoricában szárított desztilláló szemek oldhatók) általában a szójabab lisztjének pótlására használják az állati takarmányban, magas fehérje- és rosttartalma, elfogadható ára és elérhetősége miatt. A cDDGS-t tartalmazó étrenddel etetett állatok hátulja azonban puha és hajlamos az oxidációra [1]. Nagy mennyiségű telített zsírsavat tartalmazó zsírokat, például marhafaggyút vagy kókuszdióolajat adnak a takarmányhoz, hogy ellensúlyozzák a hátsó zsír minőségének romlását. Ilyen cDDGS-t javasoltak emberi étrendben történő alkalmazásra is, különösen diabéteszes és cöliákiás betegek étrendjében [1]. Érdekes módon egy évtizeddel ezelőtt a DDGS iszkémiás szívbetegségekre gyakorolt jótékony hatását feltételezte és szabadalmaztatta az Egyesült Államok Szabadalmi és Védjegyügyi Hivatala (2004/0234630 számú amerikai egyesült államokbeli szabadalom) [2]. Jelenleg a növekvő bioüzemanyagok előállításával a cDDGS elérhetősége magas; azonban az emberi étrendben továbbra is elhanyagolható. A cDDGS és a különböző zsírok elfogyasztása után az állati szövetekben előforduló molekuláris folyamatok megértése feloldhatja a kétségeket e vegyületek takarmányként, valamint a kísérő állati és emberi táplálkozás részeként történő felhasználásával kapcsolatban.
A mai napig számos kísérlet feltárta, hogy a táplálkozás változásokat indukálhat a transzkriptómban és a specifikus anyagcsere útvonalakban [3]. Peñagaricano és mtsai. (2014) észrevehető gén expressziós különbségeket figyelt meg a zsírszövetben azok között a juhmagzatok között, akiknek az édesanyja étrendet táplált cDDGS-sel, és azok között, akiknek az anyáit terhesség alatt más izoenergetikus diétákkal táplálták [4]. Ezen gének közül sok részt vett az adipogenezisben, a lipogenezisben és a zsírszövet fejlődésében. Feltételezzük, hogy ezek a megfigyelések relevánsak lehetnek más emlősfajok esetében is. Ezért azt kívántuk megvizsgálni, hogy a cDDGS hozzáadása a sertések étrendjéhez megváltoztatja-e a backfat transzkriptómot. A közelmúltban a sertések ígéretes alternatívává váltak a rágcsálók állatmodelljeivel, a szervek méretét és fiziológiáját illetően az emberekkel való hasonlóság miatt [5]; ezért tanulmányunk eredményei információkat nyújthatnak a cDDGS egészséget elősegítő adalékanyagként történő felhasználásának lehetőségéről az emberi étrendben.
Jelen tanulmány célja az volt, hogy értékelje az izoenergetikus étrendet fogyasztó sertések hátulján lévő transzkriptumának azon változásait, amelyek különböznek a cDDGS-tartalomtól és a zsírforrásoktól. Ezen túlmenően a cDDGS és a zsírsav-összetételek közötti lehetséges kölcsönhatásokat is fel akartuk mérni az étrendben.
Eredmények
Az állatok teljesítménye és szubkután hátsó zsírminősége különböző diétás kezelések után
Az állatok teljesítményét és a zsírtartalom minőségét másutt részletesen leírják a következő étrendi kezelések esetében: kontroll - I. csoport (-cDDGS + repceolaj), II. Csoport (+ cDDGS + repceolaj), III. Csoport (+ cDDGS + marhahús faggyú) és csoport IV (+ cDDGS + kókuszolaj) [6, 7]. Röviden, a különféle étrendi kezelések nem befolyásolták a súlygyarapodást, a takarmány felhasználását, a hátsó zsírvastagságot vagy a hasított húsosságot. Azonban a takarmánykeverékükben (II. Csoport) cDDGS-t és repceolajat kapó állatok hátsó zsírja a telített zsírsavak és a telítetlen zsírsavak összegének (SFA: UFA) és a legmagasabb C18: 2 linolsav arányának legkisebb arányát mutatta. tartalom és jódérték (o Az 1 mintától függően 13 148–14 391 között volt.
RNS-seq analízissel azonosított, differenciálisan expresszált gének (DEG)
Jelen tanulmányban a géneket differenciálisan expresszáltuk, amikor a hajtásváltozás> ± 1,3 volt, és a kiigazított értéket o-értéke az 1. táblázat volt. A választott teljesítmény és a zsírtartalom minőségi paraméterei
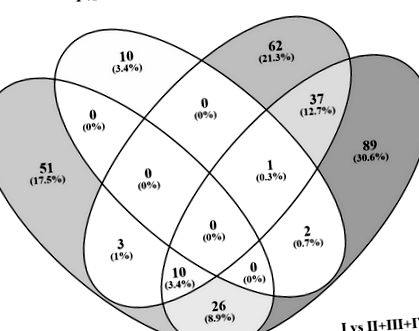
A DEG listák összehasonlítása a Venny integratív eszközzel (http://bioinfogp.cnb.csic.es/tools/venny/index.html) 39 (13,3%) közös gént tárt fel (I. csoport vs. II. Csoport) és (I. csoport vs II + III + IV), 48 (16,4%) közös gén (I csoport vs IV csoport) és (I csoport vs II + III + IV csoport) és csak 3 (1%) közös gén között (I. csoport vs III. csoport) és (I. csoport vs II + III + IV. csoport) (1. ábra).
A Venn-diagram négy összehasonlítás között mutatja a közös DEG-eket: (I. csoport vs II. Csoport), (I. csoport vs III. Csoport), (I. csoport vs IV. Csoport) és (I. csoport vs II + III + IV)
Az azonosított DEG-ek funkcionális elemzése
Megfelelő következtetések levonása céljából az egyes táplálkozási tényezők biológiai folyamatokra, molekuláris funkciókra és útvonalakra gyakorolt hatásáról elemeztük a DEG-ek minden egyes adatsorát külön-külön, és nem elemeztük a DEG-eket (I. csoport vs II + III + IV + csoport) összehasonlításból. Számos elemzést végeztünk a túlreprezentált DEG azonosítására a PANTHER osztályozási rendszer segítségével. A legérdekesebb eredményeket akkor kaptuk, amikor az I. csoportban túlzottan expresszált DEG-eket (-cDDGS + repceolaj) összehasonlítottuk a II. Csoportéval (+ cDDGS + repceolaj) (a 49 DEG 47 feltérképezett génje). A DEG-k főként a következő utakban vettek részt: metabolikus folyamatok, zsírsav-bioszintetikus folyamat, lipid-metabolikus folyamat és koenzim anyagcsere-folyamat (3. táblázat). Ezen gének közül sok enzimet kódolt, amelyek katalizálják az anyagcsere folyamatokat; ezért a katalitikus aktivitás és a ligáz aktivitás felülreprezentáltak a molekuláris funkciók között. A túlexpresszált gének többféle reaktómavezetésben is felülreprezentáltak, amelyek közül a legjelentősebb a metabolikus génexpressziót aktiváló ChREBP volt (FDR 2. ábra
DEG-ek String 10.0 bioinformatikai szoftverelemzése (http://string-db.org) után kapott interakciós fehérjék hálózata (–cDDGS + repceolaj) összehasonlításban (+ cDDGS + repceolaj). a Lassan szabályozott DEG-ek (+ cDDGS + repceolaj), b DEG-ek szabályozva (+ cDDGS + repceolaj gének)
A cDDGS által szabályozott gének működésének további elemzéséhez egy nagy megbízhatóságú génkészletet javasoltunk, amelyeket mindkét DESeq2 elemzésben (I. csoport vs II. Csoport és I. csoport vs II + III + IV. Csoport) differenciálisan expresszáltak (4. táblázat), és észrevette, hogy az irodalom szerint sok potenciális terápiás célpont az elhízás, a cukorbetegség, valamint a szív- és érrendszeri és neurodegeneratív betegségek esetén.
Az RNS-seq elemzés validálása qPCR segítségével
Nyolc gén qPCR-elemzését hajtottuk végre, amelyek közül ötöt szabályoztunk (ACACA, ACLY, FASN, FITM2, és JAJ) és amelyek közül hármat felülszabályoztak (VSIG4, C5AR1, és MS4A2) a II. csoportban (+ cDDGS + repceolaj) (1. kiegészítő fájl: S1. táblázat). A qPCR elemzés eredményeit az egyes táplálkozási csoportokról a 3. ábra mutatja be. A GLM eljárással végzett statisztikai elemzés feltárta az étrend jelentőségét a ACACA, FITM2, ALAS1, MS4A2 és VSIG4 kifejezés, míg a ACLY, FASN és C5AR1 tendenciákat figyeltek meg (o 2 = 0,99) a qPCR és az RNS-seq eredmények között nagyon szignifikáns volt, a o 3. ábra
A kiválasztott gének qPCR-analízisének eredményei az egyes étrendi csoportokban: I. csoport (-cDDGS + repceolaj), II. Csoport (+ cDDGS + repceolaj), III. Csoport (+ cDDGS + marhafaggyú), IV. Csoport (+ cDDGS + kókuszolaj) ) GLM-eljárás után, diétával és nemmel, mint fix tényezőkkel. *o-érték 0,1
Vita
A zsírsav-bioszintézist a cDDGS szabályozza
Az oxidatív foszforilezést a cDDGS szabályozza
Számos szabályozatlan gén volt (ALAS1, CYB5B, PDHX, és CSAK) (3b. Ábra), amelyek mindkét korábban említett folyamathoz kapcsolódtak: a zsírsav anyagcseréhez és a sejtlégzéshez. CSAK katalizálja az acetil-koenzim A szintézisét, amely a zsírsav-bioszintézis és a TCA-ciklus fő szubsztrátja, miközben ALAS 1 katalizálja a hem bioszintézist a citokróm P450-hez, az elektrontranszferlánc terminális oxidáz enziméhez. Nemrégiben azt javasolták, hogy a hem bioszintézise az adipogenezishez kapcsolódik mitokondriális légzési aktivitás révén [34]. A kutatók feltételezték, hogy a hem bioszintézisre van szükség az optimális adipocita differenciálódás eléréséhez a mitokondriális funkció fenntartásával.
A komplement és koagulációs kaszkádot a cDDGS szabályozza
A cDDGS esetében a komplementrendszert aktiváló tényező lehet a béta-glükán, amely a gabona eredetű étkezési rost eleme, amely jelen lehet az élesztő sejtfalaiban is. A magas zsírtartalmú étrenddel etetett sertéseknél gyulladás és immunitás gének szabályozását figyelték meg [15]. A kutatók arra a következtetésre jutottak, hogy az étkezési zsír és rost antagonista hatást gyakorolhat a gyulladáscsökkentő és gyulladáscsökkentő jelátviteli utakra. Eredményeinkkel ellentétben ezek a kutatók azonban csak a perirenalis zsírban, de a szubkután zsírban nem figyeltek meg immungén modulációt. Lehetséges, hogy a cDDGS sokkal erősebb hatásokkal bírhat, mint a szalmából származó rost, ami a szubkután zsírban is gén expresszió modulációhoz vezet. Másrészt egy ilyen reakció a mikotoxinok cDDGS-ben való jelenlétének eredménye lehet. A biokémiai elemzés nem mutatott ki ilyen szennyeződést takarmányunkban; a takarmányszennyező anyagok széles választéka miatt azonban nem zárható ki teljesen.
Vizsgálatunk korlátja, hogy megfigyelésünket nem bizonyították in vitro tenyésztett sertés adipociták alkalmazásával; ez a genomra kiterjedő kísérlet azonban számos korábbi jelentést megerősített a zsírsav-bioszintézis szabályozó génjei és az ebben a folyamatban részt vevő enzimeket kódoló gének in vitro és in silico kölcsönhatásairól emberi és egér sejtekben [16, 17]. Mindkét nem bevonása a kísérletbe szintén korlátozásnak tekinthető; az esetleges torzítás felmérése érdekében azonban elvégeztük az I. csoportból származó 6 minta és a II. csoportból származó, kiegyensúlyozott neműek 6 mintájának DESeq2 elemzését, és megállapítottuk, hogy a különbségek elhanyagolhatóak. A legfontosabb azonosított gének mindkét elemzés során statisztikailag szignifikáns gének közé tartoznak (4. kiegészítő fájl: S4. Táblázat). Ezenkívül a String szoftverrel végzett funkcionális elemzés azt mutatta, hogy a tárgyalt útvonalakban részt vevő gének (zsírsav bioszintézis, oxidatív foszforiláció, komplement és koagulációs kaszkád) útvonalak túlreprezentáltak ebben az adatkészletben (4. kiegészítő fájl: S4. Táblázat). Bizonyos kétségek adódhatnak abból a tényből, hogy a cDDGS-t tartalmazó étrendek zsírtartalma valamivel magasabb volt, mint a többi étrendben, de a különbség csak
4%, ami nem elegendő ahhoz, hogy egyénileg ilyen változásokat idézzen elő a transzkriptómban.
Következtetések
Jelenleg az elhízás, a szív- és érrendszeri és a neurodegeneratív betegségek jelentik a legfőbb halálokokat a fejlett országokban. Ez a probléma kezdte magában foglalni a háziállatokat is, például kutyákat vagy macskákat, és a cDDGS olyan terméknek tűnik, amely ellensúlyozhatja ezeket a rendellenességeket. Kutatásunk eredményei azt mutatják, hogy a cDDGS étrendhez való hozzáadása a lipogenezisben és a sejtes légzési folyamatokban részt vevő gének expressziójának csökkenését okozza, miközben stimulálja az immunrendszer génjeit. Ennek a terméknek az állati étrendben való használata sok éven át mutatja a cDDGS relatív biztonságát; további vizsgálatokra van szükség laboratóriumi állatokon és in vitro tenyészetekben, hogy teljes mértékben megértsük azokat a molekuláris mechanizmusokat, amelyek a cDDGS hozzáadása után aktiválódnak. Ezenkívül a cDDGS biológiailag aktív komponenseinek elkülönítése és aktivitásuk feltárása hasznos lehet a cDDGS mint az étrend egészségét elősegítő összetevő potenciáljának felmérésében.
Anyagok és metódusok
Állatok és diéták
Az ebben a vizsgálatban szereplő, az élő állatok felhasználásával kapcsolatos összes eljárás összhangban volt a krakkói állatok kísérletével foglalkozó helyi etikai bizottsággal (912. sz. Határozat, 2012. április 26.).
RNS izolálás, RNS-seq és qPCR eljárások
Az RNS-seq eredmények validálását 8 gén esetében végeztük (ACACA, ACLY, FASN, ALAS1, FITM2, C5AR1, VSIG4, MS4A2) kvantitatív valós idejű PCR-rel (qPCR). A cDNS-t a cDNS Archive Kit-el (Thermo Fisher Scientific, Waltham, MA) szintetizáltuk. A qPCR-t két példányban, QuantStudio 7 Flex eszközön (Thermo Fisher Scientific, Waltham, MA) hajtottuk végre, gyors hőprofil alatt. A reakcióelegy 1 μl cDNS-t, 5 μl GoTaq® qPCR Master Mix-et (Promega Corporation, Madison, WI), 0,1 μl CXR festéket, 3,23 μl vizet, 0,17 μl 60 × TaqMan vizsgálatot tartalmazott. OAZ1 (endogén kontroll) amplifikáció (Vizsgálati azonosító: Ss03397505_u1) és 0,5 μl 20 × TaqMan génexpressziós vizsgálatot a célgén amplifikálására (ACACA assay ID: Ss03389963_m1, ACLY assay ID: Ss03389566_m1, FASN assay ID: Ss03386194_u1, ALAS1 assay ID: Ss04652684_m1, FITM2 assay ID: Ss03267236_m1, MS4A2ay4 ID: S40104 ID, és C5AR1 assay ID: Ss03375530_u1). Az egyes minták relatív mennyiségi meghatározását (RQ) a ΔΔCt módszer alapján számítottuk ki, QuantStudio Real-Time PCR szoftverrel.
- Változtassa meg az életét 60 perc alatt; Egészségügyi, életmód- és étrendjavító műhelymunkák a munkavállalók számára
- Változtassa meg az étrendet, először adjon hozzá lencsét; EGY egyedüli természetes energia
- Fagyott; Fagyasztva szárított nyers táplálék étrend macskáknak Északnyugati Naturals
- 5. fejezet A tökéletes paleofantasy diéta, hús, szemek és főzés; Paleofantasy
- Magas koncentrátumú kukoricaszalma-diéta indukálta epigenetikus változások az emlőszövetben