Májimmunológia és gyógynövényes kezelés
Levelezés: Dr. Yasemin H Balaban, professzor, Gasztroenterológiai Egység, Magán Etimed Kórház, Elvan Mah, 1934 Sok, No. 4, 06790 Ankara, Törökország. rt.ude.epettecah@nabalaby
Telefon: + 90-533-2344232 Fax: + 90-312-2930605
Absztrakt
Az anyagcsere-funkciókon túl a májat nemrégiben az immunrendszer (IS) szerveként határozták meg, amelyek központi szabályozó szerepet játszanak a veleszületett és az adaptív immunitás szempontjából. A máj kényes egyensúlyt tart a kórokozó antigének májszűrése és az önantigének elleni immun tolerancia között. Az immunológiai hatású gyógynövényes kezelések képesek megváltoztatni ezt a májimmun egyensúlyt akár a terápiás, akár a betegségek oldala felé azáltal, hogy májkárosodást okoznak hepatotoxicitás vagy autoimmun betegségek megindítása révén. A leggyakrabban ismert gyógynövényes kezeléseket, amelyek terápiás hatással vannak a májra és az IS-re, in vitro, in vivo és/vagy klinikai vizsgálatokkal igazolták ebben a felülvizsgálatban.
Alap tipp: A gyógynövényes kezelés a modern orvoslás anyja. A betegségek növényekkel történő kezelésének ősi szokása továbbra is elsődleges vagy kiegészíti a hagyományos orvosi kezelést. A medál másik oldala az a tény, hogy a máj a növényi toxicitás első számú célszerve. Ezenkívül a májat nemrégiben az immunrendszer aktív szerveként határozták meg, amelynek központi szabályozó szerepe van a veleszületett és adaptív immunválasz szempontjából. A fenyegetésekkel szembeni azonnali és hatékony védekezés (az antigének immunfigyelő képessége) közötti kényes homeosztázist anélkül, hogy az immunstruktúrákkal szemben káros immunválaszt váltana ki (az antigének periferális immun toleranciája), a máj szabályozza. A gyógynövénykészítmények nem egyetlen növényi kivonat, hanem az összetevők egymással kölcsönhatásban álló keveréke, amely meghatározza a végső klinikai eredményt terápiás és hepatotoxikus hatásként. Ennek a felülvizsgálatnak az volt a célja, hogy immunológia szempontjából felhívja a figyelmet a gyógynövények mindkét potenciáljára, annak érdekében, hogy motivációt indítson a gyógynövények és a máj közötti immunológiai kölcsönhatás mechanizmusait meghatározó jellemző tanulmányokhoz.
BEVEZETÉS
A gyógynövényes kezelés a modern orvoslás anyja. Kulturális, gazdasági és gyakorlati okok miatt a betegségek növényekkel történő kezelésének ősi szokása továbbra is elsődleges vagy kiegészíti a hagyományos orvosi kezelést. A medál másik oldala az a tény, hogy a máj a növényi és étrend-kiegészítők (HDS) által kiváltott toxicitás első számú célszerve. Az Élelmiszer- és Gyógyszerügyi Hatóság (FDA) az étrend-kiegészítő egészségügyi és oktatási törvény (DSHEA) alapján 1994 óta szabályozza a gyógynövényes kezeléseket [1]. Az új növényi termékek FDA-nak történő benyújtása megköveteli az adag és az összetevők felsorolását a palackjára, azonban a biztonságosság és a hatékonyság dokumentációját nem kell jelenteni. Továbbá, HDS kapható recept nélkül, orvosi tanácsadás vagy ellenőrzés nélkül. Bár a probléma tényleges nagysága nincs pontosan meghatározva, a HDS által kiváltott hepatotoxicitás az Egyesült Államokban a hepatotoxicitás eseteinek 20% -át teszi ki, és az arány az indiai 2,5% -tól Szingapúrban 70% -ig terjed [2].
A máj hajlamos a gyógyszer okozta májkárosodásra (DILI), mivel a vegyi anyagokat metabolizálja és szabályozza az immunválaszt. A DILI dózisfüggő közvetlen gyógyszer-toxicitással, vagy - sokkal gyakrabban - idioszinkratikus reakciókként alakulhat ki az összetevőkre való egyéni hajlam miatt. A HDS komplex összetétele megkönnyíti mind a közvetlen toxicitást, mind az idioszinkratikus reakciókat májban történő metabolizmusuk során. Az idioszinkratikus DILI-t (IDILI) a legtöbb esetben enyhe sérülés jellemzi (ALT 1. táblázat. 1. A Treg sejtek expresszálják a CD4 + CD25 + -ot, és elengedhetetlenek az immun homeosztázis és az ön tolerancia fenntartásához. A Treg sejtek vagy természetes úton termelődnek CD4 + timocitákból a thymusban. vagy az iTreg sejteket periférián indukálják a naiv CD4 + T sejtekből, válaszul a TCR, TGF-béta és IL-2 alacsony dózisú stimulációjára. Mindezen effektor T sejtek mellett vannak memória T sejtek is. Az Id3 a legfontosabb transzkripció szabályozó a T-sejtek differenciálódásának szabályozására akár effektor T-sejtekké, akár memória T-sejtekké mTORC jelzéssel [7,9,12].
Asztal 1
A CD4 + cellás részhalmazok jellemzői
| Th1 | Th2 | T17 | Treg | Tfh | |
| Előállított citokinek | IFN-gama, TNF-alfa, IL-2 | IL-4, IL-5, IL-9, IL-10, IL-13 | IL-17A, IL-17F, IL-21, IL-22, IL-26 | TGF-béta, IL-10 | CXCR5, IL-21 |
| Az immunválasz közvetített | Intracelluláris kórokozók | Extracelluláris paraziták, allergia, humorális válasz | Extracelluláris baktériumok és gombák, autoimmunitás | IgA szekréció, ön tolerancia | A B-sejtek differenciálása |
| Mester transzkripciós tényezők a differenciáláshoz | T-tét | GATA-3 | RORct | Foxp3 | Bcl6 |
| Hatásos sejtek | Makrofágok, citotoxikus sejtek aktiválódtak | Eozinofilek, aktivált hízósejtek | A neutrofilek aktiválódtak | A B-sejtek aktiválták a Th1, Th2, Th17 szuppressziót | B sejtek aktiválva |
IFN: Interferonok; IL: Interleukin; TGF: transzformáló növekedési faktor; TNF: Tumor nekrózis faktor.
Az NK expresszálja az CD56-ot CD3 hiányában, de az NKT mindkettőt expresszálja. Az NKT a CD8 + T sejtek citotoxicitásának aktiválásával vagy a tolerogén mechanizmusok felülbírálásával közvetíti a tumorellenes hatást a Treg sejtek ellenszabályozásával. Az NKT képes azonosítani a glikolipid antigéneket, és a TCR expressziós profil szerint ketté osztható. Az 1-es típusú vagy invariáns NKT (iNKT) invariáns TCR alfa-lánc párosítást tartalmaz korlátozott számú béta-lánccal, míg a 2-es típusú NKT sejtek sokféle TCR-t expresszálnak, amelyek felismerik a CD1d-t, amely az MHC I. osztályú molekula. A veleszületett T limfociták (ITL) iNKT sejtekből és gamma-delta T sejtekből állnak. Az ITL-ek az APC-k és más IS-sejtek iniciálásában és polarációjában betöltött kulcsszerepein keresztül szabályozzák az adaptív immunválaszt. Az ITL ezen jellemzője immunmodulációként célozta meg őket autoimmun betegségek kezelésében [1,9].
A MÁJ, MINT A SZERVE
Annak érdekében, hogy a túlélés érdekében a homeosztázis megmaradjon, az immunválasznak folyamatosan alkalmazkodnia kellett az életkor, a nem, az étrendi antigének, a hormonok (azaz a terhesség és a szoptatás), valamint a külső stressztényezők, például a mikrobiota, a környezeti flóra vagy a kitett vegyi anyagok függvényében [13]. Ezért az IS dinamikus természetű és széles „normál tartományú”. A májban a bélhez kötődő metabolikus szerven túlmenően a közelmúltban meghatározták az IS központi tengelyét, amely szabályozza a helyi és szisztémás immunreakciókat és a toleranciát. A májsejtek minden típusának aktív immunfunkciója van, beleértve a parenchymasejteket (hepatociták, kolangiociták) és a nem parenchimasejteket [máj sinusoidális endothel sejtek (LSEC), máj májsejtek (HSC) vagy ito sejtek, KC-k, neutrofilek, mononukleáris sejtek, limfociták (B-sejtek, T-sejtek, NK-sejtek, NKT-sejtek, ITL)]. A parenchimasejtek a máj térfogatának legnagyobb részét (78% -80%) foglalják el. A nem parenchimás sejtek és az extracelluláris tér a fennmaradó 5% -6% -ot, illetve 14% -17% -ot képviselik, [11,14].
A máj egyedi anatómiai és szövettani jellemzői fontosak immunfunkciói szempontjából. A máj a szisztémás és a portális keringés találkozásánál helyezkedik el. Körülbelül 1,5 liter vér szolgáltatja percenként; 2/3-át a portális vénán keresztül és 1/3-át a máj artérián keresztül. A kettős vérellátás hatalmas antigénterhelést hordoz a gyomor-bél traktusból és a szisztémás keringésből a májba. Az ebből a két forrásból származó vér keveredik a szinuszoidákban, majd a máj lobuláján keresztül áramlik a peri-portál területéről a központi véna felé. A sinusoidok fenestrált szerkezete lehetővé teszi az antigének és a vér immunsejtjeinek intim kölcsönhatását hepatocitákkal, KC-kkel és HSC-kkel a Disse térben. A veleszületett és adaptív IS bőséges sejtjei a máj szinuszoidjaiban helyezkednek el, és képesek patogén érzékelésre, fagocitózisra, citotoxicitásra, citokin felszabadulásra és antigén bemutatásra a T sejtek számára.
A máj szinuszoidjain áthaladó antigéntartalmú vért az IS „beolvassa”, amely szorosan szabályozott az aktiváció és a tolerancia között. A máj toleráns marad az ártalmatlan étrendi antigénekkel, a bél kommenzális mikrobiota és az autoantigének termékeivel szemben, miközben reagál az exogén toxinokra, a vérben vagy bélben keletkező különféle vírusokra, baktériumokra és parazitákra, valamint az áttétes sejtekre, amelyek megpróbálják a máj otthona. Ezért a máj immunszerepei 2 csoportra oszthatók; immunfelügyelet és a perifériás immun tolerancia kiváltása [3,15]. Valójában a máj IS túlnyomórészt tolerogén szerepet játszik. Ez klinikailag megfigyelhető májtranszplantált betegeknél, például a fő MHC-ből származó máj allotranszplantáció, vagy akár ABO nem megfelelő donorok is átültethetők; ha a kombinált transzplantációt ugyanazon donor szerveivel végzik, nagyobb valószínűséggel elfogadják a nem máj allograftokat; „Operatív tolerancia”, amely klinikailag normális graftfunkciójú beteget ír le anélkül, hogy immunszuppresszióra lenne szükség, a májtranszplantációk akár 50% -ában kialakuló fejlemények [16].
A máj immunfelügyeleti funkciója
A máj erős immunitására támaszkodik azonnali és hatékony védekezésben a potenciálisan toxikus szerekkel szemben, anélkül, hogy káros immunreakciót váltana ki az önstruktúrákkal szemben. A máj, elsősorban a hepatociták, szintetizálja a lokális és szisztémás immunválaszban részt vevő fehérjék fő mennyiségét. Ezeket a fehérjéket akut fázisú reagenseknek nevezzük, mint például fibrinogén, proteináz inhibitorok, komplement fehérjék, PRR-ek [pl. C reaktív fehérje, lipopoliszacharidot (LPS) kötő fehérje, peptidoglikán-felismerő fehérje, oldható CD14], opszonizáló fehérjék (pl. Mannóz-kötő fehérjék) lektin, szérum amiloidok), citokinek (pl. IL-6, tumor nekrózis faktor alfa (TNF-alfa) és transzformáló növekedési faktor béta (TGF-béta)] és hepcidin. Az akut fázisú reagensek a veleszületett immunválasz során működnek, közvetítik a gyulladást, valamint a szövetek helyreállítását és regenerálódását. A májsejtekben való expressziójukat májban dúsított transzkripciós faktorok (pl. HNF-ek, C/EBP-k), gyulladásgátló citokinek (pl. IL-6, IL-22, IL-1β, TNF-α) és a downstream jelátviteli utak szabályozzák. (pl. STAT3, NF-kappa B) [7,15].
A neutrofilek rövid életű, keringő, fagocita sejtek, amelyeket a citokinek és kemokinek, elsősorban az IL-1 és az IL-8 fertőzés helyére toboroznak. Ők az első válaszadók a fertőzésekre, és három fő mechanizmus alapján járnak el; fagocitózis (opszonizációt igényel), reaktív oxigénfajták generálása és degranuláció (enzimeket és antimikrobiális peptideket felszabadító) és neutrofil extracelluláris csapdák (NET) képződése. A NET a mikrobák elpusztításának másik mechanizmusa. Az aktivált neutrofilek által felszabadított különféle mikrobicid fehérjékkel ligált nukleáris DNS képezi ezeket a szövedékeket. Normális körülmények között a májnak kevés neutrofilje van, de a nekrózist követően gyorsan felhalmozódnak. A neutrofilek gyorsan elmozdíthatják adhéziós mechanizmusaikat annak érdekében, hogy az endotoxinra és a baktériumokra egyaránt reagálva NET-ket képezzenek és képezzenek a májban [14].
A makrofágokat klasszikusan aktivált makrofágokként osztályozták (M1, szekretálja a TNF-α, IL-1, IL-6, IL-8 és IL-12-t) vagy alternatív módon aktivált makrofágokat (M2, szekretálja az IL-10-et és a TGF-β-t). citokin szekréciós mintázataik és gyulladásos és immunregulációs aktivitásuk, amelyek azonban felcserélhető funkcionális állapotok, attól függően, hogy milyen mikrokörnyezettel találkoznak a makrofágok [6,11]. A KC-k fix makrofágok, amelyek az oldhatatlan hulladék fagocitózis általi eltávolítására specializálódtak, és képesek a T-sejtek antigénjeinek feldolgozására és bemutatására, és részt vesznek az adaptív immunválasz szabályozásában. A KC-k az LSEC-ek intravaszkuláris oldalán helyezkednek el, és baktériumokat ragadnak meg, és nyírási körülmények között képesek megkötni a 3b komponenst, miközben átfolynak a szinuszokon. A KC-k mikrobiális elpusztításban betöltött szerepe a kórokozó természetétől és a toborzott immunsejtektől függ a gyulladás oldaláig. A PRR-ek májban történő expressziójának jellemző jellemzője a konstitutív expresszió és a bélből származó endotoxinok folyamatos alacsony szintű stimulációja. A TLR4 egy PRRS, amely az összes májsejten expresszálódik, és megköti és megtisztítja az endotoxinokat, így megindítja a gyulladásgátló és gyulladáscsökkentő citokinek szekrécióját [7].
Bár a CD3 + T-sejtek több mint 80% -a alfa-bétaT-sejt, a májat NK-k és nem konvencionális limfociták (NKT és gamma-delta T-sejtek) is dúsítják. A gamma-deltaT sejtek ötször magasabbak a májban (15%), mint a periférián [4].
Azok a hepatociták, amelyek konstitutívan expresszálják az 1-es sejtközi adhéziós molekulát, közvetlenül kölcsönhatásba léphetnek a T-sejtekkel az LSEC-ek fenestrációja révén. Az IFN-gamma a májsejteket APC-kbe adagolja, dózistól függően fokozva a HLA expressziót; a mérsékelt HLA I. osztályú expressziótól a fokozott HLA II. osztályú expresszióig alacsony vagy magas IFN-gamma szinteken. A hepatocita-alapú naiv T-sejtek vagy effektor T-sejtekké válnak, vagy ko-stimuláló jelek hiányában apoptózison mennek keresztül. Másrészt a kolangiociták viszonylag megkíméltek a vér antigén stimulációjától, de nem az epébe szekretáltaktól. A kolangiociták alacsony frekvencián expresszálhatnak TLR-ket, HLA I. osztályt és ko-stimuláló molekulákat. A hepatotrop vírusok (azaz CMV) fokozzák a HLA I. osztály expresszióját anélkül, hogy a HLA II. Olyan kóros állapotokban, mint a PBC, a kolangiociták APC-ként működnek a HLA II. Osztály, valamint a CD80 és CD86 ko-stimuláló molekulák túlzott expresszálásával. A korlátozott kísérleti adatok azt támasztják alá, hogy a HSC-k képesek APC-ként működni. A lipidek H-sejtek általi T-sejtek és NKT-sejtek általi bemutatása aktiválást vagy toleranciát okozhat az IS-ben, a ko-stimulációtól függően [4,7].
A máj közvetítette a perifériás immun toleranciát
A helyi és szisztémás ön tolerancia felülbírálható, így az autoimmun betegségek számos, a májban kialakult kóros immunmechanizmus révén elindulhatnak. Először is, a patológiás antigén prezentáció auto-reaktív T-sejteket és B-sejteket generálhat a hibás klonális deléció (az antigénspecifikus T-sejtek apoptózisa) következtében. Hasonlóképpen az ILC-k is bekapcsolják az autoimmunitást azáltal, hogy elősegítik az antigén megjelenését a klasszikus APC-kkel, citokinek felszabadításával, amelyek polarizálják az immunválaszt az effektor T-sejtek felé. Az ILC-k szintén fontos mediátorok lehetnek az autoimmun májkárosodásban a hepatociták és/vagy az epevezeték hámsejtjeinek elpusztításával. A diszbiotikus mikrobiota okozta patológiás endotoxémia megváltoztathatja az immunválaszt Th2-ről Th1-re. A Treg sejtek mind a veleszületett, mind az adaptív immunitást a CD4 + sejtek, a KC-k és az LSEC-ek szabályozásával szabályozzák. Ezért a Treg sejtek hibás működése rontja a máj immun toleranciáját, ami autoimmun hepatitishez vezet [4,7].
AZ IMMUN HOMEOSTASIS SPEKTRUMA MÁJBAN
A máj IS mindig aktív, függetlenül a válasz általános eredményétől. A máj sértésének jellege és az aktivált sejtek spektruma határozza meg a klinikai képet. Az egészséges egyéneknek kiegyensúlyozott immunfelügyelete van a kórokozókkal, valamint az önantigénekkel szembeni immun tolerancia. A túlzott immun tolerancia a májban krónikus vírusfertőzésekhez vagy a rákos sejtek májáttéteihez vezet. Ezzel szemben a máj immunválasz túlzott aktivációja fulmináns hepatitist, allograft kilökődést vagy autoimmun betegségeket okoz.
A máj immun hemoastasis folyamatosan egyensúlyba kerül a cirrhosis klinikai folyamata során. A kompenzált cirrhosisban szenvedő betegek hiperaktiválták az IS-t, a májbetegségek mögöttes etiológiájától függően. A máj dekompenzációja fokozott bélpermeabilitással jár. A bél mikrobiota és endotoxinjaik epizódos transzlokációja a portális keringésbe szisztémás és májgyulladást vált ki. Az LPS-t, lipopeptideket, glikopolimereket, flagellint és bakteriális DNS/RNS-t felismerő PAMR aktiválja a veleszületett és adaptív immunitást. A felszabaduló gyulladásgátló citokinek és kemokinek májkárosodást és a DAMP aktiválódását okozzák. A PRR tagjai közötti viszkózus ciklus, nevezetesen a PAMP és a DAMP kimeríti az IS-t, így az immunválasz túlnyomórészt „gyulladáscsökkentő” állapotról átvált az osztályok „immunhiányos” állapotára. A cirrhosis ezen nagyon késői szakaszát klinikailag akut-krónikus májelégtelenségként (ACLF) definiálják. Az ACLF-betegek immunhiányos állapotát cirrhosis-asszociált immunhiánynak nevezik [15].
Növényi kezelések potenciális terápiás hatással a májra
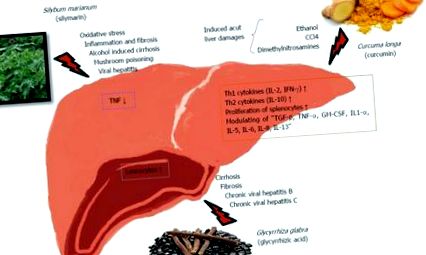
Néhány gyógynövény immunológiai hatásmechanizmusa a májon. IFN: Interferonok; TNF: Tumor nekrózis faktor; IL: Interleukin; TGF: Transzformáló növekedési faktor.
- Májkezelés kiegészítőkkel
- A máj mérgező hatása megakadályozza a fogyást Dr
- A 200 fontot elvesztő sminkes azt mondja, hogy ez a kezelés kulcsfontosságú volt a megjelenés fiatalításában - NewBeauty
- Hogyan érezheti magát a Cushing-kór kezelése után Mi a Cushing-szindróma és a Cushing-féle
- Hogyan segíthet a kiropraktika kezelése a fogyásban