MicroRNA-33a-5p szivacsok a hasnyálmirigy β-sejtek működésének gátlásához terhességi diabetes mellitusban LncRNS DANCR
Absztrakt
Háttér
A terhességi diabétesz mellitus (GDM) a terhességhez kapcsolódó leggyakoribb orvosi szövődmény, amely kockázatot jelenthet mind az anyára, mind a magzatra nézve. A mikro-RNS-ek (miRNS-ek) és a hosszú, nem kódoló RNS-ek (lncRNS-ek) létfontosságú szabályozóként szerepelnek a GDM-ben. Egy nemrégiben készült tanulmány feltárta a miR-33a-5p diszregulációját a GDM betegek placenta szöveteiben. A miR-33a-5p biológiai funkciója a GDM-ben azonban továbbra is megfoghatatlan. Ez a tanulmány a miR-33a-5p működésének és mögöttes mechanizmusainak feltárására összpontosított a GDM-ben.
Mód
A vizsgálatba 12 GDM terhességet és 12 egészséges terhességet vontak be. INS-1 sejtvonalat alkalmaztunk in vitro kísérletekben. A miR-33a-5p, az lnc-DANCR (differenciálódást gátló, nem fehérjét kódoló RNS) és az ABCA1 (ATP-kötő kazetta transzporter 1) mRNS expressziós szintjét RT-qPCR vizsgálattal határoztuk meg. A glükóz- és inzulinszinteket ELISA assay-vel mértük. Luciferáz riportertesztet és Western blot vizsgálatot alkalmaztunk a miR-33a-5p célpontjának validálásához.
Eredmények
A miR-33a-5p-t a GDM-ből származó vérmintákban szabályozták, és pozitívan korrelált a vércukorszinttel (o
Háttér
A terhességi cukorbetegség (GDM) olyan betegség, amelyben a cukorbetegség nélküli nőknél magas a vércukorszint a terhesség alatt [1]. A GDM általában a terhesség utolsó 3 hónapjában jelentkezik, és világszerte a terhes nőket érintheti [2]. A GDM-ben szenvedő nőknél fokozott a 2-es típusú cukorbetegség, a szív- és érrendszeri betegségek és az elhízás kialakulásának kockázata [3, 4]. A GDM a magzati makrosomia, a magzati morbiditás és a mortalitás megnövekedett gyakoriságával társul [5, 6]. Így a GDM patogenezisének jobb megértése kritikus fontosságú a GDM kezelésére szolgáló terápiás stratégiák kidolgozása szempontjából.
A mikroRNS-ek (miRNS-ek) kicsi, nem kódoló RNS-ek, amelyek 20–24 nukleotidból állnak, amelyek a 3'-nem transzlációs (UTR) régióban meg tudnak kötődni a cél-mRNS szekvencia helyéhez, ami az mRNS lebomlását vagy a fehérje transzlációjának gátlását okozza [7]. A MiRNS-eket elismerten létfontosságú szabályozóként ismerik el a különféle emberi betegségek patogenezisében és progressziójában [8], beleértve a GDM-et is [9, 10]. A MiRNA-k az inzulintermelés vagy az endokrin hasnyálmirigy fejlődésének befolyásolásával vesznek részt a GDM szabályozásában. Például a miR-9, a hasnyálmirigy-szigeteken bőségesen expresszált miRNS, csökkentette a béta-sejtek által kiválasztott inzulint glükózstimuláció esetén. A MiR-9 szabályozza az inzulintermelést az Onecut2 (egy elvágott domén, családtag) szabályozásával és/vagy a Rab (rassztal kapcsolatos GTP-kötő fehérje) szabályozásával [11]. A szigeteken és a hasnyálmirigyben erősen expresszált miRNS, a MiR-7 a 6-os párost (Pax 6) célozza meg, hogy negatívan szabályozza a béta-sejtek differenciálódását [12, 13].
A jelenlegi tanulmányban a miR-33a-5p biológiai jelentőségének vizsgálatára összpontosítottunk a GDM szabályozásában és annak potenciális szabályozási mechanizmusában patkány inzulinoma sejtvonal, az INS-1 sejt felhasználásával, amely a szigetecske jól megalapozott sejtmodellje. béta-sejt funkció vizsgálat. Célunk a következő kérdések megválaszolása volt: 1. vajon a miR-33a-5p szabályozatlan-e a GDM-ben; 2. Mi az a miR-33a-5p potenciális célpontja, amely összefüggésbe hozható a funkciójával; 3. Melyik lnc RNS felelős a miR-33a-5p szabályozásáért; 4. Mi a miR-33a-5p hatása az INS-1 sejtek sejtproliferációjára és inzulintermelésére?
Anyagok és metódusok
A betegek példányai
Ebben a tanulmányban 12 GDM-es terhességet és 12 egészséges terhességet (kontroll) választottak a részvételre. Az összes résztvevő 75 g-os orális glükóz tolerancia teszten (OGTT) esett át terhességének 24. és 28. hete között. A kínai társadalom kritériumait a Diabetes Mellitus esetében (kapilláris teljes vér; éhomi glükóz> 90 mg/dl, 1 óra> 180 mg/dl és 2 óra> 155 mg/dl) alkalmazták, és a GDM diagnózist akkor adták meg, amikor két a mérések meghaladták a határértékeket. Az átlagos születési súly a GDM-ben 3787,4 g, a kontroll csoportban pedig 3320,8 g volt. Mindegyik csoportban a magzat neme kiegyensúlyozott volt. A magzat neme két csoport között egyensúlyban volt. A mintákat a Qingdao Egyetemhez tartozó Yuhuangding Kórházból gyűjtötték össze, és további elemzés céljából -80 ° C-on lefagyasztották. A mintagyűjtést megelőzően minden résztvevőtől írásos beleegyező nyilatkozatot kaptak. A vizsgálati protokollt a Qingdao Egyetemhez tartozó Yuhuangding Kórház Etikai Bizottsága hagyta jóvá.
Sejtkultúra
A HEK293 sejtvonalat, az elsődleges embrionális emberi veséből létrehozott állandó sejtvonalat az American Type Culture Collection (ATCC, Manassas, USA), az INS-1 sejtvonalat pedig a ThermoFisher Scientific (MD, USA) szerezte be. A tenyészeteket Dulbecco módosított Eagle táptalajában (Thermo Fisher Scientific, Waltham, MA, USA) tartottuk fenn, 10% magzati marhaszérummal (Thermo Fisher Scientific), penicillinnel (100 U/ml) és sztreptomicinnel (100 U/ml) (Sigma) kiegészítve. -Aldrich, St. Louis, MO, USA) 37 ° C-on 5% CO2-ot tartalmazó nedvesített inkubátorban.
Kvantitatív reverz transzkripció-PCR (RT-qPCR)
Az összes RNS-t TRIzol reagenssel (Invitrogen, Carlsbad, CA, USA) extraháltuk, és az RNS koncentrációját és tisztaságát NanoDro2000c spektrofotométerrel (Thermo Scientific, Waltham, USA) határoztuk meg. A reverz transzkripciót TaqMan MicroRNA reverz transzkripciós készlettel (Applied Biosystems, Carlsbad, CA) végeztük. Az RT-qPCR folyamatot egy ABI7500 valós idejű PCR rendszeren hajtottuk végre.
Western blot
A sejteket RIPA pufferben (PI89901, Thermo Scientific Pierce, MD, USA) lizáltuk, proteáz inhibitor koktéllal együtt (A32963, Thermo Scientific Pierce, MD, USA). Összesen 20 μg fehérjét töltöttünk 10% SDS-poliakrilamid gélre, és elektroforézissel elválasztottuk őket. A fehérjéket polivinilidén-difluorid (PVDF, Bio-Rad, Hercules, CA, USA) membránokra vittük át, majd 5% zsírmentes tejjel blokkoltuk, és az ABCA1 vagy GAPDH elleni elsődleges antitestekkel inkubáltuk (Cell Signaling Technology, Danvers, MA, USA ). Ezután a membránokat HRP-konjugált szekunder antitestekkel inkubáltuk. A jeleket ECL segítségével tettük láthatóvá (Millipore, Burlington, MA, USA).
Enzimhez kapcsolt immunszorbens vizsgálat (ELISA)
A vércukorszintet az Abcamstól (Cambridge, MA, USA) származó glükóz assay kit (ab65333) segítségével mértük, az inzulin szekréció szintjét pedig a RayBiotech (Norcross, GA, USA) inzulin ELISA készlet segítségével határoztuk meg a manufaktúra utasításai szerint.
Luciferáz riportervizsgálat
A vad típusú vagy mutáns ABCA1 3′-UTR DNS-fragmensét a psiCHECK2 riporterbe (Promega, WI, USA) klónoztuk psiCHECK2-ABCA1-WT vagy psiCHECK2-ABCA1-Mut néven. Az lnc-DANCR vad típusú vagy mutáns DNS-fragmenst szintén a psiCHECK2 riporterbe klónoztuk psiCHECK2-DANCR-WT vagy psiCHECK2-DANCR-Mut néven.
A HEK293 sejteket együtt transzfektáltuk miR-33a-5p utánzattal és psiCHECK2-ABCA1-WT, psiCHECK2-ABCA1-Mut, psiCHECK2-DANCR-WT vagy psiCHECK2-DANCR-Mut, valamint pRT-TK Renilla plazmiddal. A luciferáz aktivitást Dual-Luciferase Reporter assay rendszerrel (Promega, WI, USA) mértük 48 órás ko-transzfekció után.
Sejtszámláló Kit-8 (CCK-8) vizsgálat
A sejtek életképességét CCK8 vizsgálattal határoztuk meg a manufaktúra utasításai szerint (Abcam, Cambridge, MA, USA). Az INS-1 sejteket 96 lyukú lemezekre oltottuk, és a transzfekció után 37 ° C-on inkubáltuk a kívánt időpontig. CCK-8 oldatot adunk a lemez minden egyes lyukához, majd inkubáljuk 37 ° C-on. Az abszorbanciát mikrolemez-leolvasóval mértük 450 nm-en.
Statisztikai analízis
A statisztikai elemzést SPSS 13.0 szoftverrel (IBM, Armonk, New York, USA) végeztük. Az eredményeket χ 2 teszttel, Student t teszttel vagy egyirányú ANOVA-val értékeltük Tukey post hoc tesztjével, és átlag ± SD-ként fejeztük ki. A független kísérleteket legalább három példányban megismételtük. A korrelációkat Spearman-féle korrelációs együttható teszt alkalmazásával elemeztük. A különbségeket jelentősnek tekintették a o
Eredmények
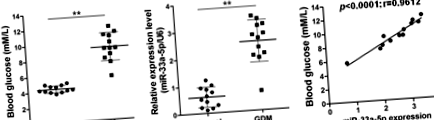
A miR-33a-5p és a vércukorszint pozitívan korrelált a GDM-ben
A jelenlegi vizsgálatban normál egészséges terhességből 12 és GDM terhességből származó 12 vérmintát alkalmaztak. Először ezekben a mintákban mértük meg a vércukorszintet, és megerősítettük, hogy a GDM terhességeknél a vércukorszint szignifikánsan magasabb volt, mint az egészséges donorokban (o 1. ábra
A miR-33a-5p túlzott expressziója gátolta az INS-1 sejtproliferációját és inzulintermelését
A miR-33a-5p funkcionális relevanciájának vizsgálata a GDM-ben arra törekedett, hogy megvizsgáljuk a miR-33a-5p túlzott expressziójának hatását az INS-1 sejtek sejtproliferációjára és inzulintermelésére. Az INS-1 sejteket miR-33a-5p-utánzó és miR-negatív kontroll (NC) utánzóval transzfektáltuk. Az INS-1 sejtekben a miR-33a-5p szintek megnövekedett szintjét a miR-33a-5p-utánzó transzfekció után RT-qPCR vizsgálattal igazoltuk (2a. Ábra). A sejtproliferációs eredmények azt mutatták, hogy a miR-33a-5p upreguláció csökkentette az INS-1 sejtek sejtnövekedési sebességét (2b. Ábra). Megfigyeltük azt is, hogy a miR-33a-5p túlzott expresszió csökkent inzulinkoncentrációt, valamint alacsonyabb inzulinszekréciót eredményezett alacsony (3,3 mM) és magas (16,7 mM) glükóz állapotokban (2c és d ábra).
A miR-33a-5p szuppresszió elősegítette az INS-1 sejtproliferációját és inzulintermelését
A miR-33a-5p GDM-en történő további tanulmányozásához miR-33a-5p-t leütünk INS-1 sejtekben miR-33a-5p inhibitor alkalmazásával. A miR-33a-5p leütését a miR-33a-5p inhibitor transzfekciója után RT-qPCR vizsgálattal igazoltuk (3a. Ábra). A miR-33a-5p túlzott expressziójának az INS-1 sejtekre gyakorolt hatásával ellentétben a miR-33a-5p elnyomása elősegítette az INS-1 sejtek sejtszaporodását (3b. És c. Ábra). Érdekes módon a miR-33a-5p gátlása fokozta az inzulin koncentrációt és az inzulin szekréciót alacsony és magas glükózszint esetén is (3d. Ábra).
A miR-33a-5p megcélozza az ABCA1-et
A miR-33a-5p funkcionális célpontjának azonosításához jól bevált miRNS-cél keresési algoritmust alkalmaztunk (http://www.microrna.org). Megállapítottuk, hogy a 3′-UTR régiók ABCA1 a miR-33a-5p potenciális kötőhelyét tartalmazó gén (4a. ábra). Az ABCA1 validálása a miR-33a-5p célpontjaként a luciferáz jelentést, az RT-qPCR és a Western blot vizsgálatokat alkalmaztuk. Megállapítottuk, hogy a miR-33a-5p túlzott expressziója specifikusan csökkentette a HEK293 sejtekben az ABCA1 vad típusú, de nem mutáns 3′-UTR régióit tartalmazó plazmid által termelt luciferáz szignált (4b. Ábra). Továbbá a miR-33a-5p erőltetett expressziója csökkentette mind az mRNS, mind az ABCA1 fehérje szintjének expresszióját az INS-1 sejtekben (4c. És d. Ábra). Végül, a miR-33a-5p-vel ellentétben, az ABCA1 expressziós szintje szignifikánsan alacsonyabb volt a GDM-ben a normál donorokhoz képest (o 4. ábra
Az Lnc-DANCR célpontjai az miR-33a-5p
Bizonyítottuk, hogy a miR-33a-5p megcélozza az ABCA1-et. A miR-33a-5p szabályozása azonban továbbra sem ismert. A miR-33a-5p potenciális cél lncRNS-jét egy jól ismert lncRNS-miRNS előrejelző eszköz (starBase v2.0) segítségével kutatva azonosítottuk, hogy az lnc-DANCR potenciálisan kötődik a miR-33a-5p-hez (5a. Ábra). Ennek a megállapításnak a megerősítésére az lnc-DANCR-WT vagy az lnc-DANCR-Mut szekvenciát inszertáltuk a luciferáz-riporter plazmidba. Az eredmények azt mutatták, hogy a miR-33a-5p túlzott expressziója nyilvánvalóan csökkentette az lnc-DANCR-WT luciferáz aktivitását, de az lnc-DANCR-Mut nem, ami arra utal, hogy a miR-33a-5p specifikusan kötődik az lnc-DANCR-WT szekvenciájához csökkentse a luciferáz szignált (5b. ábra). Valójában az lnc-DANCR túlexpressziója csökkent, míg az lnc-DANCR leütése fokozta a miR-33a-5p expresszióját az INS-1 sejtekben (5c. Ábra).
Az lnc-DANCR-miR-33a-5p jelátvitel biológiai funkciójának vizsgálatához INS-1 sejtekben az INS-1 sejteket transzfektáltuk kontrollal, lnc-DANCR, miR-33a-5p vagy lnc-DANCR + miR-33a- 5p kombináció. Az eredmények azt mutatták, hogy az lnc-DANCR upreguláció elősegítette, míg a miR-33a-5p upreguláció gátolta az INS-1 sejtek sejtszaporodását és inzulinkoordinációját. Érdekes módon az lnc-DANCR erőltetett expressziója megmentheti a miR-33a-5p által közvetített gátló hatásokat az INS-1 sejtek sejtproliferációjára és inzulintermelésére (5d. És e. Ábra).
Az lnc-DANCR, az ABCA1, a miR-33a-5p és a vércukorszint közötti összefüggés a GDM-ben
Az lnc-DANCR expressziós szintjét 24 vérmintában egészséges donoroktól vagy GDM terhességektől határoztuk meg RT-qPCR segítségével. Az eredmények azt mutatták, hogy az lnc-DANCR expressziós szintje szignifikánsan alacsonyabban volt szabályozva a GDM-ben, mint az egészséges donorokban (o 6. ábra
Vita
Az ABCA1 egy koleszterin efflux szabályozó fehérje, amely szabályozza a koleszterin kiáramlását, a foszfolipid homeosztázist és a lipid anyagcserét [33, 34]. Magas ABCA1 szintet figyeltek meg a magzat kapillárisainak endothelsejtjeiben a placenta anyai oldalán [35, 36]. Az ABCA1 szabályozza a transzplacentális feto-anya lipidcserét, jelezve ezzel a normális magzati fejlődésben betöltött fontos szerepét [37]. Beszámoltak arról is, hogy az ABCA1 a GDM-ben szenvedő betegeknél alacsonyabb szintű szabályozásban van [38]. Mások publikációival [18,19,20, 38] összhangban nem csak megerősítettük az ABCA1 down-szabályozását a GDM betegek placenta szöveteiben, hanem azt is megállapítottuk, hogy az ABCA1 a miR-33a-5p közvetlen célpontja a GDM-ben. Megállapítottuk továbbá, hogy a miR-33a-5p és az ABCA1 expressziós szintjei szintén negatívan korreláltak a GDM-es betegeknél, ami összhangban volt a korábbi megállapításokkal is, miszerint a miR-33a-5p és az ABCA1 expressziója fordítottan korrelál [15,16,17 ].
A miRNS-ek expresszióját több tényező szabályozza, például transzkripciós faktorok, epigenetikai módosítás, miRNS biogenezis és lncRNS-ek. Az lncRNS-ek gyakran miRNS-szivacsként funkcionálnak, ami megkötődik a miRNS-ekkel, és blokkolja a miRNS képességét az mRNS-céljának megkötésére [39, 40]. A jelentések szerint az Lnc-DANCR a különböző emberi rákos megbetegedések kialakulásához, progressziójához és metasztázisához kapcsolódik [41]. A közelmúltban végzett vizsgálatok arra utaltak, hogy az lnc-DANCR elősegíti a glioma, valamint az oszteoszarkóma tumor progresszióját a miR-33a-5p szivaccsal [27, 42]. Ezekkel a megállapításokkal összhangban azt is megerősítettük, hogy az lnc-DANCR kötődött a miR-33a-5p-hez és csökkentette a miR-33a-5p szintet az INS-1 sejtekben. Fordított összefüggést figyeltünk meg az lnc-DANCR és a miR-33a-5p között GDM-ben. Az lnc-DANCR túlzott expressziója elősegítette az INS-1 sejtek sejtszaporodását és inzulintermelését. Ennél is fontosabb, hogy az lnc-DANCR upreguláció megmentheti a miR-33a-5p INS-1 sejtekre gyakorolt gátló hatását.
Következtetés
A jelenlegi tanulmány kimutatta, hogy a miR-33a-5p a GDM-ben felülszabályozott. A miR-33a-5p túlzott expressziója gátolta az INS-1 sejtek sejtszaporodását és inzulintermelését. A miR-33a-5p szabályozta az INS-1 sejtek működését az ABCA1 célzásán keresztül. Az Lnc-DANCR a miR-33a-5p szivacsaként funkcionálva szabályozta a miR-33a-5p-t. Az Lnc-DANCR túlzott expressziója csökkentette a miR-33a-5p INS-1 sejtekre gyakorolt gátló hatását. Eredményeink új betekintést nyújtanak a miR-33a-5p szerepeibe a GDM-ben.
Az adatok és anyagok rendelkezésre állása
A jelenlegi vizsgálat során létrehozott és elemzett adatkészletek ésszerű kérésre a megfelelő szerzőtől kaphatók.
- Gesztációs cukorbetegség szűrése, diagnosztizálása és kezelése - amerikai családorvos
- Pregravid májenzimszintek és a terhességi cukorbetegség kockázata a későbbiek során
- Táplálkozási terápia a terhességi cukorbetegségben A cukorbetegség előrelépésének ideje
- Tápanyagok különszámú táplálkozása terhességi cukorbetegség esetén
- A hasnyálmirigy zsírlerakódása fokozott, és összefüggésben van a béta-sejtek működésével családos nőknél