Nátrium
Szerkesztõink átnézik az Ön által beküldötteket, és megállapítják, hogy módosítják-e a cikket.
Nátrium (Na), a periódusos rendszer alkálifémcsoportjának (1. csoport [Ia]) kémiai eleme. A nátrium nagyon puha ezüstfehér fém. A nátrium a leggyakoribb alkálifém és a hatodik leggyakoribb elem a Földön, amely a földkéreg 2,8 százalékát teszi ki. A természetben bőségesen előfordul olyan vegyületekben, különösen a közönséges sóban - nátrium-kloridban (NaCl) -, amely az ásványi halitot képezi, és a tengervíz oldott alkotóelemeinek körülbelül 80% -át teszi ki.
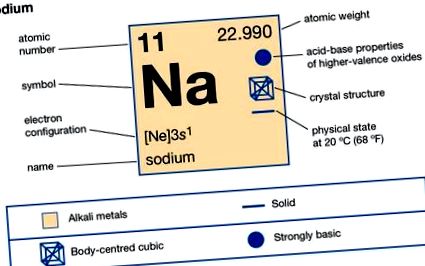
| 11. |
| 22.9898 |
| 97,81 ° C (208 ° F) |
| 882,9 ° C (1621 ° F) |
| 0,971 (20 ° C) |
| +1, −1 (ritka) |
| 2-8-1 vagy 1s 2 2s 2 2p 6 3s 1 |
Tulajdonságok és gyártás
Mivel a nátrium rendkívül reaktív, soha nem fordul elő szabad állapotban a földkéregben. 1807-ben Sir Humphry Davy lett az első, aki elemi formájában nátriumot készített, az olvadt nátrium-hidroxid (NaOH) elektrolízisével. A nátrium számos szilikát anyag, például a földpátok és a micák fontos alkotóeleme. A világ különböző részein hatalmas kősó-lelőhelyek találhatók, Chilében és Peruban nátrium-nitrát-lerakódások vannak. A tenger nátriumtartalma körülbelül 1,05 százalék, ami körülbelül 3 százalék nátrium-halogenid koncentrációnak felel meg. A nátriumot mind atom, mind ion formában azonosították a csillagok, köztük a Nap és a csillagközi közeg spektrumában. A meteoritok elemzése azt mutatja, hogy a jelenlévő szilikát anyag átlagosan körülbelül 4,6 atom nátriumot tartalmaz minden 100 szilíciumatom után.
A nátrium könnyebb, mint a víz, szobahőmérsékleten késsel vágható, de alacsony hőmérsékleten törékeny. Könnyen vezet hőt és villamos energiát, és jelentős mértékben érzékeli a fotoelektromos hatást (elektronkibocsátás fény hatására).
A nátrium messze a kereskedelemben a legfontosabb alkálifém. A nátrium előállítására szolgáló legtöbb folyamat az olvadt nátrium-klorid elektrolízisét foglalja magában. Olcsó és tartálykocsi-mennyiségben kapható, az elemet benzin-adalékanyagok, polimerek, például nylon és szintetikus kaucsuk, gyógyszerek, valamint számos fém, például tantál, titán és szilícium előállítására használják. Széles körben használják hőcserélőként és nátrium-gőz lámpákban is. A nátrium-gőz lámpa és a nátriumláng sárga színét (a nátriumra vonatkozó analitikai teszt alapja) a fényspektrum sárga részén két kiemelkedő vonallal azonosítják.
Jelentős felhasználások
A fém-nátrium legkorábbi felhasználása a nátrium-cianid és a nátrium-peroxid gyártása volt. Jelentős mennyiséget használtak fel a tetraetil-ólom benzin-adalékként történő előállítására, amely piac az ólommentes benzin megjelenésével eltűnt. Jelentős mennyiségű nátriumot használnak a nátrium-alkil-szulfátok, mint a szintetikus detergensek fő összetevőjének előállításához.
A nátriumot kiindulási anyagként használják a nátrium-hidrid (NaH) és a nátrium-bór-hidrid (NaBH4) előállításához is. Ezenkívül a nátriumot színezékek és színezék-intermedierek előállításában, parfümök szintézisében és a szerves redukciók sokféle változatában alkalmazzák. Szénhidrogének tisztításához és telítetlen szénhidrogének polimerizálásához használják. Számos szerves alkalmazásban a nátriumot diszperziók formájában használják folyékony szénhidrogén közegben.
Az olvadt nátrium kiváló hőátadó folyadék, és ezen tulajdonsága miatt hűtőközegként használta fel a folyékony-fém gyors tenyésztő reaktorokban. A nátriumot a kohászatban széles körben használják deoxidánsként és redukálószerként kalcium, cirkónium, titán és más átmeneti fémek előállításához. A titán kereskedelmi előállítása magában foglalja a titán-tetraklorid (TiCl4) nátriummal történő redukcióját. A termékek fém Ti és NaCl.
Fő vegyületek
A nátrium rendkívül reaktív, és sokféle vegyületet képez szinte minden szervetlen és szerves anionnal (negatív töltésű ionok). Oxidációs állapota általában +1, és egyetlen vegyértékű elektronja nagy könnyedén elvész, így a színtelen nátriumkation (Na +) keletkezik. A nátrium-aniont, Na - tartalmazó vegyületeket szintén szintetizálták. A fő kereskedelmi nátriumvegyületek a klorid, a karbonát és a szulfát.
A legfontosabb és legismertebb nátriumvegyület a nátrium-klorid vagy közönséges só, NaCl. A legtöbb egyéb nátriumvegyületet közvetlenül vagy közvetve nátrium-kloridból állítják elő, amely a tengervízben, természetes sóoldatokban és kősóként fordul elő. Nagy mennyiségű nátrium-kloridot használnak más nehéz (ipari) vegyi anyagok gyártásához, valamint közvetlenül jég és hó eltávolítására, víz kondicionálására és élelmiszerekben használják.
A nátrium-klorid további főbb kereskedelmi alkalmazásai közé tartozik a klór és a nátrium-hidroxid elektrolitikus bontással történő előállításában való felhasználása, valamint a nátrium-karbonát (Na2CO3) Solvay-eljárással történő előállítása. A vizes nátrium-klorid elektrolízise nátrium-hipokloritot, NaOCl-t, nátrium-, oxigén- és klórvegyületet eredményez, amelyet nagy mennyiségben használnak a háztartási klórfehérítőkben. A nátrium-hipokloritot ipari papírfehérítőként használják papírpép és textíliák számára, víz klórozására, valamint bizonyos gyógyászati készítményekben antiszeptikus és gombaölő szerként. Ez egy instabil vegyület, amely csak vizes oldatban ismert.
A karbonátok tartalmazzák a karbonátiont (CO3 2–). A nátrium-hidrogén-karbonát, más néven nátrium-hidrogén-karbonát, vagy szóda-hidrogén-karbonát, a NaHCO3 szén-dioxid-forrás, ezért sütőporok, pezsgős sók és italok összetevőjeként, valamint a száraz-vegyi tűzoltók fő összetevőjeként használják. . Enyhe lúgossága hasznos a gyomor- vagy vizelethiánysavasság és az acidózis kezelésében. Bizonyos ipari folyamatokban is alkalmazzák, például a cserzésben és a gyapjú előkészítésében. A nátrium-karbonát vagy szódabikarbóna, a Na2CO3, széles körben elterjedt a természetben, ásványvizek alkotóelemeiként, valamint szilárd ásványi anyagokként a natron, a trona és a termonatrit formájában fordul elő. Ebből az alkáli sóból nagy mennyiséget használnak üveg, mosószerek és tisztítószerek készítéséhez. A nátrium-karbonátot szén-dioxiddal kezeljük, így nátrium-hidrogén-karbonátot kapunk. A nátrium-karbonát monohidrát formáját, a Na2CO3 · H2O-t széles körben használják a fényképészetben, a fejlesztők alkotóelemeként.
A nátrium-szulfát, a Na2SO4, fehér kristályos szilárd anyag vagy por, amelyet nátronpapír, karton, üveg és mosószerek gyártásához és különféle vegyi anyagok előállításához használnak. Vagy a nátrium-szulfát ásványi mirabilit és azutánardit lerakódásából, vagy szintetikus úton nyerhető a nátrium-klorid kénsavval történő kezelésével. A kristályosított termék egy hidrát, Na2SO4 · 10H2O, közismert nevén Glauber-só. A nátrium-tioszulfátot (nátrium-hiposzulfit), a Na2S2O3-t a fotósok használják a kialakult negatívumok és nyomatok rögzítésére; úgy működik, hogy feloldja az ezüst sók filmre bevont részét, amely a fény hatására változatlan marad.
A nátrium-hidroxid (NaOH) maró fehér kristályos szilárd anyag, amely könnyedén felszívja a nedvességet, amíg fel nem oldódik. A nátrium-hidroxid, amelyet általában nátronlúgnak vagy lúgnak hívnak, a legszélesebb körben alkalmazott ipari alkáli. Nagyon maró hatású az állati és növényi szövetekre. A vízben oldva képződő lúgos oldatok különböző kereskedelmi folyamatokban semlegesítik a savakat: a kőolaj-finomítás során eltávolítja a kénsavat és a szerves savakat; a szappankészítés során zsírsavakkal reagál. A NaOH oldatait a cellulóz kezelésében és számos vegyi anyag gyártásában használják.
A nátrium-nitrátot vagy a nátrium-nitrátot, a NaNO3-ot Chile-salétromnak nevezik, az ásványi lerakódások után Chile északi részén, a fő forrásként. A nátrium-nitrátot nitrogéntartalmú műtrágyaként és a dinamit komponenseként használják.
- Szurikáta-jellemzők, élőhely, étrend, viselkedés és tények Britannica
- Shea Nut Oil - A Shea Nut Oil tulajdonságai és a táplálkozási tények
- Leves, húsleveskockák és granulátumok, alacsony nátriumtartalmú, száraz táplálkozási tények és kalóriák
- Marshmallow root Előnyök, kockázatok és felhasználások
- Hat magas nátriumtartalmú étel; soha nem vártam - Chatelaine