Nutraceutical megközelítés az alkoholmentes zsírmáj betegségben (NAFLD): A rendelkezésre álló klinikai bizonyítékok
Arrigo F. G. Cicero
1 Olasz Táplálkozástudományi Társaság (SINut), Orvosi és Sebészeti Tudományi Osztály, Bolognai Egyetem, 40138 Bologna, Olaszország; [email protected]
Alessandro Colletti
1 Olasz Táplálkozástudományi Társaság (SINut), Orvosi és Sebészeti Tudományi Osztály, Bolognai Egyetem, 40138 Bologna, Olaszország; [email protected]
Stefano Bellentani
2 Gasztroenterológiai és Hepatológiai Szolgálat - Clinica Santa Chiara, 6604 Locarno, Svájc; moc.liamg@onafetsinatnelleb
Absztrakt
1. Bemutatkozás
A májban a zsír intracelluláris beszivárgása máj steatosisnak nevezhető, és annak oka lehet mind a túlzott alkoholfogyasztás (alkoholos zsírmájbetegség - AFLD), mind más anyagcsere-tényezők (alkoholmentes zsírmájbetegség - NAFLD). A tudományos közösség által az AFLD és a NAFLD megkülönböztetésére választott nemzetközi küszöbszint napi 2 ital, 20 g-nak felel meg. A NAFLD rendkívül általános állapot, amely az általános felnőtt népesség 25–30% -át, a gyermekek 15% -át, valamint a túlsúlyos, elhízott és 2-es típusú cukorbetegek több mint 50% -át érinti. A NAFLD akkor sem tekinthető igazi betegségnek, ha abszolút reverzibilis [2].
A NAFLD klinikailag agresszív változata, az alkoholmentes steatohepatitis (NASH), amelyet gyulladás és progresszív szövetdegeneráció jellemez, az általános felnőtt populáció körülbelül 5% -át, és az elhízott emberek 20% -át érinti [3]. A NAFLD és a NASH diagnózis arany standardja a májbiopszia. A NAFLD diagnózisát azonban általában ultrahanggal („fényes máj”) diagnosztizálják, a krónikus májbetegség egyéb okainak kizárása után, az alkoholfogyasztás alacsonyabb, mint 20 g/nap, és validált pontszámok, például a zsírmáj index ( FLI), vagy fibrózis pontszám vagy mások [4].
Az elsődleges NAFL és NAFLD fő kockázati tényezői (1. táblázat) a túlsúly/elhízás, inzulinrezisztencia/2-es típusú cukorbetegség, hipertrigliceridémia és a kapcsolódó étrendi-viselkedési kiváltó tényezők, elsősorban a fruktózzal édesített italok bevitele. Önmagában a különböző megfigyelési vizsgálatokban [5] csak a cukrozott (főleg fruktózzal rendelkező) üdítők fogyasztása növeli a NAFLD kialakulásának kockázatát körülbelül 55% -kal [6]. A feltörekvő kockázati tényezők között szerepel még a dohányzási szokás és az obstruktív alvási apnoe szindróma (OSAS), de az álmatlanság és a túlzott nappali álmosság, amelyek nem kapcsolódnak az éjszakai alvási apnoéhez [7,8]. Az első kockázati tényező azonban gyakran a rossz életmódbeli szokásokhoz kapcsolódik. Végül, a hypothyreosis és a NAFLD közötti szoros összefüggést a közelmúltban megerősítette 13 prospektív vizsgálat meta-elemzése, amely megmutatta, hogy a hypothyreosis miként növelheti a NAFLD kockázatát több mint 50% -ra. A kockázat 70% -ra nő, ha a szubklinikai hypothyreosis kizárt [9].
Asztal 1
Az alkoholmentes zsírmáj betegség (NAFLD) kialakulásának fő kockázati tényezői.
| Finomított ételekben, magas glikémiás indexű szénhidrátokban, fruktózzal édesített italokban gazdag étrend Ülő Túlsúly/elhízás Inzulinrezisztencia/II. Típusú cukorbetegség Kortizonok, metotrexát, néhány antiretrovirális szer bevitele | Szarkopénia Pajzsmirigy alulműködés Hyperuricemia Cigaretta füst Krónikus obstruktív tüdőbetegség (COPD) Policisztás petefészek szindróma Helicobacter pylori fertőzés |
A NAFLD az első lépés a máj parenchyma visszafordíthatatlan elváltozásainak kialakulásához, amelyek cirrhosishoz vezetnek (a NAFLD eseteinek kb. 1/3-a általában NASH-sá válik, és ezek 15% -a cirrhosissá degenerálódhat), másrészt A NAFLD maga is a rizikófaktor a szív- és érrendszeri betegségek [10] és a 2-es típusú cukorbetegség kialakulásában, és az előzetes adatok szerint ez összefüggésbe hozható a máj- és a májon kívüli onkológiai patológiák nagyobb gyakoriságával is [11]. 9 megfigyelési tanulmány nemrégiben készített metaanalízise, amely 96 595 felnőtt alany adatait tartalmazta (akiknek 34,1% -át érintette a NAFLD), és 5,2 éves medián megfigyelési periódus alatt 4654 közepes vagy súlyos veseelégtelenség esete mutatta a krónikus veseelégtelenség alakul ki 37% -kal magasabb a NAFLD-ben szenvedő betegeknél. Ez a kockázat annál nagyobb volt a máj lipidbe való beszivárgásának mértékében. Figyelembe véve, hogy a veseelégtelenség és a NAFLD önmagában is a szív- és érrendszeri betegségek kockázati tényezői, könnyen megérthető, hogy ez az epidemiológiai összefüggés milyen különös jelentőségű [12].
A szilibin kémiai szerkezete.
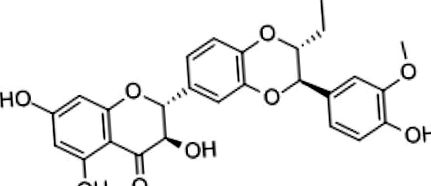
A szilimarin gyenge orális biohasznosulása, mind a gyenge bélfelszívódás, mind a máj első pass pass metabolizmusának köszönhetően. Ez a korlátozás azonban megkerülhető bizonyos gyógyszerészeti technikákkal, például a szilimarint egy fitoszómában komplexelve foszfatidil-kolinnal, ami növeli az oldhatóságát, miközben megőrzi antioxidáns tulajdonságait [23]. A szilimarin kétségtelenül az egyik legtöbbet vizsgált növényi eredetű táplálék hepatopátiás betegeknél, még súlyos betegség esetén is [24]. A farmakológiai mechanizmusok, amelyek révén a szilimarin hepatoprotektív hatását fejti ki NAFLD-ben szenvedő betegeknél, számos és összefoglalva található a 2. táblázatban [25], amely kiemeli azokat is, amelyek pozitívan befolyásolhatják az érrendszer egészségét.
2. táblázat
A silymarin májvédő hatásában részt vevő biológiai hatások a NAFLD-ben szenvedő betegeknél.
Közvetlen hulladékkezelő tevékenység *
Mitokondriális funkció optimalizálás *
Védőmolekulák, például hősokk-fehérjék, tioredoxin és sirtuinok aktiválása
Az NF-κB aktivitás gátlása
Gyulladásos citokinszintézis redukció (IL-1, IL-6, TNF-α, TNF-β) *
A kaszpáz felszabadulás és a TNF-a hatás modulálása
A csillagképző sejtek fibroblasztokká történő átalakulásának gátlása
A profibrotikus gének (prokollagén III, TGF-β) expressziójának csökkentése
Az ösztrogén receptorok részleges aktiválása *
A GLUT4 fokozott expressziója a sejtfelületen *
A hidroxi-metil-glutaril-koenzim-A-reduktáz gátlása *
Az epesó-exportáló szivattyú szabályozása *
GLUT4 = 4-es típusú glükóz transzporter, IL = Interleukin, NF-κB = aktivált B-sejtek magfaktor kappa-könnyűlánc-fokozója, PPAR = peroxiszóma-proliferátor-aktivált receptor, TGF-β = transzformáló növekedési faktor béta, TNF = tumor nekrózis faktor, * potenciálisan pozitív hatások az érrendszer egészségére.
A rendelkezésre álló adatok azt mutatják, hogy a szilimarin (önmagában vagy általában alacsony dózisú E-vitaminnal kombinálva) képes javítani az inzulinrezisztenciát és a hepatosteatosis közvetett markereit (Hepatic Steatosis Index, Lipid Accumulation Product) már 3 hónapos kezelés után [26].
Egy nemrégiben végzett multicentrikus randomizált kettős-vak, 3. fázisú vizsgálatban 180 NAFLD/NASH szövettani diagnózissal rendelkező betegen végeztek szilibint és E-vitamint (188 mg silibin, 388 mg foszfatidilkolin, 180 mg E-vitamint) 12 hónapon keresztül. A transzamináz, a gamma-glutamil transzferáz szintjének jelentős csökkenése és a máj steatosis szignifikáns csökkenése mind ultrahangvizsgálattal, mind a betegek ötödénél egy második májbiopsziával mérve. A várakozásoknak megfelelően arányosan javult az éhomi glükóz, a bazális inzulinémia és az inzulinrezisztencia index is [27]. Ezeket az adatokat 8 kontrollált klinikai vizsgálat metaanalízise igazolta 587 beteg bevonásával [28]. Van egy előzetes jelentés is, amely azt mutatja, hogy a 420 mg/nap silymarinnal történő kiegészítés csökkentette a cirrhosisban szenvedő betegek 4 éves halálozási kockázatát [29]. Az általános tolerálhatóság általában jó, még nagy dózisok és hosszú távú adagolás esetén is [30]. Ezen okok miatt a Mayo Klinika táplálékkiegészítőkre vonatkozó irányelvei a szilimarin hepatoprotektív felhasználását B fokozatba sorolják („Jó tudományos bizonyíték erre a felhasználásra”) [31].
Kardiometabolikus szempontból különösen érdekes a szilimarin klinikai hatása a cukorbeteg páciens metabolikus kontrolljára. Öt kontrollált klinikai vizsgálat nemrégiben végzett metaanalízise, amelybe 270 beteget vontak be, megmutatta, hogy a szilimarin beadása jelentősen javította-e az éhomi glikémiás kontrollt (−26,86 mg/dl; 95% CI −35,42–18,30) és a glikált hemoglobin értékeket (−1,07; 95%) CI -1,73–0,40), elfogadhatóan ennek a tápláléknak az inzulin-szenzibilizáló hatására [32].
A silymarin alkalmazásának legnagyobb korlátja általában a hatékony dóziskezelés költsége, amelyet folyamatosan kell beadni és idővel elhúzódni kell, legalábbis az életmód optimalizálásáig, és az ultrahang májvizsgálat normalizálása.
3.2. E-vitamin
A NAFLD-ben szenvedő betegeknél alaposan tesztelt táplálék-gyógyszer, bár szinte mindig a szilimarinnal társul, az E-vitamin (alfa-tokoferol vagy (2R) -2,5,7,8-tetrametil-2 - [(4R, 8R) - (4, 8,12-trimetiltridecil)] kromán-6-ol) (2. ábra).
A tokotrienolok kémiai szerkezete.
Az E-vitamin aktív formájának leghatékonyabb adagja a gyulladás és a májfibrózis csökkentése érdekében 40-szer nagyobb, mint az ajánlott napi adag (RDA) (800 NE/nap). A 20-szor nagyobb dózisok (400 NE/nap) azonban a halálozás minden okból megnövekedett kockázatával járnak. Ezért óvatosságra van szükség az E-vitaminnal történő hosszú távú terápiák hatékony adagolásakor. A klinikusok többsége alacsonyabb, kevésbé hatékony, de biztonságosabb dózisban használja az E-vitamint, vagy más aktív gyógyszerekkel társítja, amelyek valószínűleg hatékonyak a NAFLD kezelésében [33]. A 16 kontrollált klinikai vizsgálat nemrégiben készült metaanalízise kimutatta, hogy az alacsony dózisú E-vitamin hosszú távú és önmagában (nem más antioxidáns vitaminokkal együtt) történő alkalmazása képes csökkenteni a miokardiális infarktus kockázatát (RR 0,82; 95% Cl, 0,70–0,96; p = 0,01) [34]. Ezenkívül egy másik metaanalízis, amelybe hét tanulmányba beiratkozott 303 alany vett részt, azt mutatta, hogy az E-vitamin-kiegészítés az áramlás által közvetített értágulat 2,5% -os növekedésével jár [35]. Ez az eredmény fontos, mivel becslések szerint az áramlás által közvetített értágulat 1% -os javulása a kardiovaszkuláris kockázat 12% -os csökkenésével járna [36].
3.3. D-vitamin
A D3-vitamin (1,25 OH kolekalciferol; C27H44O; ID IUPAC: (3β, 5Z, 7E) -9,10-szekocholesta-5,7,10 (19) -trien-3-ol) (3. ábra) szekoszteroid hormon, amelynek moláris tömege 384,64 g/mol, és amely alapvető szerepet játszik az ásványi anyagcserében, de az immunválasz, a sejtdifferenciálódás és a gyulladás szabályozásában is, fontos következményekkel jár mind a máj, mind a szív- és érrendszer egészségében. Az emberi testben a D-vitamin körülbelül 10% -ban származik az étrendből, míg 90% -a a 7-dehidrokoleszterin kolekalciferollá történő átalakulásából származik, ultraibolya B (UVB) hatásának kitéve. Ezután a kolekalciferolt a májból 25-hidroxilázzal, majd a veséből egy alfa-1-hidroxilázból hidroxilezik, ami 1,25-hidroxi-kolekalciferol vagy kalcitriol D-vitamin aktiválódását eredményezi. a modern életmód, amely összefügg a máj és a vese hidroxilezésének életkorának csökkenésével, a lakosság nagy részét viszonylag és abszolút hiányosítja a D-vitaminban [37].
A D3-vitamin kémiai szerkezete.
A D-vitamin-hiány és az alkoholmentes hepatosteatosis csak az általános populáció mindkét betegségének magas előfordulása miatt társulhat. A legújabb epidemiológiai bizonyítékok azonban azt mutatják, hogy a NAFLD-ben szenvedő betegeknél gyakrabban hiányzik a D-vitamin, mint az általános populációban, és a keringő D-vitamin szintje arányos a NAFLD fibrotikus evolúciójának mértékével [38]. Mindazonáltal nem minden vizsgálat egyezik: a megfigyeléses vizsgálatok nemrégiben végzett metanalízise, amelybe 974 NAFLD beteget vontak be, nem mutatott különbséget a 25-hidroxi-D-vitamin szintjeiben a magas NAFLD aktivitási pontszámmal (NAS) rendelkező NAFLD betegek és az alacsony NAS (MD = −0,93, 95% CI −2,45–0,58), valamint a magas fibrózis pontszám az alacsony fibrózis ponttal szemben (MD = 0,88, 95% CI −2,65–4,42). A D-vitamint a NAFLD patogenezisében feltételező bizonyítékok ellenére a szérum 25-hidroxi-D-vitamin nem társulhat a NAFLD szövettani súlyosságával [39]. Ezenkívül Barchetta et al. orális D-vitamin-kiegészítés (2000 NE/nap) 24 hét alatt nem javította a máj steatosisát vagy az anyagcsere/kardiovaszkuláris paramétereket a NAFLD-ben szenvedő cukorbetegeknél [40]. Ezzel szemben Lim és mtsai. arra utal, hogy a szérum 25-hidroxi-D-vitamin szintje a metabolikus szindróma kockázati tényezője lehet a NAFLD-ben szenvedő betegeknél [41].
A 3. táblázat összefoglalja a rendelkezésre álló bizonyítékokat, amelyek a D-vitamint és a NAFLD-t kóros fiziológiai szempontból kötik meg, igazolva a D-vitamin-pótlást az ezen állapot által érintett betegeknél [42,43]. Ezenkívül az integrációt a nem farmakológiai adagolási dózisok mellékhatásainak virtuális hiánya indokolja, mivel a D-vitamin-hiány szinte járványos, és azok a pozitív hatások, amelyeket a vitamin nemcsak a csont és a máj szintjén, hanem a az immun- és a szív- és érrendszer [44,45].
3. táblázat
A D-vitamint és a NAFLD-t megkötő kórélettani mechanizmusok.
A D-vitamin-receptor nélküli egerek inzulinrezisztensek
A D-vitamin modulálja az inzulin gén transzkripcióját
A D-vitamin-hiány rontja a béta-sejtek szekréciós válaszát a szénhidrátterhelésre adott válaszként
A D-vitamin javítja az izomsejtek glükóztranszportját
A D-vitamin szabályozza a GLUT4 transzlokációját és a glükóz adipociták általi felhasználását
A máj D-vitaminának magasabb szintje magasabb adiponektin-szinttel jár (fordítva arányos az adipocytás flogózissal)
Állatmodellekben a D-vitamin pótlása csökkenti az IL-6 mennyiségét az adipocitákban
Az emberi zsírsejtek D-vitaminnal történő kezelése gátolja az NF-kB-t és csökkenti a gyulladásos prokaminok felszabadulását.
A D-vitamin gátolja a makrofágok kemotaxisát és növeli az adiponektin expresszióját a preadipocytákban
A D-vitamin-hiány kiváltja a Toll receptorokat és súlyosbítja a máj gyulladását
A patkányok mesterséges megvilágítása csökkenti a gyulladás és a máj apoptózis mértékét
A D-vitamin receptor expressziója kolangiocytákon fordítottan arányos a steatosis súlyosságával és a NAFLD pontszámokkal
A D-vitamin in vitro gátolja a májcsillagsejtek szaporodását
A D-vitamin csökkenti a pro-fibrotikus marker szintet (mint TIMP-1) és az I. típusú kollagén termelődését a máj stellát sejtjeinek sejttenyészeteiben
A D-vitamin receptor knockout egerek spontán kialakítják a májfibrózist
GLUT4 = 4-es típusú glükóz transzporter, IL = interleukin, NF-kB = aktivált B-sejtek magfaktor kappa-könnyűlánc-fokozója, TIMP-1 = metalloproteinázok-1 szövetgátlói.
Egyes klinikai vizsgálatok azt mutatják, hogy a napi D-vitamin-kiegészítés javítja az inzulinrezisztenciát és a kapcsolódó paramétereket a NAFLD-ben szenvedő betegeknél [54,55]. A D-vitamin pótlása szintén pozitív hatással lehet a szív- és érrendszerre. Valójában, miközben hiánya összefüggésben áll a magas vérnyomás és az érrendszer öregedésének kockázatával. Kiegészítése éppen ellenkezőleg, jelentősen csökkentené a magas érzékenységű C reaktív fehérje szintjét, amely a szív- és érrendszeri betegségek független kockázati tényezőjeként ismert, amint azt 10 tanulmány meta-analízise bizonyította 924 résztvevő bevonásával [56].
3.4. Az Omega-3 sorozat többszörösen telítetlen zsírsavai
Az omega-3 sorozat többszörösen telítetlen zsírsavai (4. ábra) esszenciális zsírsavak, amelyeket az emberi test nem képes szintetizálni, és ezeket az étrendben kell bevenniük.
A dokozahexaénsav (DHA) és az eikozapentaénsav (EPA) kémiai szerkezete.
- Alkoholmentes zsírmáj betegség (NAFLD)
- Az alkoholmentes zsírmájbetegség (NAFLD) tünetei, kezelése, megelőzése A fogyatékkal élők világa
- Alkoholmentes zsírmájbetegség (NAFLD) és alkoholmentes szteatohepatitis (NASH); Arizona máj
- Alkoholmentes zsírmájbetegség és annak megelőzése
- Metformin alkoholmentes zsírmájbetegség és alkoholmentes szteatohepatitis esetén - FPIN s Clinical