Oculopharyngealis izomsorvadás
Tartalom
- 1 Betegség entitás
- 1.1 Betegség
- 1.2 A betegség története
- 1.3 Genetika
- 1.4 Kórélettan
- 1.5 Epidemiológia
- 2 Történelem
- 3 Fizikai vizsgálat
- 4 Diagnózis
- 4.1 Laboratóriumi vizsgálat
- 4.2 Differenciáldiagnózis
- 5 Rendszerirányítás
- 5.1 Blepharoptosis kezelése
- 5.2 Blepharoptosis szövődmények
- 5.3 Előrejelzés
- 6 Hivatkozások
Az okulopharyngealis izomsorvadást a következő kódok ismerik fel a szabványos nómenklatúra szerint:
- Betegségek Nemzetközi Osztályozása (ICD)
- ICD 10: G71.0
- Az ember online mendeli öröksége
- OMIM: 164300
Betegség
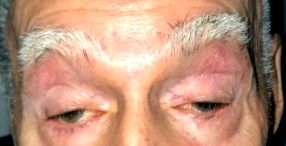
Az okulopharyngealis izomdisztrófia (OPMD) tipikusan egy későn megjelenő genetikai autoszomális dominánsan átvitt örökletes vázizomzat. Az OPMD elsősorban az extra szemizmokat (oculo-) és a garatot (-garat) foglalja magában, de gyakran a végtagok proximális izmait is magában foglalja. Progresszív blepharoptosis (ptosis) és dysphagia társul. Más önkéntes izmok idővel érintettek lehetnek. A szemhéj emelőjén és a szemen kívüli izmokon kívül jellemzően érintett izomcsoportok közé tartoznak az alsó végtagok proximális izmai, és kisebb mértékben a felső végtagok is. A tünetek általában az élet ötödik évtizedében jelentkeznek, bár egyes esetekben korábban és súlyosabban is érintettek.
A betegség története
Az OPMD-ről 1915-ben eredetileg egy francia-kanadai család négy tagjánál számoltak be, [1] és az állapotot először úgy írták le, hogy M Victors, R Hayes és RD Adams 1962-ben az „okulopharyngealis izmos dystrophia” kifejezést használta. [2]
Genetika
Autoszomális dominánsan öröklődő rendellenesség, a mögöttes genetikai rendellenesség a pABPN1 gén mutációja, amelyet először 1988-ban írtak le., GCT, GCC és GCG - kódolhatják az alanin) ismétlődő régiót a 14q11.2 kromoszómán. [3] Ez a régió a poliadenilát-kötő fehérje 1-es nukleáris génjének (PABPN1, korábbi rövidítése PABP2) N-terminális része. A PABN1 szabályozó funkcióval rendelkezik a messenger RNS poliadenilezésében. [4] Az N-terminális domén általában (GCN) 10 ((GCN) 10/Ala10), de az alaninbővítések hossza +1 és +8 között mozog. [5] A mutáció nemzedékeken át stabil, és nem mutat genetikai várakozást.
Gyakori mutációk prevalencia szerint rendezve:
- GCN) 13 a leggyakoribb domináns mutáció Quebecben és világszerte
- (GCN) 11 egy recesszív polimorfizmus, amelyet az észak-amerikai, európai és japán egyének 1-2% -a hordoz. Súlyosabb fenotípust okoz, ha a páciens mind a (GCN) 13, mind a (GCN) 11 variánssal rendelkező vegyület heterozigóta
- Vannak olyan ritka homozigóta esetek, amelyek két domináns mutációt hordoznak, amelyeket két érintett szüleiktől örököltek, és amelyeknek sokkal súlyosabb fenotípusuk van
Bár az öröklődési minta jellemzően autoszomális domináns, egy allélos autoszomális recesszív formát dokumentáltak (lásd fent a gyakori mutációkat). Autoszomális domináns OPMD esetekben, bár egyetlen mutáció is elegendő a betegség kialakulásához, időnként mindkét allél mutálódik, ami nemcsak a betegség korábbi megnyilvánulását eredményezi, hanem gyorsabb és súlyosabb progressziót is eredményez. AD betegeknél a heterozigóta hordozó minden gyermekének 50% esélye van arra, hogy örökli a betegséget okozó mutációt. Majdnem teljes behatolási mintázat van, a megnövekedett életkor mellett fokozott a megjelenés kockázata. A mutációval rendelkező egyének többsége az élet 7. évtizedében mutatkozott be (de átlagosan az 5. évtizedben jelentkezik). Az autoszomális recesszív mutációval rendelkezők esetében az utódok kötelezőek lesznek a heterozigóta (hordozók) számára, de az érintettség kockázata kevesebb, mint 1%, tekintve a (GNC) 11 recesszív allél 2% -os hordozói arányát. [3]
Kórélettan
A PABPN1 gén felelős a vázizomsejtekben az mRNS integritásáért és transzportjáért a testen keresztül, megőrizve integritását és működését. A PABPN1 mutációval rendelkező betegeknél az mRNS törékenysége megnő, ami intracelluláris csomókat eredményez. Ezek a csomók (intranukleáris zárványok) progresszív izomsejt-diszfunkciót, esetleges sejthalált és ezáltal progresszív klinikai izomdiszfunkciót eredményeznek.
Így a genetikai tesztek mellett az izombiopszia is hasznos lehet az OPMD diagnosztizálásában. Az intranukleáris zárványok (INI) jelenléte a myonukleusokban az OPMD specifikus szövettani jellemzője. Diavetítésenként a PABPN1-t és sok más RNS-kötő fehérjét tartalmazó INI látható elektronmikroszkóppal, mint tubuláris filamentum az OPMD betegek deltoid izomzatának 4-5% -ában. [6] Nem ismert, hogy mi az oka az OPMD-nek, de a fő hipotézisek szerint a patológiát vagy 1) a halmozódó fehérjék (INI), vagy 2) a normál fehérje hiánya okozza. A klinikailag nem érintett izmok szövettani megállapításokkal is rendelkezhetnek, például peremű vakuolák és rongyos vörös rostok, amelyek dystrophiás patológiára utalnak (de az érintetlen izmokban található megállapítások nem specifikusak az OPMD-re). [7]
Járványtan
Az OPMD legnagyobb csoportja a kanadai Québecben található, de eseteket több mint 30 országban figyeltek meg. [8] Québec francia-kanadai lakosságának OPMD gyakorisága 1/1000, [9] míg Izrael burkharai zsidó lakosságának a világon a legnagyobb a génfrekvenciája, 1/600 érintett. [10]
A betegek általában lassan progresszív bilaterális, bár gyakran aszimmetrikus, blepharoptosisról panaszkodnak. A betegek néha kompenzálják azt, ha nyakhosszabbítással „álla felfelé” helyezkednek el, hogy a látótengelyüket a ptotikus felső szemhéjakhoz képest rosszabb helyzetbe hozzák. A diszfágia szilárd ételekkel kezdődik, de folyadékok felvételével is előreléphet. A beszéd nehézségei vagy a rekedtes gyenge hang kiemelkedő jellemző lehet. Néhány beteg fokozatos fáradtságot és lassuló vagy megváltozó járást észlel. Az alsó végtag gyengesége gyakoribb, mint a felső végtagok gyengesége. A felső végtagok proximális gyengeségét leginkább a deltoid izmokban észlelik, ha egyáltalán.
Az OPMD klinikai tünetei az életkor függvényében változnak, bár végül minden betegnél ptosis és dysphagia alakul ki, bizonyos fokú proximális lábgyengeséggel. Az érintett genetikai csoporttól függően a jelek a következők: [11] [12]
Pertinens normális eredmények a sérülésmentes belső szemizmok és a retina normális működése.
A következő három kritérium hasznos az OPMD diagnózisának klinikai alapú megállapításához: [9]
- Pozitív családi anamnézis két vagy több generáció részvételével (fontos mellékjegyzet: minden genetikai rendellenesség gyanúja esetén fontos a törzskönyv kitöltése)
- A ptosis jelenléte vagy a ptosis korábbi korrigált műtéte (az egyik vagy mindkét palpebralis repedés kisebb vagy egyenlő, mint 8 mm (függőlegesen átlagosan 10 mm).
- A dysphagia jelenléte (képtelen 80 cm3 hideg vizet inni kevesebb, mint 8 másodperc alatt)
A fenti kritériumok a (GCN) 13 mutáció penetranciájára vonatkoznak az 50 év körüli betegek 31% -ában, míg a 69 év feletti betegek esetében 99% -ban [15].
Laboratóriumi teszt
Az egy polimeráz láncreakció (PCR) tesztjének érzékenysége és specificitása a PABPN1 mutációra az egyén hordozó státuszának meghatározása érdekében meghaladja a 99% -ot. A DNS-termékek méretével meghatározhatjuk a GCN-beillesztések számát és a pontos GCN-szekvenciát. Tüneti egyén DNS-vizsgálatának indikációi a következők: [12]
- A diagnózis megerősítése soha nem tesztelt családban
- Diagnosztikai dilemmát felmutató klinikai kép megerősítése
- A mutáció méretének értékelése, mint a súlyosság lehetséges mutatója
- A vegyület heterozigóta állapotának értékelése súlyos, korábban kialakult formában szenvedő páciensnél
- A recesszív OPMD-ben szenvedők megerősítése
Megkülönböztető diagnózis
- Szem myasthenia gravis (az OPMD-vel ellentétben a ptosis ingadozó és fáradékony)
- Mitokondriális miopátia
- Krónikus progresszív külső oftalmoplegia (CPEO; A teljes külső oftalmoplegia ritka az OPMD-ben)
- Mitokondriális neurogasztrointesztinális encephalopathia szindróma (MNGIE; néha gyermek OPMD-nek nevezik, de nem találtak PABPN1 (GCN) n mutációt)
- Oculopharygnodistal myopathia (OPDM; a gyengeség az élet elején jelentkezik. Arcdiplegia látható, bár ez nem drámai jellemző az OPMD-ben)
- A myotonikus dystrophia (az OPMD-vel ellentétben gyakori a myotonia, amely képtelen pihenni az izmokat a használat után.) Az extraocularis izomeltérések gyakran diplopiát okoznak. A myotonikus dystrophia okuláris leletei között szerepelnek a „karácsonyfa” szürkehályog-változások is, és viszonylag alacsony az intraokuláris nyomás a szem myotonikus dystrophiájában, valószínűleg a csilló test leválása miatt. (A ptózis mindkettőnél közös) [16]
- Polimiozitisz (nem lesz ptosis)
- Inklúziós test myositis (IBM; beleértve a myositist, a polymyositist és a progresszív bulbar bénulást. Ezeknek nincs ptosisuk)
- Autoszomális domináns disztális myopathia (hangszál gyengeség ptosis nélkül)
- Az extraokuláris izmok veleszületett fibrózisa (CFEOM; veleszületett ptosis dysphagia nélkül).
Jelenleg nincs megállapított orvosi kezelés az OPMD számára. Elősegíteni kell a magas fehérjetartalmú étrendet a fogyás korlátozására, valamint a nem megerőltető kardiovaszkuláris gyakorlatokat, az izmok lebomlásának korlátozására. [12] Ambulációs segítségre lehet szükség náddal vagy kerekesszékkel.
Ki kell értékelni a tüneti diszfágiát. Súlyos dysphagia, markáns súlycsökkenés, majdnem végzetes fulladás vagy visszatérő tüdőgyulladás sürgős értékelést igényel. A cricopharyngealis myotomia (felső nyelőcső záróizom myectomia) a legtöbb esetben enyhíti a tüneteket. [17] A cricopharyngealis dilatáció a leggyakrabban alkalmazott kezelés, bár tudományos bizonyítékok még mindig hiányoznak annak hosszú távú előnyeiről. A cricopharyngealis botulinum toxin, a myectomia utáni autológ myoblast transzplantáció és a trehalóz molekula felhasználása az OPMD fenotípus enyhítésére az embereknél jelenleg vizsgált terápiák közé tartozik. [18] [19] [20] [21] A mutáns PABPN1 gén elnémítására és funkcionális kópiával történő helyettesítésére irányuló állatkísérletek sikeresek voltak az egereknél, és folyamatban vannak az erőfeszítések annak értékelésére, hogy ez a siker átadható-e emberi betegeknek. [22]
Blepharoptosis kezelése
A blepharoptosis korrekciója ajánlott, ha a szemhéjak zavarják a látást, vagy a beteg nyaki fájdalomra panaszkodik a nyak állandó meghosszabbítása miatt. A levator palpebrae aponeurosis és a frontalis szuszpenzió reszekciója egyaránt lehetséges. [23] Eredetileg azt gondolták, hogy Beard veleszületett ptosis irányelvei alkalmazhatók az OPMD-ben szenvedőkre [24], és hogy a levator palpebrae aponeurosis reszekció ésszerű elsődleges eljárás lenne ezen irányelvek alapján. [25] Azonban a veleszületett ptosissal ellentétben, amely statikus betegség, az OPMD idővel fokozatosan romlik. Ezért Beard iránymutatásai általában magas mértékű újrafeldolgozást eredményeznek azoknál az OPMD-ben szenvedőknél, akik a levátor előrehaladásán mennek keresztül.
Ezért sok sebész most elsődleges frontalis felfüggesztést választ, még akkor is, ha a levátor funkció> 4 mm. [26] A Frontalis szuszpenzió újragyakorlatokban is alkalmazható azoknál a betegeknél, akiknél előzőleg levátoros reszekció volt. Kimutatták, hogy a Frontalis felfüggesztés megfelelő eredményeket ér el, többek között azokban is, amelyek jó levator funkcióval rendelkeznek. [27] Különböző felfüggesztési anyagokkal, felfüggesztési mintákkal és követési idővel rendelkező publikációk sokasága miatt egyetlen technika vagy anyag sem tekinthető aranyszínvonalnak. A szintetikus anyagok azonban egyre népszerűbbek a polipropilén varratokon és a szilikon szalagokon végzett nagy tanulmányokkal, amelyek elfogadható eredményeket hoztak. [27] [28] (2. ábra)
A blepharoplasztika ellenjavallatai kifejezett ophthalmoplegia, száraz szem szindróma vagy gyenge orbicularis funkció. [12]
Blepharoptosis szövődmények
A lagophthalmos a legjelentősebb szempont. Amikor frontalis szuszpenziót végeznek helyi érzéstelenítésben, akkor a 3 mm-nél nagyobb reflex távolságra (MRD1) való törekvés, különösen rossz orbicularis tónusú betegeknél, jelentős szaruhártya-expozíciót eredményezhet. A konzervatív MRD-1 (általában ≤2,5 mm) elérése minimálisra csökkenti a lagoftalmot és a potenciálisan súlyos nemkívánatos eseményeket. Sling expozíció, fertőzés vagy blepharoptosis kiújulás a betegség progressziója, a csomó csúszása vagy az anyagi sajt bekötése miatt. A polipropilén és a szilikon szalagok a legtöbb esetben másodlagos eljárásként beállíthatók az MRD-1 módosítására.
Prognózis
Az OPMD progresszív betegség. A betegeknél fokozatosan csökken az izomerő. Az ismételt blepharoptosis műtétek minimalizálhatók az elsődleges frontalis szuszpenzió figyelembevételével, különösen csökkent levator funkcióval rendelkező esetekben. A garat diszfunkciójának és a táplálkozás megfelelő kezelésével a várható élettartam nem rövidül. [13]
- Pozitív maradni a súlygyarapodás és az izomdisztrófia mellett - Izomdisztrófia hírfórumok
- Erős hátsó edzés egy izmos keret felépítéséhez
- A láb fájdalmas izomsorvadása Rheumatology Oxford Academic
- Projekt elindítása Az Egészséges, Biztonságos Gyermekek Országos Központja
- Az alegység kölcsönhatásai és viszonyuk a nyúl vázizomzatának alloszterikus tulajdonságaihoz