Foszfaturia
Kapcsolódó kifejezések:
- Angolkór
- Hipofoszfatémia
- A kalcium izotópjai
- D-vitamin
- Fibroblast növekedési faktor 23
- Foszfor
- Foszfát
- Parathormon hormon
Letöltés PDF formátumban
Erről az oldalról
A mellékpajzsmirigy hormon és a kalcium homeosztázis
GORDON J. STREWLER, Gyermekcsont, 2003
A foszfát visszaszívódása
A PTH foszfaturiát indukál, feltehetően a foszfát kiürítésének mechanizmusaként, amely a kalciummal együtt felszívódik a D-vitamin hatása alatt, vagy amely a csontból felszabadul a kalciummal együtt, amikor a csont felszívódik. A PTH foszfatirikus hatásának hiánya volt a fő bizonyíték, amelyet Albright et al. [317] arra a következtetésre jutottak, hogy a pszeudohypoparathyreoidizmus alapja a célszerv nem reagál a PTH-ra.
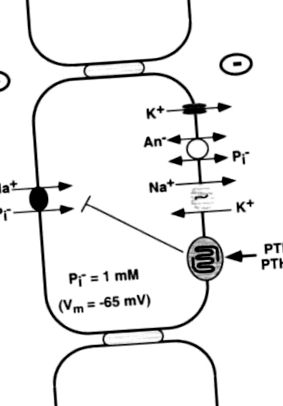
A PTH gátolja a foszfát visszaszívódását azáltal, hogy csökkenti a transzporterek számát az apikális membránban (18. ábra) [169, 318]. Három nátrium-foszfát kotranszportert klónoztunk. Kettő, az I és IIa típusú NaPi kotranszporterek a proximális tubulus apikális membránjain expresszálódnak, de a PTH által végzett szabályozás fő célpontja a IIa típusú transzporter. A IIa típusú transzporter szintjét az apikális membránon a PTH-val végzett kezelés csökkenti [319, 320], és az egérben a IIa típusú kotransporter gén megszakadása nagymértékben megszünteti a hormonérzékeny foszfát visszaszívódást [321]. Az előrejelzések szerint a IIa típusú kotranszporternek nyolc transzmem korpa doménje van, és a proximális tubulusban a nátriumhoz kapcsolt foszfát visszaszívódás körülbelül 70% -áért felelős [322]. Az apikális membránon lévő szintjét az étrendi foszfát bevitele is szabályozza, így a transzporter sűrűségét és a foszfát visszanyerését maximalizálja az alacsony étrendi foszfáttartalom [169, 318]. Az I. típusú NaPi kotranszporter kevésbé specifikus anion transzport fehérje, a III. Típusú kotransporter sok sejttípusban expresszálódik, és sejtes háztartási funkciókat szolgálhat [169].
18. ÁBRA. A foszfát (Pi) visszaszívódása a proximális tubulusban. A foszfátot aktívan kell szállítani a PCT-sejt apikális membránján, mivel az erősen negatív belső potenciál és az a tény, hogy a citoszolos Pi-koncentráció (1 mM) megközelítőleg százszorosa az egyensúlyi szintnek. Ezt a transzportot egy elektrogén IIa típusú NaPi kotransporterrel hajtják végre, amelyet a bazolaterális Na + -K + -ATPáz által létrehozott meredek transzmembrán Na + gradiens táplál. Ennek a transzporternek az aktivitását csökkenti a PTHR aktiválása. A bazolaterális Pi kilépési mechanizmusokat nem ismerjük jól, de egy anioncserélő lehetővé teheti Pi számára, hogy passzívan távozzon a sejtből.
A PTH a membrán-kereskedelem szabályozásával szabályozza az apikális membránon a IIa típusú NaPi kotranszporterek szintjét. A PTH növeli a kotranszporterek visszakeresését az apikális membránból azáltal, hogy az intermicrovilláris hasadékokban lévő clathrinnel bevont gödrökhöz irányítja őket. A transzportert a tubulusfolyadékban oldódó fehérjékkel együtt vezikulákba építik és internalizálják (19. ábra). Az internalizált NaPi kotransportereket tartalmazó vezikulák lizoszómákban lebomlanak, és nincs bizonyíték arra, hogy a kotransporterek visszavezethetők lennének a sejtfelszínre [323, 324].
19. ÁBRA. A NaPi társszállítás PTH által történő szabályozása. A PTH1R aktiválása a PCT sejtek bazolaterális membránján stimulálja a PKA-t és a PKC-t. A PKA vagy PKC aktiválása az apikális felületen kifejezett NaPi-2 transzporterek aktivitásának gyors csökkenését idézi elő. Ez magában foglalhatja egy vagy több köztes fehérje (X) foszforilezését, mivel a NaPi-2 fehérjében lévő konszenzusos PKC foszforilációs helyek kiküszöbölhetők, anélkül, hogy befolyásolnák a PKC szabályozó hatását. A PTH-hatás legalább egy része magában foglalja a felszíni NaPi-2 kotranszporterek visszanyerését mikrocsőle-függő endocitózis, lizoszomális fúzió és lebontás folyamatával.
A PTH által megcélzott molekuláris helyet nem sikerült azonosítani. Lehet, hogy nem a szállító; a IIa típusú kotransporter PKC foszforilációs helyekkel rendelkezik, de ezen maradékok mutációja nem szünteti meg a transzport PTH általi gátlását [333, 334]. A transzporter két intracelluláris hurokját tartalmazó doménre van szükség a PTH hatásához [334]. A IIa típusú kotransporter kölcsönhatásba lép egy Na +/H + cserélő szabályozó faktor családtaggal (NHERF-1) [314, 335] és más PDZ domént tartalmazó fehérjékkel [336], és ez a kölcsönhatás fontos lehet a receptorok apikális membrán, a receptorok PTH-val vagy mindkettővel történő visszakereséséhez.
Sav-bázis, elektrolit és anyagcsere-rendellenességek
Ahmad Bilal Faridi, Lawrence S. Weisberg, a kritikus gondozás orvoslásában (harmadik kiadás), 2008
Fokozott vesekiválasztás
Az elsődleges hyperparathyreosis bármilyen oka foszfaturiát okoz, és hajlamos hipofoszfatémiát okozni. A hipokalcémia vagy a D-vitamin hiánya vagy rezisztenciája által okozott hyperparathyreosis hasonlóan összefügg a hipofoszfatémiával. Kivételt képez a krónikus vesebetegség másodlagos hiperparatireoidizmusa, amelyre jellemző a csökkent vesefoszfor elimináció okozta hiperfoszfatémia. A D-vitamin-hiány vagy a rezisztencia a csökkent bélfoszfát-felszívódás miatt hipofoszfatémiát is okoz. Az extracelluláris térfogat-bővülés növeli a szűrt foszforterhelést és hígítja a foszfor luminalis koncentrációját, ami foszfaturiát eredményez. Az etanol és a glycosuria egyaránt csökkenti a proximális tubulus-foszfát visszaszívódását. 208 285 Minden diuretikum, főleg azok, amelyeknek proximális tubuláris hatása van, mint például az acetazolamid és kisebb mértékben a tiazidok, foszfaturiát okoznak.
A bizonytalan differenciálás különféle daganatai
MD, Eduardo Calonje, DipRCPath. Boštjan Luzar, PhD, a bőr Mesenchymal Neoplasia diagnosztikai atlaszában, 2020
Klinikai szolgáltatások
Járványtan
A legtöbb érintett egyén felnőtt
Ritka eseteket jelentettek gyermekekkel és idősekkel kapcsolatban
Bemutatás
Az osteomalacia és a foszfaturia régóta fennáll
A fibroblaszt-23 növekedési faktor (FGF-23) szérumszintjének emelkedése, amely szerepet játszik a vese tubuláris foszfátvesztésében
Ritka esetekben nem alakul ki FGF-23
Lágyrészekben vagy csontokban keletkeznek, leggyakrabban az alsó végtagokban
A méret változó, de általában kicsi; a csontban kialakuló daganatok általában kisebbek, mint a lágy szövetekben
Prognózis és kezelés
A legtöbb daganat jóindulatú
Teljes kivágással gyógyítva, amely az osteomalacia feloldódását eredményezi
Gyakori a lokális kiújulás
A rosszindulatú daganatok végzetes áttétekhez vezethetnek
A foszfát homeosztázis endokrin szabályozása
3.1 Parathormon hormon
A foszfát visszaszívódását a vesében csökkenti a PTH, amely foszfaturiát vált ki. Csökkent visszaszívódás lép fel, mivel az Npt2a és az Npt2c fehérje szintje csökken a BBM-ben. Az endocitózis révén az Npt2a lebomlás céljából a lizoszómákba kerül, míg az Npt2c a mikrotubulusoktól függő útvonalon keresztül oldódik fel. A proximális tubulus bazolaterális és apikális felülete egyaránt tartalmaz PTH receptorokat. Az apikális felületen a PTH receptorokat egy protein-kináz C (PKC) út jelzi, és egy protein kináz A (PKA) út jelzi a PTH receptorokat a bazolaterális felületen. A PTH szignalizáció az NHERF1 foszforilezésével történik. 46–49 Az FGF23 termelését fokozza a PTH, és a foszfát az mRNS stabilizálásával növeli a PTH termelést. 50–54
I. kötet
2. típusú pseudohypoparathyreosis
I. kötet
A kalcitonin veseműködése
A vesék nem cisztás örökletes betegségei
Örökletes hipofoszfatémiás ricsa hypercalciuriával
Ez egy családi rendellenesség, amely rachitaként, alacsony termetként, foszfaturiában, hiperkalciuriában (8 mg/kg/24 óra), valamint a fokozott bél kalcium- és foszfátfelszívódásként jelentkezik. A keringő 1,25-dihidroxi-D3-vitamin koncentrációja kétszer-ötször normális, összehasonlítva az X-hez kapcsolódó hipofoszfatémiás rachit csökkent koncentrációival és a hipofoszfatémiás csontbetegség normál koncentrációival. Ez a rendellenesség egy vesefoszfát-szivárgást jelent, amely hipofoszfatémiát eredményez, ami viszont serkenti az 1,25-dihidroxi-D3-vitamin szintézist. A magasabb D-vitamin metabolitkoncentrációk fokozott aktív bél kalcium felszívódást, a mellékpajzsmirigy hormon (PTH) szekréciójának elnyomását és hiperkalciuriát eredményeznek. Mivel a plazmában az 1,25-dihidroxi-D3-vitamin koncentrációja megemelkedik, a D-vitamin terápia nem javallt. A hosszú távú orális foszfát önmagában megfordítja ennek a ritka rendellenességnek a biokémiai jellemzőit. 11.
Kalcium- és foszforbetegségek
ROBERT F. REILLY JR., az Onco-Nephrology-ban, 2020
Myeloma multiplex.
Mivel az FLC által kiváltott Fanconi-szindrómában szenvedő betegek többségében MGUS vagy parázsló myeloma van, kemoterápia nem ajánlott, tekintettel a másodlagos myelodysplastikus szindróma és a leukémia kockázatára alkilező szerekkel. Nincsenek olyan vizsgálatok, amelyek kiértékelnék a proteaszóma inhibitorokat.
A csont glükokortikoid hatásának klinikai és alapvető szempontjai
Barbara E. Kream,. Barbara P. Lukert, a Csontbiológia alapelvei (harmadik kiadás), 2008
Emésztőrendszeri kalcium felszívódás
A glükokortikoidok farmakológiai dózisait szedő betegeknél a kalcium, a hiperkalciuria és a foszfaturia felszívódása gyomor-bélrendszerben, valamint a szérum PTH és 1,25 (OH) 2D magasabb szintje a szteroidokat nem szedő betegekkel összehasonlítva (Adams et al., 1981; Bikle et al., 1993; Favus és mtsai, 1973; Shrivastava és mtsai, 2000). Még a beklometazon nagyon kicsi orális adagjai is, hasonlóan azokhoz a dózisokhoz, amelyeket a betegek inhalációs formában használó betegek lenyelhetnek, csökkentik a kalcium felszívódását a belekben (Smith és mtsai, 1993).
A kalcium a bélből passzív (paracelluláris) és aktív (transzcelluláris) transzport révén szívódik fel. Az aktív kalcium felszívódás elsősorban a duodenumban lokalizálódik és szorosan szabályozott. A transzcelluláris kalciumtranszport három egymást követő sejtszintű lépésben írható le, ideértve a luminalis kalcium transzferjét az enterocitába a TRPV6 epitheliális Ca 2+ csatornával, a citoszolos Ca 2+ transzlokációját a bazolaterális membrán felé kalbindin-D9K segítségével és az aktív extrudálást a keringésbe az ATPáz 1b plazmamembrán (PMCA1b) által (Huybers et al., 2007; van Abel et al., 2003).
A glükokortikoidok által kiváltott csökkent aktív Ca 2+ felszívódás a nyombél első részében a csökkent TRPV6 és kalbindin-D9K expresszióval jár együtt normál kalcitriolszint jelenlétében, ami a glükokortikoidok kalcitrioltól független hatását sugallja a kalcium felszívódására. A kalcium felszívódásának in vitro vizsgálatai a D-vitamintól független, a kalcium transzport gátlásának bizonyítékát is kimutatták (Adams és mtsai., 1980; Charneyet al., 1975). Ezeket a transzportra gyakorolt hatásokat nem kizárólag a kalciumreceptorok vagy más, a transzportban szerepet játszó fehérjék vagy enzimek változásai okozhatják (genomiális hatás), hanem a membrán permeabilitására, poszttranszkripciós eseményekre, bazolaterális membrántranszportra, a paracelluláris transzport változásaira is vezethetnek., vagy egyéb káros hatások. A lehetséges mechanizmusok közé tartozik a mitokondriális adenozin-trifoszfát kimerülése (Krawitt, 1972) vagy a paracelluláris hátsó fluxus, amelyet a nátrium-kálium-ATPáz szivattyú glükokortikoidokkal történő stimulálása okoz (Adams et al., 1980; Charney et al., 1975).
D-vitamin-hiány, ricsa és osteomalacia
David Feldman, Peter J. Malloy, a Hormonok enciklopédiájában, 2003
III.D A tumor által kiváltott osteomalacia
Néhány apró mesenchymalis daganat (hemangiopericytoma, fibroma, angiosarcoma stb.) Foszfaturiát és hipofoszfatémiát okozhat, ami osteomalaciához vezet. A szindróma tumorindukált osteomalacia (TIO) vagy onkogén osteomalacia néven ismert. A mechanizmus magában foglalja a foszfaturációs faktor túlzott mennyiségének szintézisét és szekrécióját. Jelenleg a fő jelölt erre a szerepre az FGF 23. Még mindig nem teljesen tisztázott, hogy az FGF 23 hogyan okoz foszfaturiát. Az X-hez kapcsolódó hipofoszfatémia és az autoszomális domináns hipofoszfatémiás rachita vizsgálatának legújabb megállapításai azonban rávilágítottak a TIO-ra és mindhárom foszfatirikus entitás mechanizmusára. A TIO-t okozó daganatokat eredetileg jóindulatúnak és mesenchymális eredetűnek gondolták, de a rosszindulatú daganatokról is beszámoltak a szindróma kialakulásában. Gyakran a daganatok kicsiek és nehéz megtalálni őket. A kalcitriol szintje nem megfelelő (alacsony a hipofoszfatémiának serkentenie kell a kalcitriol termelődését), ezért a daganattermékről úgy gondolják, hogy zavarja a vese 1α-hidroxilációját is. Az osteomalacia nagy foszfát-kiegészítőkkel reagál a kezelésre, amelyek visszaállítják a foszfátszintet a normális szintre. A szindróma a tumor sikeres eltávolításával gyógyítható.
- Nem fertőző betegség - áttekintés a ScienceDirect témákról
- Prosztata Adenoma - áttekintés a ScienceDirect témákról
- Hasnyálmirigy-lé - áttekintés a ScienceDirect témákról
- Csipkebogyó - áttekintés a ScienceDirect témákról
- Paralytic Ileus - áttekintés a ScienceDirect témákról