PINK1/Parkin-függő mitokondriális megfigyelés: A pleiotropiától a Parkinson-kórig
Francois Mouton-Liger
1 Institut National de la Santé et de la Recherche Médicale, U1127, Párizs, Franciaország
2 Centre National de la Recherche Scientifique, UMR 7225, Párizs, Franciaország
3 Sorbonne Universités, UPMC Université Paris 06, UMR S 1127, Párizs, Franciaország
4 Institut du Cerveau et de la Moelle épinière, ICM, Párizs, Franciaország
Maxime Jacoupy
1 Institut National de la Santé et de la Recherche Médicale, U1127, Párizs, Franciaország
2 Centre National de la Recherche Scientifique, UMR 7225, Párizs, Franciaország
3 Sorbonne Universités, UPMC Université Paris 06, UMR S 1127, Párizs, Franciaország
4 Institut du Cerveau et de la Moelle épinière, ICM, Párizs, Franciaország
Jean-Christophe Corvol
1 Institut National de la Santé et de la Recherche Médicale, U1127, Párizs, Franciaország
2 Centre National de la Recherche Scientifique, UMR 7225, Párizs, Franciaország
3 Sorbonne Universités, UPMC Université Paris 06, UMR S 1127, Párizs, Franciaország
4 Institut du Cerveau et de la Moelle épinière, ICM, Párizs, Franciaország
5 Neurológiai Tanszék, Institut National de la Santé et de la Recherche Médicale, Assistance-Publique Hôpitaux de Paris, CIC-1422, Hôpital Pitié-Salpêtrière, Párizs, Franciaország
Corga Olga
1 Institut National de la Santé et de la Recherche Médicale, U1127, Párizs, Franciaország
2 Centre National de la Recherche Scientifique, UMR 7225, Párizs, Franciaország
3 Sorbonne Universités, UPMC Université Paris 06, UMR S 1127, Párizs, Franciaország
4 Institut du Cerveau et de la Moelle épinière, ICM, Párizs, Franciaország
Absztrakt
Bevezetés
A Parkinson-kór (PD) az egyik leggyakoribb neurodegeneratív rendellenesség, világszerte több mint hatmillió ember szenved. Kardinális motoros tüneteit (bradykinesia, izommerevség és nyugalmi remegés) az SN pars compacta dopaminerg (DA) neuronjainak preferenciális, progresszív degenerációja okozza, és akkor nyilvánulnak meg, amikor ezen idegsejtek több mint 50% -a elvész (Fearnley Lees, 1991; Lang és Lozano, 1998; Damier és mtsai, 1999). Az idegsejtfolyamatokban a szinaptikus fehérje α-szinukleinnel dúsított jellegzetes zárványtestek, a sejttestek, a Lewy-neuritok és a Lewy-testek a betegség második ismertetőjegyei. Bár gyakran elhanyagolják, a károsodás az SN-n kívül más agyi régiókra is kiterjed, beleértve a dorzális IX/X motoros magot, a raphe rendszert, a locus coeruleust, a thalamusot és az amygdalát, valamint a legsúlyosabb esetekben a neocorticalis területeket (Lang és Lozano, 1998; Braak és Braak, 2000; Braak és mtsai, 2004).
Hogy miért halnak meg ezek a neuronok a PD-ben, továbbra is rejtély. A sérülékeny idegsejtek egyik figyelemre méltó tulajdonsága a hosszú, kanyargós és gyakran elágazó nemmelinizált axon (Braak és Del Tredici, 2004). Becslések szerint az SN pars compacta humán DA idegsejtjeinek átlagos hossza 4,5 m volt, kivételesen bonyolult kerttel, amely 1 és 2,4 millió szinapszist képez a striatumban (Bolam és Pissadaki, 2012). A biológiai alapú számítási modellezésből származó bizonyítékok azt sugallják, hogy egy ilyen nagy axonális architektúra az idegsejteket szélsőségesen bioenergetikai igény alá helyezi az akciós potenciál terjedése, a membránpotenciál helyreállítása és a szinaptikus transzmisszió miatt (Pissadaki és Bolam, 2013). Ezek az egyedülálló tulajdonságok teszik ezeket az idegsejteket nagyon érzékenyek az energiaellátás zavaraira. Ezért nem meglepő, hogy a mitokondriális dyshomeostasis az egyik vezető mechanizmus, amelyről feltételezhető, hogy szerepet játszik a PD patogenezisében.
A toxinoktól és a mitokondriális komplex I. diszfunkciójától kezdve a génekig és a mitofágiaig
Mitophagy diszfunkció Parkinson-kórban: hol állunk?
A mitofágia túl: A PINK1 és a Parkin a mitokondriális minőség szempontjából releváns egyéb mechanizmusokat szabályozza
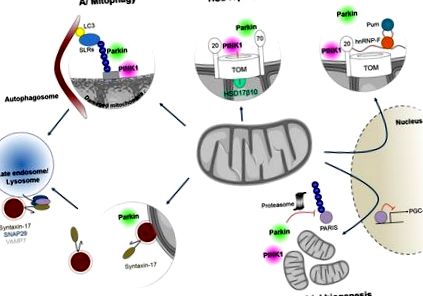
A mitokondriális minőségellenőrzés olyan koordinált mechanizmusok sorozatára utal, amelyek az egészséges mitokondriumok populációjának megőrzésére alakultak ki a sejtben, amelyek közül a mitofágia szélsőséges szempontot képvisel (Rugarli és Langer, 2012; Shutt és McBride, 2013). Ezek a mechanizmusok létfontosságúak az idegsejtek számára, mivel megváltoztatásuk neurodegeneratív betegségeket okoz. Egyre egyértelműbb, hogy a PINK1 és a Parkin szélesebb körben szabályozza őket.
A mitokondriális hálózat dinamikája szorosan összefügg a mitokondriális tevékenységek fenntartásával. Fúziós és hasadási események ciklusaihoz kapcsolódik, amelyeket a belső (OPA1) és a külső mitokondriális membránok (Mfn1 és Mfn2) fúziós tényezői, valamint a hasadás GTPase Drp1 szabályoz. A mitokondriális membránfúzió lehetővé teszi a mitokondriális tartalom újraelosztását, és ezáltal védelmet nyújt a sérült komponensek, például a mutáns mitokondriális nukleoidok felhalmozódása ellen. Ez túlélést támogató kompenzációs választ jelent stressz körülmények között, biztosítva az optimális ATP termelést és megakadályozva a mitokondrium autofág eltávolítását (Tondera és mtsai., 2009; Gomes és mtsai., 2011; Shutt és McBride, 2013). A súlyos mitokondriális diszfunkció gátolja a mitokondriális fúziót, ami mitokondriális szétaprózódást eredményez az ellenálló hasadás és az azt követő mitofágia következtében. Jelentős bizonyíték van arra, hogy a PINK1 és Parkin különféle közvetlen és közvetett mechanizmusokkal, többek között az Mfn1/2 és a Drp1 szabályozásával szabályozzák a mitokondriális dinamikát (Lutz et al., 2009; Gegg et al., 2010; Tanaka et al., 2010; Ziviani és mtsai, 2010; Guo, 2012; Corti és Brice, 2013; Buhlman és mtsai, 2014; Sun és mtsai, 2015; Pryde és mtsai, 2016).
Végül, a korai vizsgálatok a PINK1-et a mitokondriális chaperon, a tumor nekrózis faktor (TNF) receptorhoz társított TRAP1 fehérje (Pridgeon és mtsai., 2007) és a mitokondriális intermembrán térbeli szerin proteáz, HtrA2 (Plun-Favreau és mtsai. 2007). A Drosophilában végzett kiegészítő vizsgálatok megerősítették ezen fehérjék és a PINK1 közötti genetikai kölcsönhatást, bár nem mindig következetes eredményekkel (Tain és mtsai, 2009; Costa és mtsai, 2013; Zhang és mtsai, 2013). Megjegyzendő, hogy míg az ubiquitin és a Parkin ubiquitin-szerű doménje a PINK1 vitathatatlan foszforilációs szubsztrátjává vált, a strukturális vizsgálatok által alátámasztott legfrissebb felfedezések alapján (Caulfield et al., 2015; Dove et al., 2015), a további feltételezett PINK1 szubsztrátok tisztázása még hátravan.
Egyszerűtől a bonyolultig: a mitokondriális stresszre adott sejtválasz integrált elemzése és annak PINK1 és Parkin általi szabályozása felé
Végül egy másik fontos tanulságot tanultunk az UPR mt C. elegans-ban végzett tanulmányaiból: a mitokondriális stressz szorosan összefügg a veleszületett immunitáskomponenseket kódoló gének, például az antimikrobiális peptidek és a C-típusú lektinek (Melo és Ruvkun, 2012; Nargund és mtsai., 2012; Pellegrino és mtsai, 2014). Ezzel szemben a mitokondriális funkciót zavaró kórokozók védő UPR mt választ váltanak ki. A PINK1 és Parkin közötti erősen kialakuló kapcsolatokkal és a C. elegans és emlősök kórokozó reakcióútjának szabályozásával együtt (Mira et al., 2004; Manzanillo et al., 2013; Chopra et al., 2014; Kirienko et al., 2015 ), ezek a megfigyelések indokolttá teszik a PINK1/Parkin-függő mitokondriális minőségellenőrzés szerepének részletes elemzését az immunrendszer sejtjeiben, különösen a központi idegrendszerben, ahol diszfunkciójuk hozzájárulhat a neurodegenerációhoz.
Szabályozó központ a mitokondrium és az ideggyulladás metszéspontjában
Történelmileg a PARK2/Parkin elsősorban a mycobacteriumok, például M. leprae és M. tuberculosis fertőzésre való fokozott érzékenységével társult (Mira et al., 2004; Manzanillo et al., 2013; Chopra et al., 2014). A Parkin modulálja a gazda reakcióját ezekre a kórokozókra azáltal, hogy elősegíti azok ürülését az ubiquitin által közvetített autofágia révén (Manzanillo et al., 2013). A parkin és a PINK1 expresszióját vírusok is stimulálják, mint például a hepatitis B vírus (HBV) és a hepatitis C vírus (HCV) (Kim és mtsai, 2013a, b). A HBV és a HCV elősegíti a Parkin és a Parkin-függő mitofágia mitokondriális transzlokációját (Kim és mtsai, 2013a, b; Hara és mtsai, 2014; Khan és mtsai, 2016). HBV-fertőzésben a Parkin kölcsönhatásba lép a mitokondriális adapter fehérjével, a MAVS-szel, elősegítve annak módosulását anarchálatlan lineáris poliubikvitin-láncokkal és kiváltva az β-interferon termelésével járó antivirális jelátviteli kaszkádot (Khan és mtsai, 2016). Összességében ezek a tanulmányok azt sugallják, hogy a PINK1 és a Parkin modulálja a fertőzésekre való hajlamot, ami további munkát indokol, annak értékelésére, hogy ez a mechanizmus mennyiben járul hozzá a PD kockázatához. Egy másik PD gént az interferonválaszhoz, az LRRK2 (leucinban gazdag ismétlődő kináz-2) összekapcsoló bizonyítékok megerősítik ezt az elképzelést (Gardet et al., 2010).
Érdekes, hogy a gyulladásos aktiváláshoz NLRP3 toborzásra van szükség az endoplazmatikus retikulum (ER) -mitokondria interfészére (Zhou és mtsai, 2011), esetleg a MAVS adapterfehérjével (Subramanian et al., 2013), és az ER-ből származó kalcium központi szerepet játszik NLRP3 aktiváció (Lee és mtsai, 2012; Rossol és mtsai, 2012). Nemrégiben kimutattuk, hogy a kiütéses egerek és a PARK2 PD betegek Parkin-hiánya vagy diszfunkciója súlyosbítja az ER-mitokondrium interfészt, ami túlzott kalciumtranszferhez vezet ezen organellák között (Erpapazoglou és Corti, 2015; Gautier et al., 2016). Ez egy olyan mechanizmust biztosít, amellyel a Parkin modulálhatja az NLRP3 aktivitását.
Összességében ezek a tanulmányok határozottan támogatják a PINK1/Parkin út szerepét a veleszületett immunitás és gyulladás szabályozásában. Az egyik kulcsfontosságú kérdés, amelyet a jövőben kell megválaszolni, az az, hogy a PINK1/Parkin útvonal deregulációja az immunsejtekben káros hatással van-e a DA idegsejtjeire. Együttes kultúrarendszerek létrehozása, a PARK2 vagy PINK1 kiütött egérmodellekből előre aktivált mikroglia és primer embrionális DA idegsejtek integrálása előzetes lépést jelenthet ezen interakciók globálisabb elemzése felé a PD-ben.
A jó mitofágia, a rossz cukorbetegség és kapcsolatuk a PD-vel
Nevezetesen egy nemrégiben készült tanulmány szerint a metabolikus szindróma, amelyet az egerek okoztak a T5DIN érzékenységi gén, a TP53INP1 (tumorprotein 53-indukálta nukleáris fehérje 1) deléciójával, amely szerepet játszik a tumor szuppressziójában és az autofágia szabályozásában, a PINK1/PARKIN által közvetített mitofágia, oxidatív stresszel és krónikus gyulladással társítva (Seillier és mtsai, 2015). Ez a munka megerősíti a kapcsolatot a PINK1/Parkin-függő mitokondriális kontroll diszfunkciója, a cukorbetegség és a PD között.
Következtetés
A mitokondriális minőség-ellenőrzés hibái a Parkinson-kórhoz kapcsolódó számos utat érintenek. A PINK1/Parkin-függő mitokondriális minőség-ellenőrzés, beleértve a mitofágia, az MDV útvonalát és a mitokondriális biogenezist, elengedhetetlen a sejtek életképességéhez. Ennek a folyamatnak a változása több sejttípusban összekapcsolódhat az 1/mikroglia aktivációval, amely az NLRP3 gyulladásos és IL-1β 2 komponenseit kódoló gének transzkripciós indukciójához vezethet/neuronokban, károsodott mitokondriumok és 3/2-es típusú cukorbetegség (T2DM) és alacsony sűrűségű lipoprotein (LDL) koleszterin felhalmozódása. A veleszületett immunrendszer aktiválása, az anyagcsere dyshomeostasis és az energetikai hibák hozzájárulnak a neuronok halálához, amely szorosan kapcsolódik a Parkinson-kórhoz.
Szerzői hozzájárulások
Az FML és az OC írta a kéziratot. MJ és JCC kritikus előadást tartottak. MJ rájött a grafikus ábrázolásokra. Valamennyi szerző véglegesen jóváhagyta a beküldött verziót.
Finanszírozás
Ezt a munkát az Institut national de la santé et de la recherche médicale (INSERM), a Fondation Institut du Cerveau et de la Moelle épinière és az Agence Nationale pour la Recherche („Investissements d'avenir”, ANR-10-IAIHU támogatás) támogatásával támogatták. -06), az Innovatív Gyógyszer Kezdeményezés Közös Vállalkozás az 115568 sz. Támogatási megállapodás alapján, amelynek forrásai az Európai Unió hetedik keretprogramjának (FP7/2007-2013) pénzügyi hozzájárulásából és az EFPIA társaságok hozzájárulásából állnak. Fondation de France (Grant ID Engt 2016 00066513) és a Michael J. Fox Alapítvány (Target Validation Awards 2016. tavaszi program, Grant ID 12095).
Összeférhetetlenségi nyilatkozat
A szerzők kijelentik, hogy a kutatást bármilyen kereskedelmi vagy pénzügyi kapcsolat hiányában végezték, amely potenciális összeférhetetlenségként értelmezhető.
- Parkinson; s Betegség és diéta - Parkinson; s Hírek ma
- A levodopa-karbidopa intesztinális gél kezelés biztonságossága előrehaladott Parkinson-kórban szenvedő betegeknél
- Önmozgás-érzékelés Parkinson-kórban - Halperin - European Journal of Neuroscience - Wiley
- Parkinson; s betegség - Kezelés - NHS
- Küzdelem a fogyásért A körte fogyasztása elősegíti a zsírégetést, a szívbetegségek és a rák elleni küzdelmet