Potenciális élelmiszer-gyógyszer kölcsönhatások rheumatoid arthritisben szenvedő betegeknél
Táplálkozástudományi Doktori Iskola, Sagami Női Egyetem, Kanagawa, Japán
Levelezés: Dr. Kayo Masuko, a táplálkozástudományi diploma, Sagami Női Egyetem, 2-1-1 Bunkyo, Minami-ku, Sagamihara ‐ shi, Kanagawa 252-0383, Japán.
Reumatológiai Osztály, Nemzeti Kórházszervezet Sagamihara Nemzeti Kórház, Kanagawa, Japán
Reumatológiai Osztály, Nemzeti Kórházszervezet Sagamihara Nemzeti Kórház, Kanagawa, Japán
Táplálkozástudományi Doktori Iskola, Sagami Női Egyetem, Kanagawa, Japán
Levelezés: Dr. Kayo Masuko, a táplálkozástudományi diploma, Sagami Női Egyetem, 2-1-1 Bunkyo, Minami-ku, Sagamihara ‐ shi, Kanagawa 252-0383, Japán.
Reumatológiai Osztály, Nemzeti Kórházszervezet Sagamihara Nemzeti Kórház, Kanagawa, Japán
Reumatológiai Osztály, Nemzeti Kórházszervezet Sagamihara Nemzeti Kórház, Kanagawa, Japán
Absztrakt
A rheumatoid arthritis (RA) kezelésére különféle gyógyszereket alkalmaznak. Élelmiszerek és gyógyszerek közötti kölcsönhatások előfordulhatnak egy adott étel egyidejű bevitelével. Például a metotrexát (MTX), az RA elleni terápiás stratégia horgonyszere antifolát ágens. Az étrendi folsav túlzott jelenléte vagy hiánya szabályozhatja az MTX anyagcseréjét, ami váratlan mellékhatásokhoz vezethet. Ebben az áttekintésben az MTX, az izoniazid és a kalcineurin inhibitorokra összpontosítunk, valamint a lehetséges élelmiszer-gyógyszer reakciók következményeire a reumatológiában, ami arra utal, hogy a táplálkozási értékelések fontos szerepet játszanak RA betegekben.
Bevezetés
Széles körben ismert, hogy bizonyos élelmiszerek befolyásolhatják a gyógyszerek metabolizmusát és/vagy farmakológiai hatásait, beleértve a rheumatoid arthritis (RA) kezelésében alkalmazott gyógyszereket is. Az ilyen élelmiszerek és gyógyszerek közötti kölcsönhatásokra vonatkozó információk azonban korlátozottak, és nem ismert, hogy a betegek tudnak-e ezekről.
Reumatológiai klinikánkon egy kérdőív segítségével felmértük, hogy az RA-ban szenvedő betegeket milyen gyakran tájékoztatták az élelmiszerek és a gyógyszerek közötti lehetséges kölcsönhatásokról. Megállapítottuk, hogy ilyen ismeretek nagyon korlátozottak a RA-betegek körében (publikálatlan). Itt összefoglaljuk a lehetséges élelmiszer-gyógyszer kölcsönhatásokat, összpontosítva azok reumatológiai következményeire, mint referencia az orvosi személyzet számára.
Metotrexát (MTX) és folsav (FA)
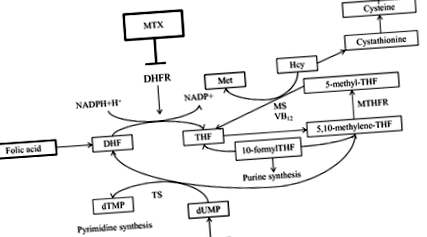
A B-vitamin komplex folsav (FA) és az MTX antifolát szer kölcsönhatása a legtöbb reumatológus számára jól ismert. Az MTX blokkolja a dihidrofolát-reduktáz (DHFR) enzimet, amely a dihidrofolátot (DHF) tetrahidrofoláttá (THF) alakítja, amely az FA redukált, aktív formája (1. ábra). Így az MTX az aktív folát sejtszintű kimerülését indukálja. Ezenkívül downstream termékként az 5-metil-THF metildonorként szolgál, amelynek révén a homocisztein metioninná alakul. Az MTX közvetetten növeli a homocisztein plazma- és vizeletszintjét, amint azt az MTX-kezelés bizonyítja, beleértve RA-betegeket is. 1
Bár az MTX antifolát aktivitása vagy folát antagonizmusa az alapja a hatékonyságának, mellékhatásokat is okoz, például gyomor-bélrendszeri intoleranciát vagy hematológiai rendellenességeket. 2 Ezért az FA hiánya az MTX toxicitás egyik fő kockázati tényezője. Az FA metabolizmus MTX toxicitásban való részvételét az 5,10-metilén-tetrahidrofolát-reduktáz (MTHFR; az FA-anyagcsere kulcsfontosságú enzimje, amely az 5,10-metilén-THF-t 5-metil- THF [1. ábra]) és az MTX-hez kapcsolódó mellékhatások. 3, 4
A toxicitás megelőzése érdekében a Japán Reumatológiai Főiskola által 2011-ben megállapított irányelvek (http://www.ryumachi-jp.com/index.html) határozottan ajánlják az FA (≤ 5 mg/hét) MTX együttes alkalmazását MTX-sel RA-val kezelt betegeknél. ≥ 8 mg/hét MTX és/vagy azok, akiknél a FA-hiány miatt nagy a kockázata a káros hatásoknak. Az FA-kiegészítés hatása az MTX-toxicitások megelőzésére széles körben megállapított, és úgy tűnik, hogy az FA-kiegészítők nem csökkentik jelentősen az MTX hatékonyságát. A 2, 5, 6 FA felszámolja a homocisztein fokozott termelését. 2, 7 Súlyos káros hatások vagy MTX túladagolás esetén antidotumként FA helyett 5-formil-tetrahidrofolsav (folinsav) használható. A folsav (más néven leukovorin) a THF 5-formil-származéka, amely könnyen átalakítható más FA-származékokká DHFR nélkül, 8 az MTX célenzimje. Az FA pótlása megfontolható azoknál a RA-betegeknél is, akik MTX és szulfaszalazin (SSZ) 9-11 kombinált terápiájában részesülnek, mivel az SSZ-ről beszámoltak arról, hogy befolyásolja az FA-koncentrációt, elsősorban az FA bélfelszívódásának zavarása révén. 9, 10
Az étrendi FA módosíthatja az FA szérumkoncentrációját, valamint az MTX hatékonyságát. 12 Konkrétan, a magas foláttartalmú étrend növelheti az FA szérumkoncentrációját és megszüntetheti az MTX aktivitását, annak ellenére, hogy az FA biohasznosulása az alkalmazott különféle ételektől és főzési stílusoktól függően nagyban változik. 13 Ilyen interferencia nem fordulhat elő gyakran, ha az FA napi étrendi bevitele a normális tartományba esik; beszámoltak arról, hogy az étrendi FA-bevitel nem feltétlenül korrelál az FA szérumkoncentrációival, különösen a nőknél. 14 Figyelmet kell azonban fordítani, ha a beteg nagy adagban szed FA-dúsító kiegészítőket, vagy speciális étrendet folytat, rendkívül alacsony FA-szint mellett. Ilyen esetekben megfelelő táplálkozási konzultációt kell kérni. 12, 15, 16 A dohányzásról azt is beszámolták, hogy csökkenti az FA szérumkoncentrációját, függetlenül a folát étrendi bevitelétől. 14, 17
A Japánban rendszeresen fogyasztott, magas FA-tartalmú élelmiszerek reprezentatív példái az 1. táblázatban találhatók. Néhány országban az élelmiszerek kötelező folátdúsítását politikaként (az idegcsőhibák megelőzésére) 18 hajtották végre, Japánban azonban nem. Japánban azonban különös figyelmet kell fordítani a aojiru (zöld levélnyomó), vagyis zöld leveles zöldségekből, például kelkáposzta és fiatal árpa levelekből készült zöldséglé. Asahina et al. 19 arról számolt be aojiru az idős embereknél (≥ 65 év) magasabb volt a felhasználás, és ami még fontosabb, a hosszú távú orvosi kezelés alatt álló emberek körében. FA-tartalom természetes eredetű aojiru változó, de kereskedelmi jellegű aojiru ≥ 200 μg/adagot tartalmazhat (1. táblázat). Valószínű, hogy a betegek más FA-tartalmú ételek mellett gyakran többet isznak egy pohárnál naponta. Ezért azt javasoljuk, hogy a kezelő orvosok kérdezzék meg, hogy a betegek szednek-e aojiru az MTX beadásakor és ellenőrizze az összetevőket aojiru (beleértve az FA-t is). A zöld tea, a fekete tea vagy az oolong tea fogyasztása befolyásolhatja az FA szérumszintjét. 20, 21 Az ilyen teák ehető részeinek 100 g-jára jutó FA-tartalom azonban nem magas gyokuro (Asztal 1).
| Edamame | Edamame | Főtt | 260 |
| Kelbimbó | Mekyabetsu | Főtt | 220 |
| Petrezselyem | Paseri | Nyers | 220 |
| Spárga | Főtt | 180 | |
| Brokkoli | Főtt | 120 | |
| Vöröshegyű levélsaláta | Sani ‐ retasu | Nyers | 120 |
| Gombó | Okura | Főtt | 110 |
| Spenót | Ho ‐ renso | Főtt | 110 |
| Korona százszorszép | Shun ‐ giku | Főtt | 100 |
| Eper | Ichigo | Nyers | 90 |
| Avokádó | Nyers | 84. | |
| Tossa juta | Moroheiya | Főtt | 67 |
| Tyúktojás, sárgája | Ran-oh | Nyers | 140 |
| Földimogyoró | Olajban sült és sózott | 98 | |
| Dió | Kurumi | Sült | 91. |
| Csirkemáj | Nyers | 1300 | |
| Szarvasmarha, máj | Nyers | 1000 | |
| Sertés, máj | Nyers | 810 | |
| Tengeri sün, nyers nemi mirigyek | Nama ‐ uni | Nyers | 360 |
| Baba szardínia | Tatami ‐ iwashi | 300 | |
| Japán szardella | Katakuchi ‐ iwashi (Tazukuri) | 230 | |
| Lazac ikra | Ikura | 100 | |
| Sült íz | Yaki-nori | 1900 | |
| Fűszerezett zamat | Ajitsuke-nori | 1600 | |
| Zöld tea (Sencha) | Infúzió | 16. | |
| Zöld tea (Gyokuro) | Infúzió | 150 | |
| Fekete tea | Infúzió | 3 | |
| „Aojiru’Zöld levélprés (táplálkozási tények szerint) | 1. minta | 45–200 |
| 2. minta | 147 | |
| 3. minta | 57 | |
| 4. minta | 15 | |
| 5. minta | 8. | |
| Chrorella | 1. minta | 1200 |
- Az élelmiszerek példái, amelyekben a folsav jelentős mennyiségben van jelen, a Japán élelmiszer-összetétel standard táblázatai (2010) szerint találhatók (http://fooddb.jp/). Tájékoztatásul, a japán Egészségügyi, Munkaügyi és Jóléti Minisztérium 2010-es étrendi referencia bevitelében az ajánlott folsavbevitel egészséges, 18–49 éves japán felnőttek számára 240 μg/nap (a legfrissebb változat megtalálható a weboldalon Országos Egészségügyi és Táplálkozástudományi Intézet (http://www0.nih.go.jp/eiken/).
- a Mikrogramm FA/100 g ehető adag.
- b Mikrogramm FA/1 csomag.
Nemrégiben Kinoshita et al. 22 beszámolt az étrendi FA immunológiai szerepéről: az FA hiányos étrendet tápláló egerek a vastagbélben csökkentették a Foxp3 + szabályozó T-sejtjeit. A bél immunrendszere kulcsszerepet játszik a szisztémás veleszületett immunitásban; ezért az étrendi vitaminoknak (beleértve az FA-t) az ember normális vagy kóros immunfunkcióiban erős modulációs funkciói lehetnek. Ezenkívül az FA olyan táplálkozási tényező, amely metilegységeket szolgáltat a DNS metilezéséhez; így az étrendi FA részt vehet az RA epigenetikus betegségmechanizmusaiban, mint a rák esetében. 23, 24
Izoniazid (INH) és halak
Amint az MTX és biológiai szerek, például tumorellenes nekrózis faktor (TNF) -α antitestek használata egyre bővül, az ilyen immunszuppresszív gyógyszerek által okozott súlyos nemkívánatos események megelőzése nagyon fontossá válik. Az egyik legfontosabb mellékhatás, amely gyakran előfordul ilyen használat során, a súlyos opportunista fertőzés. Ebben a tekintetben Japánban az immunszuppresszált betegeknél gyakori a pulmonalis tuberkulózis (TB). Tehát a TB elleni megelőző kezelés biztosítása a biológiai szerek vagy az MTX felírása előtt elengedhetetlen. Ennek érdekében az INH orális beadása a szokásos protokoll a legtöbb reumatológiai klinikán és kórházban Japánban.
Az orvosok körében jól elfogadják, hogy az INH az enzimek, például a CYP2C9 és a CYP3A4, 25 citokróm CYP450 szupercsaládjának inaktiválásával gyógyszerkölcsönhatásokat okozhat. Mindazonáltal az INH és bizonyos élelmiszerek közötti kölcsönhatást is ki kell emelni 26, 27 (2. ábra).
Az INH a monoamin-oxidáz (MAO) és a diamin-oxidáz (DAO) inhibitora. A MAO és a DAO hozzájárul a hisztamin és a tiramin metabolizmusához, 28 amelyek bizonyos típusú halakban és sajtokban megtalálhatók. Például a tonhal és a makréla hisztidint tartalmaz, és vannak hisztamint termelő baktériumok (HPB), mint pl. Photobacterium phosphoreum és Raoultella planticola, a hal mikroflórájában, amely hisztidin-dekarboxiláz (HDC) aktivitást fejt ki (ami a hisztidint hisztaminná alakítja). 29 A tenger gyümölcseiben jelen lévő egyéb fontos biogén aminok közé tartozik a tiramin, a triptamin, a putreszin és a kadaverin, amelyek hasonló mechanizmus révén képződnek tirozinból, triptofánból, ornitinból és lizinből. A tiramin a sajtban (különösen az érlelt sajtban) és a vörösborban is jelen van, különböző koncentrációban. 31-33
Ezeket a biogén aminokat egészséges egyénekben gyorsan méregtelenítheti az amin-oxidázok, míg az alacsony MAO/DAO aktivitásúak ételmérgezés vagy intolerancia veszélyének vannak kitéve, ha akár alacsony hisztamint vagy tiramint tartalmazó ételeket is fogyasztanak. 34, 35 Az ilyen mérgezés, amelyet gyakran a scombroid családba tartozó szennyezett halak (pl. Tonhal, makréla, hering, marlin, bonito és bakok) fogyasztása kísér, scombrotoxikus halmérgezésnek nevezik, és nem ritka, mivel járványkitöréseket regisztráltak. Az étrendi tiramin MAO-gátlókkal történő biológiai hatásainak (például hipertóniás reakciójának) potenciálosítása sajtreakciókként vagy sajthatásként ismert, ami korlátozhatja az ilyen gyógyszerek alkalmazását. 37-39 Ebben az összefüggésben az INH-ban részesülő betegeket különösen veszélyeztetheti az ilyen ételmérgezés. Például Morinaga et al. 40 1997-ben arról számolt be, hogy egy INH-t kapó 83 éves nőnél a hisztamin mérgezés tünetei jelentkeztek, beleértve a fejfájást, a szívdobogást és a viszketéssel járó bőrkitöréseket nyers tonhal fogyasztása közben. A hisztamin toxikáció kitöréséről csak egy tuberkulózisos osztályról számoltak be INH-t kapó betegeknél őrölt saury fogyasztása után (sanma japánul) paszta. 41
Javasolták a monoamin-oxidáz-gátló (MAOI) étrend kategóriáját, amelyben ajánlott az elöregedett sajt és szójatermékek kerülése. 31, 42 A MAOI-k mellékhatásprofiljának javulása szerint azonban ilyen óvatosságra nincs szükség. Mindazonáltal, figyelembe véve a fent említett mérgezés kitöréseit, az RA-betegeknek, akik INH-kezelést (vagy más immunszuppresszív terápiát) végeznek (vagy fontolgatnak), tisztában kell lenniük az INH által okozott élelmiszer-gyógyszer kölcsönhatásokkal. Beszámoltak arról, hogy például a nagyláncú kereskedelmi üzletekből származó pizzák biztonságosak a MAOI-val történő fogyasztásra, de a betegeknek ügyelniük kell arra, hogy olyan pizzákat rendeljenek, amelyek idősebb sajtokat tartalmazhatnak. 31
Kalcineurin inhibitorok és grapefruit
A kalcineurin gátlók, például a takrolimusz és a ciklosporin Japánban alkalmazhatók az RA terápiájában vagy társbetegségében, mivel hatékonyságuk és biztonságosságuk ígéretesnek bizonyult. A takrolimuszt elsősorban az emberi máj CYP3A4 metabolizálja, amely a jelenleg ismert gyógyszerek 50–60% -ának metabolizmusáért felelős. 45, 46 A grapefruit a bél CYP3A4 rendszerének inhibitora; ezért a takrolimusz kölcsönhatásba léphet a grapefruitlével, ha egyidejűleg szedik. Vagyis a CYP450 rendszer grapefruit általi gátlása váratlanul megemelheti a bevitt gyógyszer szérumkoncentrációját, beleértve a takrolimust is.
A P-glikoprotein (Pgp) egy 170 kDa-os foszforilezett glikoprotein, amelyet az emberi MDR1 gén. A Pgp köztudottan a gyógyszer farmakokinetikáját adenozin-trifoszfát (ATP) vezérelt efflux pumpaként szabályozza, és a szubsztrátok széles skálájával is rendelkezik. Jelentős a szubsztrátok átfedése a CYP3A4 és a Pgp között, 45 és a takrolimuszt, a ciklosporint pedig a CYP3A4 és a Pgp szabályozza. 47
Felvetődött, hogy a Pgp aktivitását és expresszióját befolyásolhatják az élelmiszercsoportok (pl. Növényi összetevők, például kurkumin, ginsenozidok, piperin, zöld tea katechinek), a grapefruitlé néhány természetes összetevője (pl. Bergamottin, kvercetin) és a gyömbér. 48, 49 Ezért a Pgp és ezen élelmiszerek közötti kölcsönhatás megváltoztathatja a Pgp szubsztrátjaiként szolgáló gyógyszerek felszívódását és biohasznosulását. 48 E tekintetben beszámoltak a takrolimusz minimális vérkoncentrációjának emelkedéséről a grapefruit (vagy pomelo) gyümölcslével máj- vagy veseátültetetteknél. 50-52 Noha a gyógyszerkoncentrációra gyakorolt moduláló hatás a CYP vagy MDR1 genotípusaiban eltérhet, 47, 53 RA-s betegek (különösen máj- vagy veseműködési zavarban szenvedők) ajánlhatók a takrolimusz/ciklosporin és a grapefruit vagy más citrusfélék egyidejű fogyasztásának elkerülése érdekében.
A reumatológiai klinikákon gyakran alkalmazott egyéb gyógyszerek mellett az 1,4-dihidropiridin-kalcium-csatorna blokkolók (CCB-k) és a hidroxi-metil-glutaril-koenzim A (HMG-CoA) reduktáz inhibitorok (sztatinok) potenciális kölcsönhatást mutathatnak a grapefruittal (áttekintve: Kane és Lipsky 54). . A sztatinok farmakokinetikájának grapefruit általi módosítása ezen szerek különböző osztályaiban eltérő lehet. 55, 56
Záró megjegyzések
Az élelmiszer-gyógyszer interakciókat kiemelni kell az egészségügyi szakemberek és a betegek számára nemcsak a TB osztályokon vagy a pszichiátriai osztályokon, hanem a reumatológiai klinikákon is. Javasoljuk, hogy fontolja meg a táplálkozási konzultációt az RA-betegeknél az étel – gyógyszer kölcsönhatások elkerülése, valamint az anyagcsere- vagy táplálkozási kockázatok csökkentése érdekében, amelyek szerepet játszhatnak a gyulladás fennmaradásában. 57, 58
Köszönetnyilvánítás
A szerzők köszönetet mondanak Sachiko Nagahama professzornak, RD, Hiroko Sakai asszonynak, RD és Masako Kawamoto asszonynak, a Sagami Női Egyetem értékes tanácsaiért és támogatásáért.
- Metoprolol-szukcinát ER és alkohol-élelmiszer kölcsönhatások
- A Prozac és az alkohol interakciói az ételekkel
- A közegészségügyi összefoglaló inaktív gyerekek jövőbeli egészségügyi kockázatokat jelentenek; Élelmiszerpatikák; Segítsen a betegek kézműves munkájában
- A reumás ízületi gyulladás fokozott gyulladásos markereivel járó elhízás - A reumatológus
- Étel- és étrendjavaslataim kolosztómiás betegek számára - Patient s Lounge - Betegorvosi tapasztalatok