Családi gyógyszer
Család- és közösségi orvoslás, Texas Tech Egyetem Egészségügyi Tudományos Központ El Paso és Paul L. Foster Orvostudományi Kar, CAQ-Sportorvoslás, El Paso, Texas (Dr. Murphy) és Neurológiai Tanszék, Massachusettsi Általános Kórház és Harvard Orvosi Iskola, Boston (Dr. Levy).
[e-mail védett]
A szerzők nem számoltak be a cikk szempontjából releváns esetleges összeférhetetlenségről.
► 2 hónapon át súlyosbodó hányinger, hányás és szédülés, ami 20 kilós súlycsökkenést eredményez
► viszketés
► Ataxia
► Enyhe halláskárosodás, ismétlődő esési epizódokkal
Hivatkozások
1. Hinson SR, Pittock SJ, Lucchinetti CF és mtsai. Az IgG vízcsatorna extracelluláris doménjéhez való kötődésének patogén potenciálja neuromyelitis opticában. Neurológia. 2007; 69: 2221-2231.
2. Ratelade J, Zhang H, Saadoun S és mtsai. Neuromyelitis optica IgG és természetes gyilkos sejtek NMO elváltozásokat okoznak egerekben mielinveszteség nélkül. Acta Neuropathol. 2012; 123: 861-872.
3. Saadoun S, Waters P, Bell BA és mtsai. A neuromyelitis optica immunglobulin G és az emberi komplement agyon belüli injekciója neuromyelitis optica elváltozásokat eredményez egerekben. Agy. 2010; 133: 349-361.
4. Takahashi T, Fujihara K, Nakashima I és mtsai. Az anti-akvaporin-4 antitest részt vesz az NMO patogenezisében: az antitest-titer vizsgálata. Agy. 2007; 130: 1235-1243.
5. Jarius S, Aboul-Enein F, Waters P és mtsai. Az aquaporin-4 elleni antitest a neuromyelitis optica hosszú távú lefolyásában. Agy. 2008; 131: 3072-3080.
6. Hamid SHM, Whittam D, Mutch K és mtsai. Az AQP4-IgG-negatív NMO spektrum rendellenességben szenvedők hány százaléka Mog-IgG pozitív? Keresztmetszeti vizsgálat 132 betegnél. J Neurol. 2017; 264: 2088-2094.
7. Peschl P, Bradi M, Hoftberger R és mtsai. Myelin oligodendrocita glikoprotein: célpont megfejtése gyulladásos demyelinizáló betegségekben. Front Immunol. 2017; 8: 529.
8. Jurynczyk M, Messina S, Woodhall MR és mtsai. Klinikai bemutatás és prognózis MOG-antitest betegségben: Egyesült Királyságban végzett tanulmány. Agy. 2017; 140: 3128-3138.
9. Sellner J, Boggild M, Clanet M és mtsai. EFNS irányelvek a neuromyelitis optica diagnózisához és kezeléséhez. Eur J Neurol. 2010; 17: 1019-1032.
10. Kleiter I, Gahlen A, Borisow N és mtsai. Neuromyelitis optica: 871 roham és 1153 kezelési kúra értékelése. Ann Neurol. 2016; 79: 206-216.
11. Watanabe S, Nakashima I, Misu T és mtsai. A plazma-csere terápiás hatékonysága neuromyelitis opticában szenvedő NMO-IgG-pozitív betegeknél. Mult Scler. 2007; 13: 128-132.
12. Collongues N, Brassat D, Maillart E és mtsai. A rituximab hatékonysága refrakter neuromyelitis opticában. Mult Scler. 2016; 22: 955-959.
13. Collongues N, de Seze J. A rituximab hatékonyságának és biztonságosságának bizonyítékainak frissítése a neuromyelitis optica kezelésében. Ther Adv Neurol Disord. 2016; 9: 180-188.
14. Kim SH, Huh SY, Lee SJ és mtsai. A rituximab-kezelés ötéves nyomon követése neuromyelitis optica spektrumzavaros betegeknél. JAMA Neurol. 2013; 70: 1110-1117.
15. Kim SH, Kim W, Li XF és mtsai. Ismételt rituximab-kezelés a perifériás keringő memória B-sejtek értékelése alapján 2 év alatt relapszáló neuromyelitis optica-ban szenvedő betegeknél. Arch Neurol. 2011; 68: 1412-1420.
AZ ÜGY
Egy 26 éves spanyol/afroamerikai nő 2 hónapos anamnézisben hányingert és hányást, valamint szédülést mutatott be klinikánknak. A hányinger és a hányás tartósan súlyosbodott, és csak az almát és a bogyókat tűrte. Ebben a 2 hónapos időszakban 20 kilót fogyott, és tünetei a viszketés, az ataxia és az enyhe halláscsökkenés közé tartoztak, ismétlődő eséses epizódokkal.
A DIAGNOSZIS
Vizsgálatkor kiderült, hogy bradikardikus, 47 ütés/perc szívfrekvenciával, a jobb tengely eltérésével és az invertált T hullámokkal az I., II. És a megnövekedett vektorban. Családtörténete magában foglalta egy 30 év körüli néni halálát ismeretlen szívbetegség miatt.
Az echocardiogram enyhe mitrális szelep regurgitációt azonosított 55–60% -os ejekciós frakcióval (referencia tartomány: 55–70%). A kardiológia megállapította, hogy a bradycardia nem a tünetek forrása. Egy neurológiai vizsgálat 3+ hiperreflexiát (a reflex megnövekedését jelezve), tandem járási instabilitást és bal oldali oculomotoros diszfunkciót azonosított.
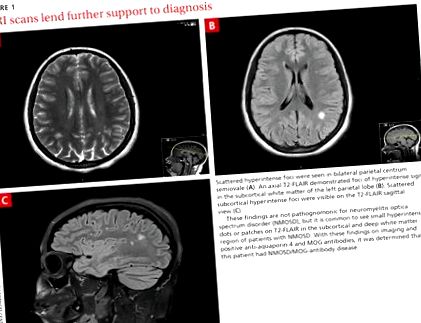
Az agyi mágneses rezonancia képalkotás (MRI) kétoldalú parietális fehérállományi elváltozásokat azonosított, ahol a demyelinizációs folyamat nem zárható ki (1A. ÁBRA). A beteg hányinger és hányás tünetei tovább folytatódtak, és csak a földimogyorót és a folyadékot tolerálta. A gerinc MRI-je negatív volt.
A laboratóriumi vizsgálatok azt mutatták, hogy a beteg negatív volt az emberi immunhiányos vírus (HIV), a szifilisz, a Lyme-kór és a lupus szempontjából. Pajzsmirigy-stimuláló hormon szintje 1,7 mIU/L (referencia tartomány: 0,4-4,2 mIU/L), B12-vitamin szintje pedig 504 pg/ml (referencia tartomány: 160-950 pg/ml).
A beteg ágyéki lyukasztása negatív volt az oligoklonális sávok esetében. Az IgG szintézis aránya/indexe cerebrospinalis folyadék (CSF) –3,9 volt, kizárva a sclerosis multiplexet. CSF-tenyészete negatív volt, glükózszintje 42 mg/dl (referencia tartomány: 70-110 mg/dl), színtelen megjelenés, 1 fehérvérsejt és gerincalbumin 12,2 mg/dl (referencia tartomány: 8-42 mg/dl). A vizuálisan kiváltott potenciál negatív volt. Az aquaporin-4 (AQP4) antitest pozitív értéke 3,4 U/ml volt, a mielin oligodendrocita glikoprotein (MOG) antitest pozitív volt.
A gasztroenterológia a gyomor normális befogadását és a nem figyelemre méltó számítógépes tomográfia (CT) enterográfiát vonta le. Mérsékelt eróziókat azonosítottak a gyomorban erythemás gastropathiával. A beteget protonpumpa inhibitorra helyeztük.
Folytassa: A vizsgálatot követően.
- Fogyás követtem az EBB képletét és mindössze 6 hónap alatt 40 kilót fogytam! - India idõpontjai
- Fogyás Az ember 7 hónap alatt 50 fontot dob le, miután megtalálta a könnyű fogyás titkát
- Mi lenne, ha csak hónapok választanának el a testtől, megérdemli a Beast Athletics Fogyás Tampa -t
- Fogyás 8 hónap alatt leadtam a súlyom felét, hogy anya legyek, de mégsem tudtam; nem teherbe esni
- Fogyás inspiráció Ez a lány 8 hónap alatt 30 kg-ot fogyott EZT az étrend-terv szerint - Times of India