A tabletta súlya
Kapcsolódó kifejezések:
- Szorbit
- Kroszpovidon
- Magnézium-sztearát
- Tabletta keménysége
- Mikrokristályos cellulóz
- Keményítő-glikolát-nátrium
- Por áramlás
Letöltés PDF formátumban
Erről az oldalról
ASAP alkalmazás: instabil gyógyszerjelölt a korai fejlesztésben
Anjali Agrawal,. Zeena Williams, gyorsított prediktív stabilitás, 2018
3.2.2 A szokásos segédanyagok tabletta prototípusának értékelése
9. táblázat A prototípus tabletta készítmények összetételei
| 50 | 50 | 50 | 50 | 50 | 50 |
| 47 | 44. | 22. | 0 | 22. | 0 |
| 0 | 0 | 22. | 0 | 0 | 0 |
| 0 | 0 | 0 | 44. | 22. | 0 |
| 0 | 0 | 0 | 0 | 0 | 44. |
| 3 | 3 | 3 | 3 | 3 | 3 |
| 0 | 3 | 3 | 3 | 3 | 3 |
10. táblázat ASAP eredmények a prototípus tabletta készítményekről
| 0.51 | 5.2 | 6.6 | 4.9 | 4.4 |
| 0,85 | 6.2 | 6.9 | 6.3 | 4.7 |
| 0,62 | 6.1 | 7.0 | 6.1 | 4.6 |
| 0,82 | 6.1 | 4.9 | 7.7 | 4.7 |
| 0,85 | 6.3 | 5.1 | 7.7 | 4.9 |
| 0,75 | 6.0 | 5.0 | 7.3 | 4.6 |
11. táblázat Az ASAPprime® használatával a tabletta prototípusának összehasonlító eltarthatósági előrejelzése (évek)
| 29,366 ± 4,641 | 32,545 ± 4,952 | 31,813 ± 4,657 | 43,167 ± 4,904 | 42,016 ± 4,924 | 41,43 ± 4,463 | |
| 20,745 ± 3,298 | 23,088 ± 3,522 | 22,531 ± 3,313 | 30,792 ± 3,490 | 29,932 ± 3,500 | 29,541 ± 3,324 | |
| 0,013 ± 0,004 | 0,019 ± 0,005 | 0,018 ± 0,005 | 0,031 ± 0,005 | 0,029 ± 0,005 | 0,029 ± 0,004 | |
| 0,949 | 0,979 | 0,969 | 0,947 | 0,948 | 0,962 | |
| Várható eltarthatóság (év) a | ||||||
| 0.51 | 0,65 | 0,64 | 3.59 | 2.87 | 3.0 | |
| 0,63 | 0,81 | 0,74 | 3.74 | 3.12 | 3.61 | |
| 0,76 | 1.28 | 1.20 | 10.6 | 8.28 | 7.98 | |
| 0,62 | 0,90 | 0,82 | 4.54 | 4.74 | 4.85 | |
Megjegyeztük azt is, hogy az F # 3 és F # 5 ASAP eredményeinek összehasonlításakor (11. táblázat), ahol az MCC-t azonos százalékban alkalmazták (9. táblázat), a keményítő látszólag képes volt mérsékelni az MCC destabilizáló hatását, és az F # 5 készítmény életképes lehetőség az inkompatibilis segédanyag MCC felvétele ellenére.
Cukoralkoholok ☆
Tablettázás
Bár az összes porított poliolt rotációs gépeken összenyomhatjuk tabletták előállítására, a szorbit a leggyakoribb poliol, amelyet ezen a területen használnak.
A porított szorbit kiváló áramlási tulajdonságokkal rendelkezik a tablettázáshoz. A jó folyékonyság nagyon fontos a tabletta egységes tömegének biztosításához. Más, közvetlenül összenyomható anyagokkal összehasonlítva, a porított szorbit nagy szakítószilárdság-növekedést eredményez a nyomóerő függvényében, ezért nagyon alkalmas közvetlen összenyomáshoz. Meglehetősen magas higroszkóposságuk miatt a szorbit-alapú tablettákat védeni vagy viszonylag száraz körülmények között kell tárolni, hogy elkerüljék a nedvességfelvétel miatti lágyulást. A szorbit tabletták, még az alacsony nyomáson összenyomott tabletták életképessége is rendkívül alacsony, és tovább javul az egyensúlyi relatív páratartalom mellett történő tárolással. A szorbit por általános teljesítőképessége a tablettázás során különböző tényezőktől függ, például részecskemérettől és eloszlástól, kristálymorfológiától és kompressziós körülményektől.
CUKOR ALKOHOLOK
Albérlet
Bár az összes porított poliolt rotációs gépeken összenyomhatjuk tabletták készítéséhez, a szorbit a leggyakoribb poliol, amelyet ezen a területen használnak.
A porított szorbit kiváló folyási tulajdonságokkal rendelkezik a tablettázáshoz. A jó folyékonyság nagyon fontos a tabletta egységes tömegének biztosításához. Más, közvetlenül összenyomható anyagokkal összehasonlítva, a porított szorbit a szakítószilárdságot a kompressziós erő függvényében nagy mértékben megnöveli, ezért közvetlen nyomáshoz nagyon alkalmas. Meglehetősen magas higroszkóposságuk miatt a szorbit-alapú tablettákat viszonylag száraz körülmények között kell védeni vagy tárolni, hogy elkerüljék a nedvesség felszívódása miatti lágyulást. A szorbit tabletták, még az alacsony nyomáson összenyomott tabletták életképessége is rendkívül alacsony, és tovább javul az egyensúlyi relatív páratartalom (ERH) közelében történő tárolással. A szorbit por általános teljesítőképessége a tablettázásban különböző tényezőktől függ, például részecskemérettől és eloszlástól, kristálymorfológiától és kompressziós körülményektől.
OXPIRT: Ontológia alapú eXpert rendszer egy általános azonnali kiadású tabletta előállításához
Nopphadol Chalortham,. Phuriwat Leesawat, a gyógyszerkészítmény-fejlesztési eszközökben, 2013
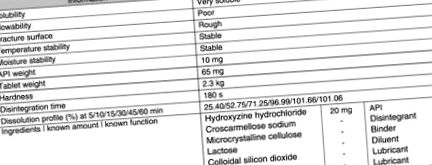
Hidroxi-zin-hidroklorid
Az eredeti hidroxi-zin-hidrokloridra vonatkozó információkat a 8.9. Ábra tartalmazza .
8.9. Ábra Információ az előformulációs tanulmányban szereplő hidroxi-zin-hidroklorid termékről és eredeti szabadalma
A 8.9. Ábra információval kapcsolatos IF-THEN szabályait a 8.6. Táblázat sorolja fel .
8.6. Táblázat A generikus hidroxi-zin-hidroklorid-termelés koncentrációjának beállítására használt szabályok
| én | HA ÉS AKKOR |
| II | HA ÉS AKKOR |
| III | HA az eredeti szétesési ideje kisebb vagy egyenlő, mint 180 s> ÉS AKKOR |
| IV | HA AKKOR |
| V | HA ÉS ÉS ÉS ÉS ÉS AZTAN |
8.10. Ábra OXPIRT eredmény egy hidroxi-zin-hidroklorid generikus termékre.
Az OXPIRT eredményét laboratóriumban kell előállítani, hogy megvizsgálják a tabletta tulajdonságait a szokásos minőség-ellenőrzés érdekében. A 8.11. És a 8.12. Ábra egy oldódási profilt és grafikont mutat be, összehasonlítva az eredeti és a 8.10. Ábrán kapott általános változatot, és az eredmény a gyógyszerészeti ekvivalenciát mutatja, mivel a különbség (f1) és a hasonlóság (f2) tényezők elfogadható tartományon belül vannak.
8.11. Ábra Gyógyszerészeti ekvivalencia eredmény az eredeti és a általános hidroxi-zin-hidroklorid között
8.12. Ábra Eredeti Atarax® tabletta és általános hidroxi-zin-hidroklorid tabletta oldódási profilja
A vízben rosszul oldódó gyógyszereket tartalmazó push-pull ozmotikus pumpás tabletták kifejlesztésének és elkészítésének szakértői rendszere
Automatikus szabályozás
Amikor a felhasználó a szerszámátmérő „automatikus” értékét választja a kezelőfelületen a segédanyagok kiválasztásához, akkor a tabletta magjának súlyát automatikusan szabályozni kell, ami azt jelenti, hogy a rendszer a tabletta tömegét széles tartományban, csak a szabályok. Ezt a következőképpen hajtják végre.
A kezdeti készítmény tabletta magjának tömegét kiszámítjuk. Ezután folytassa (ii).
A gyógyszerrétegben lévő szuszpenzió 10% -kal növekszik, ha a tabletta magja kevesebb, mint 300 mg. A tabletta magjában lévő összes többi segédanyag ugyanolyan sebességgel változik. Ezután folytassa a (iii) ponttal.
Ha a tabletta mag tömege 300 mg és 400 mg között van, akkor a következő lépésre lép, amely módosítja a készítményt annak érdekében, hogy megtalálja azt, amely a várt módon felszabadíthatja a gyógyszert.
Ha a tabletta mag tömege meghaladja a 400 mg-ot, a nyomóréteget a gyógyszerréteg 40% -ára csökkentik, ami azt jelenti, hogy a nyomóréteget a kezdeti felhasználási mennyiség 40% -ára/60% -ára csökkentik, beleértve a duzzadó szert is. ozmotikus szer, kötőanyag, pigment és kenőanyag a nyomórétegben. A nyomóréteg kezdeti felhasználási mennyisége a szabályok szerint a gyógyszerréteg 60% -a. Ezután folytassa (iv).
Kiszámítjuk a módosított készítmény tabletta mag tömegét. Ezután folytassa (ii).
Kiszámítjuk a módosított készítmény tabletta mag tömegét. Ha az alaptömeg nem több, mint 800 mg, akkor a következő lépésre lép, amely módosítja a készítményt annak érdekében, hogy megtalálja azt, amely a várt módon felszabadíthatja a gyógyszert.
Ha a mag tömege nagyobb, mint 800 mg, a nyomóréteget a gyógyszerréteg 25% -ára csökkentik, ami azt jelenti, hogy a nyomóréteg a kezdeti felhasználási mennyiség 25% -ára/60% -ára csökken. Ezután kiszámítják a módosított készítmény tabletta mag tömegét. Ha a mag tömege ezúttal is meghaladja a 800 mg-ot, a rendszer befejezi a folyamatot, és üzenetet jelenít meg arról, hogy a felhasználó nem tudja megtalálni a célkészítményt. Vagy áttér a következő lépésre, amely módosítja a készítményt annak érdekében, hogy megtalálja azt, amely a várt módon felszabadíthatja a gyógyszert.
A munkafolyamat a 4.16. Ábrán látható .
4.16. Ábra A mag tömegének módosításának munkafolyamata (automatikus mag tömeghatár). Kilépés: a rendszer nem tud elfogadható eredményt elérni, majd kilép a folyamatokból és tájékoztatja a felhasználót. Folytassa a következő lépéssel: a rendszer elfogadható eredményt kap, majd a következő lépésre lép
A minőségi elvek integrált alkalmazása a kábítószer-termékekre és azok ellenőrzési stratégiájának kidolgozására
6.3 Potencia és tartalmi egységesség
A potenciál és a tartalom egységességének kockázatértékelése alapján vizsgált folyamatparamétereket és anyagjellemzőket a 14. ábra mutatja .
14. ábra A potenciát és a tartalom egységességét befolyásoló anyagjellemzők és folyamatparaméterek (Badawy et al., 2016).
A keverési paraméterek és a hatóanyag részecskemérete alacsony kockázatot jelentett a brivanib-alaninát magas tablettatartalmának (50 tömeg%) miatt. Ezért nem vizsgálták őket a tabletta hatékonyságára és a tartalom egységességére gyakorolt hatásuk szempontjából. A nagy gyógyszerterhelésű készítményeknél a hatékonyságot és a tartalom egységességét általában elsősorban a tabletta átlagos súlya és súlyváltozása szabályozza. Ezeket tehát kritikusnak tekintették ezen CQA-k kontrollja szempontjából.
A folyamat közbeni anyagjellemzők, amelyek ismerten befolyásolják a tabletta tömegének változását a sajtolás során, magukban foglalják a szemcseméret-eloszlást és az áramlási tulajdonságokat. A nedves granulálás és az őrlési folyamat paramétereit a granulálás részecskeméret-eloszlására, áramlási tulajdonságaira és a tabletta tömegének variációjára gyakorolt hatásuk alapján értékeltük a fent említett DOE vizsgálatokban. Bár a nedves granulálás és az őrlési paraméterek változása némi eltérést okozott a keverék végső részecskeméret-eloszlásában és áramlási sebességében (Erweka áramlásmérővel mérve) (8. ábra), a szemcseméret-eloszlás és az áramlási sebesség ezen változása nem volt hatással a tabletta tömegének változására a kompressziós vizsgálatokban. A nedves granulálási és őrlési paramétereket ezért nem kritikusnak tekintjük a hatékonyságra és a tartalom egységességére gyakorolt hatásuk szempontjából.
Fejlődő technológia a gyógyszergyártás korszerűsítésére
37.4.5 Tömörítés
Ha a poranyag részecskeméret-eloszlása vagy sűrűségének változékonysága nagy, akkor a szétválasztás a szerszámtöltés során, amely tartalmi egységességi problémákat eredményez. A szerszám kitöltéséhez szükséges időt befolyásolhatja az alacsony térfogatsűrűség, a rossz összenyomhatóság vagy a poranyag összetartása, ami a tabletta tömegének változékonyságát és a tabletta elégtelen keménységét eredményezi. 18 A tabletta keménységének változása befolyásolhatja a termék teljesítményét (azaz az oldódást). 42,43 A részecskék finom mennyisége összenyomódási problémákhoz vezethet, például felső határhoz. 44,45 Ezenkívül a hatóanyag fiziokémiai tulajdonságai befolyásolhatják a hőmérséklet-függő polimorf átalakulások hajlamát a tömörítési folyamat során. 46
A táblagép-prések egy másik példa a jelenleg folyamatosan üzemelő berendezésekre. Annak érdekében azonban, hogy a tablettázás folyamatos irányban integrálható legyen az előremeneti műveletekhez, az adagoló garat kitöltési szintjének dinamikája eltérhet a hagyományos szakaszos gyártásnál tapasztaltaktól. 18 Az egyik működési módszer a tabletta sajtójának toronysebességének kiválasztása, hogy megfeleljen a folyamat kívánt vonalsebességének. Ezután a garatban lévő töltés szintje változhat működés közben, hogy pufferként szolgáljon az áramlási sebesség változásának elnyelésére.
A szilárd orális gyógyszerkészítmények specifikációjának beállítása és gyártási folyamatának ellenőrzése
25.5.1 Folyamaton belüli anyagvizsgálatok és minőségi jellemzők
A folyamat közbeni anyagvizsgálatok a folyamatszabályozás egyik kritikus eleme. Ezeket a gyógyszerek vagy gyógyszerkészítmények gyártása során lehet végrehajtani, nem pedig a termék felszabadulása előtt elvégzett hivatalos tesztek részeként. 1 A folyamat közbeni teszteket, amelyeket csak a folyamatparaméterek kiigazítására használnak egy működési tartományon belül (pl. A bevonandó tablettamagok keménysége és törékenysége és az egyedi tabletta súlya), nem tartalmazzák a specifikációk. A 25.7. Táblázat felsorolja a szilárd orális dózisformák tipikus folyamat közbeni anyagvizsgálatait.
25.7. Táblázat Példák a szilárd orális adagolási formák folyamat közbeni tesztjeire
- Sigmoid Volvulus - áttekintés a ScienceDirect témákról
- Struvite - áttekintés a ScienceDirect témákról
- Orlistat - áttekintés a ScienceDirect témákról
- Taurin - áttekintés a ScienceDirect témákról
- Oxálsav - áttekintés a ScienceDirect témákról