Táplálkozás alkohollal összefüggő májbetegségekben Fiziopatológia és kezelés
Az alultápláltság, amely magában foglalja mind a makro-, mind a mikro-tápanyaghiányt, továbbra is az alkohol okozta májbetegségek (ArLD) egyik leggyakoribb szövődménye. A fehérje-energia alultápláltsága jelentős szövődményeket okozhat, beleértve szarkopeniát, gyengeséget és immundepressziót cirrhotikus betegeknél. Az alultápláltság csökkenti a beteg túlélését és negatívan befolyásolja az ArLD-vel rendelkező egyének életminőségét. Sőt, a táplálékhiány növeli a máj dekompenzációjának valószínűségét cirrhosisban. A veszélyeztetett személyek gyors felismerése, az alultápláltság korai diagnosztizálása és kezelése továbbra is az ArLD kezelésének kulcsfontosságú eleme. Ebben az áttekintésben az alultápláltság patofiziológiáját írjuk le az ArLD-ben, áttekintjük a táplálkozás értékeléséhez rendelkezésre álló szűrési eszközöket, és megvitatjuk az ArLD különböző stádiumai szempontjából releváns táplálkozási menedzsment stratégiákat, az akut alkoholos hepatitistől a dekompenzált végstádiumú májbetegségig.
Alap tipp: Az alultápláltság az alkoholhoz kapcsolódó májbetegség (ArLD) gyakori szövődménye, amely kezeletlenül hátrányosan befolyásolhatja a beteg kimenetelét és gyógyulását. A táplálék-kimerülés gyors felismerése azonosíthatja azokat a betegeket, akiknek nagyobb a kockázata a klinikai dekompenzációnak, de kevés útmutatás létezik ezen komplex betegek klinikai kezelésének tájékoztatására. Ebben a cikkben megvitatjuk az ArLD mikro- és makro-tápanyaghiányának patofiziológiáját és kezelését, és ajánlásokat adunk a betegek kezelésére a betegségük különböző szakaszaiban.
- Idézet: Kamran U, Towey J, Khanna A, Chauhan A, Rajoriya N, Holt A. Táplálkozás alkohollal összefüggő májbetegségekben: fiziopatológia és kezelés. Világ J Gasztroenterol 2020; 26 (22): 2916-2930
- URL:https://www.wjgnet.com/1007-9327/full/v26/i22/2916.htm
- DOI:https://dx.doi.org/10.3748/wjg.v26.i22.2916
Aligha kétséges, hogy az ArLD-vel kapcsolatos alultápláltság értékelésére és osztályozására irányuló klinikai gyakorlati útmutatások hiánya okozza ennek a betegségnek a klinikai gyakorlatban való rossz felismerését, diagnosztizálását és kezelését. A cikk célja a releváns patofiziológia meghatározása, az értékelési módok összefoglalása és az optimális táplálkozás-kezelés megbeszélése az ArLD különböző formáiban.
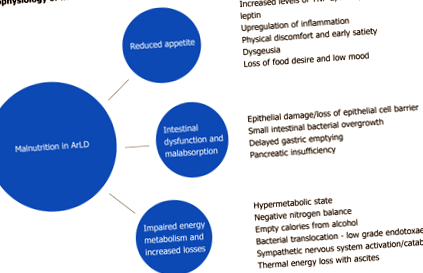
Az alultápláltság az ArLD-ben és az AcLD-ben sokféle és sok egymástól függő elemből áll, de az energia-kiegészítők elérhetőségének növelése nem elegendő a katabolikus állapotot vezérlő hatalmas erők ellensúlyozásához. Itt feltárunk néhány olyan elemet, amely hozzájárul a feltételhez (1. ábra).
Az alkohol diffúzió útján szívódik fel a gyomorban, kisebb mértékben a nyombélben és a jejunumban. Míg az akut és túlzott alkoholfogyasztás gyomor- és nyombélüróziókat, valamint a villák túlnyomó részében fellépő hámvesztést okozhat a jejunum felső részén [29], a krónikus alkoholfogyasztás bélnyálkahártyára gyakorolt hatását nemigen értik. Ez magában foglalhatja a bélfibrózist, valamint az aerob és anaerob mikroorganizmusok túlnövekedését, amelyek hozzájárulnak a vékonybél funkcionális és morfológiai rendellenességeihez [30]. Gerova et al [31] az ARLD-ben szenvedő betegeknél a vékonybél baktériumok kolonizációjának nagyobb gyakoriságáról számoltak be, a változások a májműködési zavar stádiumától függetlenül következtek be, ami arra utal, hogy az alkohol közvetlen hatása a bélmotilitására és immunitására megengedő mikrokörnyezetet teremt a vékonybél túlnövekedéséhez ezeken oldalak.
A bél mikrobiomjában bekövetkező változások mellett a krónikus alkoholfogyasztás csökkentheti a hámsejtek szoros csatlakozásainak tapadását [32], ami fokozott bélpermeabilitást, baktériumok transzlokációját és ennek következtében a gyulladáscsökkentő citokinek és lipopoliszacharidok növekedését eredményezheti [33]. A krónikus alkoholfogyasztás rontja a bélmozgást, az alkohol okozta kémiai gyomorhurut pedig késlelteti a gyomor kiürülését, mindkettő jelentősen megnöveli az oro-vakbél tranzitidejét [34], ami a tápanyagok károsabb felszívódásához vezet. Ezenkívül az alkohol fontos rizikófaktor a krónikus hasnyálmirigy-gyulladásban és a hasnyálmirigy exokrin elégtelenségében (PEI), amely súlyosbíthatja a felszívódási rendellenességet [35]. .
A hosszabb időn át tartó túlzott alkoholfogyasztás az inzulinrezisztencia romlását, a szív- és érrendszeri morbiditást és a mortalitást fokozza [48, 49]. Krónikus alkoholfogyasztás esetén a máj glikogénkészletei kimerülnek, míg az erős alkoholfogyasztás (mértéktelen alkoholfogyasztás) akut epizódjaiban gátolják a glükoneogenezist és stimulálják a máj glikogenolízisét a hipoglikémia megelőzésére. Ezért, míg egészséges egyénnél az akut alkoholfogyasztás valószínűleg nem okoz változásokat az euglikémiás állapotban, krónikus májbetegségben szenvedő betegeknél az akut alkoholfogyasztás hipoglikémiát okozhat [50, 51] .
Az alacsony vagy mérsékelt alkoholadagok alig vagy egyáltalán nem befolyásolják az izomfehérje egyensúlyát, de a nagy adag alkoholfogyasztás heveny fogyasztása és a krónikus alkoholfogyasztás a nitrogén kiválasztás növelésével megváltoztatja mind az egész testet, mind a szövetspecifikus fehérje anyagcserét [52]. A myopathia a krónikus alkoholizmus gyakori szövődménye, és az izomfehérje növekedése és lebontása közötti hosszan tartó egyensúlyhiány eredménye [53, 54] .
A májnak központi szerepe van a lipid metabolizmusban, amely a hormonok, a magreceptorok, az intracelluláris jelátviteli utak és a transzkripciós faktorok összetett reakcióhálózatát és kölcsönhatását követi. A szabad zsírsavakat (FA) a máj szintetizálja a glikolitikus utakból, és közvetlenül a bélből és a zsírszövetből mobilizálja. Az alkohol gátolja az FA oxidációs útjait (számos PPARα-szabályozott gén expressziójának csökkentésével) [55], és növeli az FA észterezését, ami az intrahepatikus triglicerid fokozott felhalmozódását eredményezi [56]. Az alkohol a FA májból történő exportját is befolyásolja azáltal, hogy elnyomja a mikroszómás triglicerid transzfer fehérjét, amint az etanollal táplált állatok májában megfigyelhető, ami szükséges a nagyon kis sűrűségű lipoproteinek export előtt történő összeállításához [57]. Ennek eredménye az intrahepatikus zsírfelhalmozódás, amely végül tartós alkoholfelesleggel járó sérülések és sejthalál iteratív ciklusainak eredményeként cirrhosissá fejlődik.
A krónikus alkoholfogyasztás és a sárgaság miatt az A-vitamin szintje csökken [61]. Az A-vitamin metabolizmusa hasonlít az emberi szervezet alkohol-anyagcseréjéhez, mivel mindkettő oxidatív útvonalat érint, ezért kiszolgáltatott a máj bazális redoxi-állapotának változásaira [62]. Az alkohol-dehidrogenáz aktivitás és a citokróm 2E1 negatívan befolyásolja a retinoid homeosztázist [63], a krónikus alkoholfogyasztás pedig a máj és a plazma retinoidszintjének és a retinoidkötő fehérjék kimerüléséhez vezet [64, 65]. Az alkoholról úgy gondolják, hogy gátolja a β-karotin, az étrendi A-vitamin pro-karotinoid hasítását is [66]. Az A-vitamin hiány az éjszakai vakság klinikai megjelenéséhez vezethet.
Az étrendi elégtelenség mellett különféle mechanizmusokat feltételeztek a C-vitamin hiányának a krónikus alkoholfogyasztás összefüggésében történő figyelembe vételére [67]. Az alkohol által kiváltott enterocita toxicitás a bél felszívódási zavarához és hepatotoxicitásához vezet, amelyek gátolják a különféle vitaminok (köztük a C-vitamin) májban történő átalakulását aktív metabolitjaikká [68]. A C-vitamin egyensúlyhiányát súlyosbítja az aszkorbinsav vizelettel történő fokozott kiválasztódása az alkoholfelesleg epizódjait követően [69]. Egyes tanulmányok azt sugallják, hogy a C-vitaminnal történő előzetes kezelés jelentősen növeli a vér etanol-clearance-ét, valószínűleg annak eredményeként, hogy képes peroxidot szolgáltatni, és ezáltal lehetővé teszi a kataláz hozzájárulását az etanol oxidációjához [70]. A C-vitamin-hiány klinikai megnyilvánulása skorbut, és gyenge sebgyógyulásként, ínyduzzadásként, ínyvérzésként, fogvesztésként és mucocutan petechiákként jelentkezhet; a késői betegség életveszélyes lehet anasarca, haemolysis és sárgaság esetén [71, 72] .
A cink felszívódik keresztül fémmegkötő transzkripciós faktorok és kulcsszerepet játszik a génexpresszió szabályozásában. Az alkohollal táplált egerekben az alkohol megzavarja a bél áteresztőképességét és növeli az oxidatív stresszt, főleg a disztális vékonybél szintjén, amely zavarja a cink homeosztázisát, és csökkent ileális cinkkoncentrációhoz vezet [73]. Állatkísérletek kimutatták, hogy a cinkpótlás megőrzi a bél integritását és megakadályozza az endotoxaemiát, ami az endotoxin által kiváltott TNF-α-termelés gátlásához vezet a májban mind az alkohol expozíciójának akut, mind krónikus körülményei között [74]. A csökkent enterális felszívódás és a cink fokozott vizelettel történő kiválasztása mellett az alkohollal összefüggő cirrhosisban szenvedő betegeknél gyakran hiányzik a fehérje- és cinktartalom, a cinkhiány a dysgeusia gyakori (és könnyen orvosolható) oka. A cinkhiány megnyilvánulhat acrodermatitis, anorexia, hypogonadism, megváltozott immunfunkció, rossz sebgyógyulás, éjszakai látásromlás, hasmenés, mentális funkciók és portális szisztémás encephalopathia formájában [75, 76]. .
A magnézium a második leggyakoribb mikroelem az emberi testben, és a hiány szinte egyetemes azoknál az egyéneknél, akik magas alkoholfogyasztással és/vagy májbetegséggel rendelkeznek. Az anyagcsere kritikus meghatározója, ko-faktorként működik a fehérje- és nukleinsavszintézisben, valamint az energia-anyagcserében részt vevő több mint 300 enzimatikus reakcióban. Az alkohol növeli a magnézium vizelettel történő kiválasztását, és a magnézium teljes testrészlete kimerül szinte minden, alkohollal összefüggő cirrhosisban szenvedő beteg esetében [77]. További érzéketlen veszteségek lépnek fel az alkohol okozta hasmenés, hányás és olyan gyógyszerek, mint a diuretikumok és az aminoglikozidok egyidejű alkalmazása miatt. A hypomagnesemia hajlamos metabolikus csontbetegségre, kardiovaszkuláris társbetegségekre, és görcsrohamokkal, depresszióval és neuromuszkuláris rendellenességekkel társul [78, 79] (1. táblázat).
| Tápanyagok | Az alkoholfogyasztás hatása | Eredmények | |
| Szénhidrát | Akut alkoholfogyasztás | Gátolja a glükoneogenezist; serkenti a máj glikogenolízisét | Hipoglikémiás; hiperglikémiás |
| Krónikus alkoholfogyasztás | Gátolja a laktát által stimulált glükoneogenezist; szénhidrátban gazdag étel alkohollal együtt | Hyperlactatemia; késleltetett paradox hipoglikémiás állapot | |
| Fehérjék | Akut és krónikus alkoholfogyasztás | Növeli a nitrogén kiválasztását; egyensúlyhiány a fehérje növekedése és lebontása között | Izomvesztés és myopathia |
| Lipidek | Akut és krónikus alkoholfogyasztás | Gátolja a β-oxidációt és növeli a zsírsavak észterezését | Fokozott triglicerid felhalmozódás a hepatocitákban Fibrosis |
| Tiamin | Krónikus alkoholfogyasztás | Nem megfelelő táplálkozási bevitel Csökkent felszívódás | Wernicke Korsakoff szindróma |
| Folsav | Krónikus alkoholfogyasztás | Csökkentett étrendi bevitel; bél felszívódási zavar; csökkent májfelvétel, tárolás; fokozott vizeletürítés | Makrocita anaemia; izomzavar |
| A-vitamin | Krónikus alkoholfogyasztás | Gátolják a β-karotin, egy diétás A-vitamin karotinoid diétájának hasítását | Xeroftalmia és éjszakai vakság |
| C vitamin | Krónikus alkoholfogyasztás | Bél felszívódási zavar; a hepatotoxicitás gátolja a máj transzformációját aktív metabolitjaivá | Skorbut és gyenge sebgyógyulás |
| Cink | Krónikus alkoholfogyasztás | Megzavarja a bél áteresztőképességét; csökken az ileum -cink koncentrációja; a reaktív oxigénfajok és a plazma endotoxinszintek fokozott felhalmozódása | Acrodermatitis; étvágytalanság; hipogonadizmus; megváltozott immunfunkció; gyenge sebgyógyulás; zavart éjszakai látás; hasmenés; károsodott mentális funkció és portális szisztémás encephalopathia |
| Magnézium | Krónikus alkoholfogyasztás | Növeli a magnézium vizelettel történő kiválasztását | Kardiovaszkuláris: magas vérnyomás, stroke és miokardiális infarktus; Neurológiai: Görcsroham, depresszió és neuromuszkuláris rendellenességek |
A kétértékű kationhiányok, például a szelén és a magnézium kölcsönhatását nemigen értik, de úgy tűnik, kulcsfontosságú szerepet játszanak az alkohollal összefüggő cirrhosisban megfigyelt immunparézisben. A szelénhiány gyakori alkoholfüggőségben [80, 81], arányos a betegség stádiumával és a gyulladásgátló citokinek fokozott szintjével, amelyek szerepet játszanak a májkárosodásban és a fibrózisban. A jelenlegi bizonyítékok azt sugallják, hogy a dekompenzált májbetegségben a mikroelemek anyagcseréje károsodott, és hogy ezen elemi hiányosságok pótlásával a klinikusok képesek lesznek ellensúlyozni az immunhiány-parézis és a hangulati rendellenességek némelyikét, amelyeket ezekben az alultáplált állapotokban szoktak észlelni [82, 83]. .
A májbetegségekben az alultápláltság felmérésére nincs aranyszabvány, és egyiket sem kifejezetten ArLD-s betegek számára tervezték, de számos olyan szűrőeszköz létezik [97], amelyeket az alultápláltság kockázatának értékelésére fejlesztettek ki, bár a legtöbbnek nincs külső validációja. A májbetegség alultápláltságát szűrő eszköz [98] egy hat kérdésből álló táplálkozási szűrőeszköz, amelyről kiderült, hogy pontosan azonosítja az alultápláltságot (93%) májcirrhosisban szenvedő betegeknél, bár hosszabb távon nem vizsgálták. Míg a Royal Free Hospital Nutritional Prioritization Tool (RFH-NPT) [99] alkalmazkodott a folyadék túlterhelésének kezeléséhez. Az RFH-NPT felhasználóbarát, gyorsan kitölthető, és jó előre jelzi a klinikai romlást. Tekintettel az alultápláltság és a szarkopénia magas előfordulására az alkohollal összefüggő cirrhosisban, minden betegnél táplálkozási szűrést kell végezni a bemutatás helyén, ideális esetben egy szabványosított szűrőeszköz, például az RFH-NPT alkalmazásával [100] .
A testtömeg-index (BMI) gyakran torzul krónikus májbetegségben szenvedő betegeknél olyan folyadékretenciós állapotok miatt, mint az anasarca vagy az ascites. Ezenkívül a szarkopéniás elhízás egy másik entitás, amelyet a túlzott zsír, valamint a gyenge izomtömeg és funkció jellemez [101]. Ilyen körülmények között a BMI nem megfelelő mérőszámnak bizonyul a szövődmények előrejelzéséhez, és az izomtömeg és erő objektív mérőszámaival együtt kell használni.
Az ArLD miatt dekompenzált cirrhosisban szenvedő betegeknél szinte mindig kiegészítő táplálkozási támogatás szükséges, különösen ascites betegeknél. Fontos kerülni a hosszan tartó éhezési periódusokat, hogy minimalizáljuk az izom- és zsírraktárak lebomlását anyagcsere-üzemanyagként, és ezt rendszeres 2-3 órás étkezési szokás, beleértve az ágyban történő snacket is. Míg az energiaszállítás gyakoriságának módosítása hatékony eszköz a glükoneogenezis gátlásával a csontváz zsírtömegének gyorsított veszteségének megakadályozásában; azok a betegek, akik egész nap folyamatosan legelnek, védik az izmokat, de előfordulhat, hogy nem fogyasztanak elegendő kalóriát a zsírraktárak megőrzéséhez, és további kalóriákra lehet szükség a zsírvesztés megelőzéséhez [106]. A kompenzált cirrhosis energiaigényét ezért napi 25-30 kcal/kg-ra, dekompenzált cirrhosisban 30-35 kcal/kg-ra becsülik. Elhízott betegeknél (BMI> 30 kg/m 2) az energiaigény körülbelül 25 kcal/kg/nap értékre becsülhető (3. ábra). Minden követelménynek a becsült száraz testtömegen és a becsült BMI-n kell alapulnia.
Az orr-gyomor (NG) vagy a naso-jejunal (NJ) táplálás klinikailag javallt, ha az energia- és/vagy fehérjeszükséglet önmagában szájon át történő bevitel révén nem teljesíthető. A májcirrózisban az NG/NJ táplálás megkezdésének egyéb indikációi közé tartozik az ascites korai jóllakottsága, a refrakter ascites, az energia- és fehérjeszükséglet optimalizálása vagy a krónikus hányás. Kearns et al [107] az egyidejű cirrhosisban szenvedő AAH-val rendelkező kontrollcsoportot szokásos orális bevitelhez kapta, míg egy másik csoport enterális táplálékot kapott napi 40 kcal/kg és napi 1,5 g/kg fehérje mellett. Az enterálisan táplált csoport 200% -kal több energiát kapott, mint a kontrollok, és javult a nitrogén egyensúly, a szérumalbumin és a HE (P ≤ 0,02) 3 hét múlva. Míg ez a tanulmány a táplálkozási állapot rövid távú javulását és a májjal kapcsolatos nemkívánatos események csökkenését mutatta, a vizsgálat kis mintamérete és keresztmetszeti jellege korlátozta a hosszabb távú eredmények értékelését. Más tanulmányok rámutattak az intenzív tubus-etetés kockázataira a cirrhosisban, és a rövid ideig tartó etető csövek in situ elhelyezésének megtartása kihívást jelenthet, különösen zavart betegeknél [18, 108] .
A vékonybél bakteriális túlnövekedésének (SIBO) tünetei közé tartozik a hasmenés, a steatorrhoea, a krónikus hasi fájdalom, a puffadás és a puffadás, bár egyes betegek tünetmentesek lehetnek. Általában diagnosztizálják keresztül a hidrogén vagy metán légzésvizsgálata és kezelése általában nem felszívódó antibiotikumok, például rifaximin vagy neomicin kezelését igényli. Az egyik metaanalízis [114] potenciális szerepet azonosított a probiotikumok, a prebiotikumok és a szimbiotikumok alkalmazásában - arra a következtetésre jutott, hogy a probiotikumok jobban tolerálhatók, mint a laktulóz, javult a SIBO és a minimális HE kezelése [kockázati arány (RR) 0,40, 95% CI: 0,32-0,50, P [115], és meg kell jegyezni, hogy a hemoglobin alkalmazása a glikémiás kontroll közvetlen markerként anémia vagy a közelmúltbeli vérátömlesztés összefüggésében pontatlan lehet, és körültekintően kell értelmezni.
Az ArLD-ben szenvedő betegek táplálkozási értékelését és kezelését bonyolultabbá teszi a betegek klinikai állapotromlásában szerepet játszó kórokozó mechanizmusok száma. A táplálék és nyomelem kimerülése általában társul az ArLD-vel, és a betegek gyorsan kialakíthatják a súlyos PEM jellemzőit, hacsak nem kezdenek azonnal táplálkozási menedzsment stratégiákat. Ezenkívül a szövődményeket, mint például a táplálkozási immunparezist, a szarkopeniát és a gyengeséget, nehéz megállapítani, miután ezek létrejöttek. Az alultápláltság és a szarkopénia szorosan összefügg a cirrhosis szövődményeinek kialakulásával, és a helytelen táplálkozás továbbra is mind a rövid, mind a középtávú túlélés erős előrejelzője. Ennek ellenére az energia- és fehérjehiány visszafordulása mind az AAH-ban, mind az alkohollal összefüggő cirrhosisban javítja a betegek kimenetelét a funkció és a fizikai állapot javításával, valamint a mortalitás és a morbiditás csökkentésével. Ebben az összefüggésben fontos, hogy az ilyen betegeket kezelő orvosok jól ismerjék a májbetegségre jellemző táplálkozási terápiákat, így a kezelések gyorsan megkezdhetők és tudományos módon alkalmazhatók.
Kézirat forrása: Meghívott kézirat
Levelező szerzői tagság szakmai társaságokban: a Brit Gasztroenterológiai Társaság tagja, 1193.
Specialitás típusa: Gasztroenterológia és hepatológia
Származási ország/terület: Egyesült Királyság
Peer-review report tudományos minőségi osztályozása
A osztály (Kiváló): A
B osztály (nagyon jó): B
P-Reviewer: Barone M, Cravo M S-szerkesztő: Yan JP L-szerkesztő: E-szerkesztő: Liu MY
- Táplálkozás és testmozgás a májcirrhosis kezelésében
- A táplálkozás szerepe az alkoholmentes zsírmájbetegség patogenezisében és megelőzésében Legutóbbi
- NASPGHANESPGHAN Position Paper Nutrition Support krónikus májbetegségben szenvedő gyermekek számára;
- A kolesztázis táplálkozási kezelése - Send - 2020 - Klinikai májbetegség - Wiley Online Könyvtár
- Alkoholmentes zsírmájbetegség - Étel; Táplálkozási Magazin