Táplálkozási genomika, polifenolok, étrendek és hatásuk a dietetikára
Stephen Barnes
Farmakológiai és Toxikológiai Tanszék, valamint a tápanyagok és a gének kölcsönhatásának központja a rák megelőzésében, Alabamai Egyetem, Birmingham, és a Purdue Egyetem-Alabamai Egyetem, a Birmingham Botanikai Központ Korral kapcsolatos Betegségek Központja, Birmingham, AL 35294
Absztrakt
Bevezetés
Ez az áttekintés ismerteti az alapul szolgáló biokémiát, bemutatja az emberi genom variációit és a táplálkozás táplálkozási genomikával kapcsolatos szerepét, valamint bemutatja az egyes étrendi összetevők időzítésének szerepét, amelyeken a genom egyes részei kifejeződnek. Például az étrendi polifenolok egészségben betöltött szerepét táplálkozási genomikai és dietetikai szempontból tárgyaljuk. Végül röviden áttekintjük az új terület gyümölcseinek elérése érdekében folyamatban lévő nemzeti és nemzetközi erőfeszítések fontosságát. A táplálkozási genomika dietetikára gyakorolt hatásának áttekintését lásd Afman és Müller (5), valamint Trujillo és mtsai. (6).
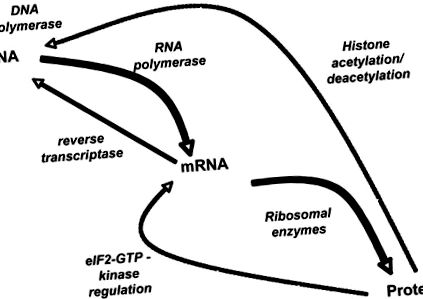
A biokémiai információk áramlása
A fő útvonal a DNS-től az mRNS-ig terjed a fehérjékig (a félkövér vonalak), és egy sor fehérje közvetíti, beleértve az RNS-polimerázt és a transzlációs készülékét. Jól értendő azonban, hogy az enzimek mind a DNS, mind az RNS szintézisét szabályozzák (ellenőrzésüket a szaggatott vonalak képviselik). Az információ az RNS-ről a DNS-re áramlik a reverz transzkriptáz hatására. A kinázok szabályozzák a megnyúlás-iniciációs faktor 2-guanozin-trifoszfát (eIF2-GTP) komplex foszforilációs állapotát. Az életünk egy adott szakaszában egy sejtben expresszálódó gének nagymértékű szabályozását a hisztonok, a DNS-hez szorosan kötődő bázikus fehérjék transzláció utáni módosítása határozza meg. A hisztonok dezacetilezése a génexpresszió elnyomásához vezet.
A DNS kettős szálú, mindegyik szál a másik tükörképe [a kép úgy jön létre, hogy a citozint (C) és a guanozint (G), az adenozint (A) és a timidint (T), és fordítva]. A kettős szálú DNS-ben lévő információt RNS-polimeráz segítségével írják át, mRNS-kópia képződik [vegye figyelembe, hogy míg a C/G, G/C és T/A kópiák fennmaradnak, mint a DNS-párokban, a T uridinné (U) ]. Az mRNS-en található AUG kodon a kezdőkodon (metionint is kódol). Az mRNS nukleotidszekvenciát aminosav-szekvenciává alakítják egymás melletti triplett kodonok (három egymást követő nukleotid) sorozatának „leolvasásával”. A legtöbb, de nem az összes aminosavat egynél több triplett kodon kódolja.
A sejtben lévő kis molekulák komplex halmaza képviseli metabolomját. A metabolom mérhető egy sejtben, szövetekben (agy, szív, vese, máj, izom, petefészek, here stb.) Vagy biológiai folyadékokban (szérum/plazma, vizelet, epe stb.). Ez függ a genomban elérhető génektől, a transzkriptómban expresszált génektől, az extracelluláris és intracelluláris vegyületeket a sejtmembránon át mozgató transzporterektől, valamint az enzimek egy sejten belüli katalitikus aktivitásától és szerveződésétől. A metabolom folyamatosan változik. A metaboloma elemeinek bizonyos tartományokon belüli fenntartását homeosztázisnak nevezzük. Egyes vegyületek esetében a normál tartomány nagyon szűk, például intracelluláris ATP (adenozin-trifoszfát). Mások számára, például a plazma glükóz, ez szélesebb. A glükóz esetében azonban van egy alsó határ, amikor a különböző mechanizmusokat alkalmazzák a glükóz ellátására és a homeosztázis fenntartására. Amikor a glükózszint étkezés után emelkedik, a hasnyálmirigyből felszabaduló inzulinból származó jelek hozzájárulnak a sejtek glükóztranszportjának növeléséhez, valamint glikogénként és zsírként történő tárolásához. A plazma állandóan magas glükózszintje az alacsony inzulinszekréció vagy az inzulinra való válaszképtelenség miatt a diabetes mellitus szövődményeihez vezet.
A szacharidok, zsírsavak és aminosavak mellett az emberi testnek szüksége van az étrend egyéb esszenciális vegyületeire, beleértve a vizet, vitaminokat és ásványi anyagokat. Az egyéb bioaktív élelmiszer-összetevőket, amelyek közül sok fitokemikália (növényi vegyszer), fontosnak tartanak az emberi egészség szempontjából. Így a teljes étrend az élelmiszer-összetevők összetett mátrixa, amelyet gyakran gyógynövényekkel, növényi anyagokkal és bioaktív komponenseket, valamint vitaminokat/ásványi anyagokat tartalmazó étrend-kiegészítőkkel egészítenek ki. Ennek a komplex mátrixnak a bemutatása jelenti a kihívást a dietetikus számára, aki nemcsak meghatározza azokat a tápanyagokat, amelyeket az egészséges étrend elkészítéséhez kombinálni kell, hanem számos tudomány ismeretein alapuló módszereket is megfogalmaz, amelyek biztosítják az egyes élelmiszerek biztonságos és ízesítését (a a közösség normái, amelyben működnek).
Genetikai variációk az emberekben
Tehát, ha az embereknek van egy adott génkészlete, miért nem vagyunk egyformák? És ha mindannyian egészséges étrendet fogyasztottunk, akkor miért nem vagyunk egységesen egészségesek? A válasz mindkét kérdésre az, hogy bár a Homo sapiens egy különálló faj, vannak különbségek az egyes genomjainkban. Jól ismertetett egygénes rendellenességek esetén bizonyos génekben különféle mutációk, deléciók és addíciók vannak, amelyek a belőlük származó fehérjék hiányához vagy diszfunkciójához vezetnek. Mivel minden szülő minden gén (egy allél) egy példányát hozzájárulja gyermekeihez, az esetek többségében (de nem mindig) mindkét allélnak működőképtelennek kell lennie ahhoz, hogy a társult állapot megnyilvánuljon.
A fehérjék mérettartománya széles
50 aminosav (pl. Inzulin)> 2500-ig (például zsírsav-szintáz - belépési szám> P49327 a http://www.expasy.org oldalon). Ezeket a fehérjéket 150 -> 7500 nukleotidot tartalmazó gének kódolják. Ennek megfelelően néhány génnek nincs SNP-je, míg másoknak több van. Azoknál az egyéneknél, akiknek SNP-je több génben van, az SNP-kombinációk száma korlátozott - az SNP-k megfigyelt blokkjait haplotípusoknak nevezzük, több kapcsolt lókuszon lévő allélek kombinációi, amelyeket együtt továbbítanak. Az SNP-k mintázata a genetikai öröklődés tükrözi, és bizonyos haplotípusok tipikusak lehetnek azokra, amelyek egy adott régióban találhatók. Mivel a hímek Y-kromoszómája csak egy példányban van jelen, rekombináció útján nem keveredik, és az SNP-k mintázata megalapozza az apai vérvonalat és az egyén patrilinealis őseinek földrajzi eredetét.
A tápanyagfüggő transzkriptóm
A transzkripcióban bekövetkező változások felmérésére mikroszkópos elemzést alkalmaznak. Míg a mikroray technológia jelentősen javult az elmúlt 10 évben, még mindig szenved túl drágán ahhoz, hogy legyőzze alkalmazásának fő korlátját - a replikátumok kis száma és a tesztelt paraméterek (gének) száma. A legjobb analitikai körülmények között a nullhipotézis alapján a kontroll és a kezelési csoport között várható eltérések száma (azaz nincs különbség), az α értéke 0,05 egy tömbnél, ahol 10 000 jellemző van (gén), 500. Ez a kérdés nem jellemző a mikroarray elemzésre - a proteomikus és metabolomikus elemzésekre is vonatkozik. A DNS-mikroszkópos adatok korai publikációi azokra a génekre összpontosultak, amelyek expressziója kétszeresen (felfelé vagy lefelé) változott. Ezek a paraméterek vezethettek olyan gének kiválasztásához, amelyek expressziója jelentősen megváltozik, de biológiai jelentőségük nélkül (17). A kulcskérdés az, hogy elegendő biológiai replikátum álljon rendelkezésre a varianciák kiszámításához. A mikroszkópos adatok egy másik módja annak meghatározása, hogy egy teljes útvonal érintett-e, ami segíthet azonosítani, hogy hol található egy kritikus gén vagy annak génterméke.
A valószínű igaz-pozitívak rendezésének másik módja a megfigyelt változások feltérképezése a sejt metabolikus, szintetikus és jelátviteli útvonalain. Ugyanazon az úton hasonló változások csoportja ésszerűen jelentősnek tekinthető. A mikroarray kutatás egyik fontos jellemzője a kísérlet minden aspektusának szabványosítása és rögzítése (18). Az ilyen kutatásokhoz lefektetett iránymutatások (a MIAME [Minimum Information About a Microarray Experiment] szabványok] (19) követésével a kutatók a nyilvánosan elérhető mikrorajz adatok (National Center for Biotechnology Information Gene Omnibus) (20) letölthetik a hasonló kísérletektől. amelyeket a kísérletükhöz szükséges statisztikai teljesítmény kiszámításához terveznek. Hasonlóképpen, a tápanyag által megváltoztatott gének és útvonalak statisztikai tesztjei megerősíthetők az adatkészletek kombinálásával. Ez a megközelítés még nem jött létre a proteomikában és a metabolomikában, de feltehetően ez ugyanúgy bekövetkezik, mint a mikroarray elemzésnél.
A tápanyag-gén kölcsönhatás időzítése
Diétás polifenolok és táplálkozási genomika
A polifenolok sokféle ehető növényből kerülnek az étrendbe. Az Alabamai Egyetem, a Birmingham Táplálék-Gén Interakció Központjának tevékenységei részeként három polifenolt (a szója izoflavon genisteinjét, a szőlőből származó stilbene transz-resveratrolt és a zöld tea epigallocatechin-3-gallátot) vizsgálnak. szerepek az emlőrák megelőzésében. A rágcsáló vizsgálatokból származó bizonyítékok azt sugallják, hogy a genistein (25) és a proantocianidinben gazdag szőlőmag-kivonat (26) kemopreventív hatása attól függ, hogy az állatok az elválasztás és a pubertás idején genisteinnek vagy szójának vannak-e kitéve. Az epidemiológiai adatok szerint a szója (tofu formájában) kitettség serdülőkorban kritikus fontosságú a szója jótékony hatása szempontjából az emlőrák kockázatának csökkentésében (27,28). A genisteinhez hasonlóan az étrendben (1000 ppm) a transz-rezveratrol patkányoktól születéstől az elválasztásig, majd 100 napos kortól 50% -kal csökkentette a rákkeltő anyagok által kiváltott emlődaganatok számát (29). Ezzel szemben az ivóvízben beadott epigallokatechin-3-gallátnak nem volt hatása ebben a modellben.
Polifenol-variabilitás és betegségmegelőzés
A szójabab többnyire daidzein, genistein és glicitein 6 ″ -O-malonil-glükozidjaiból áll (ebben a példában a genisteint mutatjuk be). A fermentáció a teljes glükózrész hasításához vezet, valamint hidroxilezésen megy keresztül a 6. és 8. pozícióban. A zúzott szójabab extrakciója n-hexánnal az olaj kinyerése nem változtatja meg az izoflavon összetételét. A szójaliszt pirításához való melegítés azonban CO2-veszteséget okoz a malonilcsoporttól, amely az izoflavont 6 ″ -O-acetil-glükoziddá alakítja. Ez a forró extrudálási módszerekkel előállított szójatermékek esetében is előfordul, például texturált növényi fehérje (TVP) vagy pörkölt termékek (SoyLife ™) esetében. A szójabab forró nyomáson történő extrahálása vízzel a szójatej előállításához a malonilcsoport hidrolíziséhez vezet, az izoflavonokat egyszerű glükozidokká alakítva. A teljes zsírtartalmú szójatejből készült termékek ilyen összetételűek. Egyes szójatermékeket nagyon lágynak terveztek, és forró vizes etanollal kezelt szójalisztből készülnek. Ez az oldószer extrahálja az izoflavonokat, így ezek a termékek lényegében izoflavonmentesek.
Polifenolok és dietetikák
A polifenolban gazdag étrend összhangban áll a gyümölcsök és zöldségek napi 8–10 adagjára vonatkozó ajánlásokkal, amelyeket mind a Betegségmegelőzési és Megelőzési Központ (44), mind az Országos Szív-, Tüdő- és Vérintézet (45) ajánl. Az izoflavonok a szójabab és a szójaételek fő polifenoljai; a proantocianidinek kiemelkedőek az almában, a szőlőben és sok bogyóban; a katechinek (flavanolok) teákban vannak, különösen a zöld teában; a resveratrol a mogyoróban és a szőlőhéjban található. Ezeknek az ételeknek az egészséges és ízletes étrendbe történő integrálása elérhető. 2007-ben a gyorséttermek és az iskolák gyümölcsök és saláták alternatíváit kezdték biztosítani a mindenütt jelenlévő francia sütéseknél. Ez válaszul az elhízás tudatosságának fokozására és a lakosság táplálkozással kapcsolatos viselkedésének változásaira vezethet be.
Következtetések és kihívások a táplálkozási genomikában
A táplálkozási genomika leírásának kibontakozásával az válik világossá, hogy számos dimenzióból áll - a genomból, a gének komplementeréből és azok mutációiból, amelyek expresszálhatók, a transzkriptómból (fehérjét kódoló és nem fehérjét kódoló RNS-ekből), a proteom (primer polipeptidek, ezek poszttranszlációs módosításai és fehérjekomplexei), az epigenom (metilált DNS, metilált és acetilezett hisztonok), a metabolom (a kis endogén molekulák, amelyek energiát teremtenek és komplex bioaktív köztitermékek, köztük lipidek, komplexek szintézisére szolgálnak) szénhidrátok, fehérjék és nukleinsavak), a nutribiome (élelmiszer eredetű xenobiotikumok) és a xenobiome (egyéb vegyületek, amelyek a testen kívülről származnak - beleértve a szennyező anyagokat is). Mindezen változók elemzése jelentős kihívást jelent a kutató számára.
Ami a populációk, génjeik és a velük kölcsönhatásban lévő étrend tényezőinek összes vizsgálatát illeti, a túlteljesítés fő akadálya, hogy elegendő statisztikai erővel kell rendelkezni ahhoz, hogy határozott következtetéseket lehessen levonni. A kutatóknak elég nagy vizsgálati csoportra van szükségük a statisztikai követelmények kielégítésére, és elegendő támogatási támogatásra van szükségük az ilyen nagy vizsgálatok elvégzéséhez. A megfelelően hajtott klinikai vizsgálatok elvégzésének képessége még az USA-ban és a legrangosabb intézményekben is problémát jelent. Koushik és mtsai. (46) az ápolók egészségügyi tanulmányából és az egészségügyi szakemberek nyomon követési tanulmányainak kohorszából összegyűjtött adatok felhasználásával 376 vastagbélrákban szenvedő férfival és nővel és 849 kontrollalanyon végzett vizsgálat során mutatták ki, hogy az MTHFR 677TT genotípusú betegek a vastagbélrák kockázatának csökkenése (esélyhányados 0,66; 95% -os konfidenciaintervallum, 0,43–1,00), de nem tudta felismerni a kapcsolatot az étrendi metil-státussal. Arra a következtetésre jutottak, hogy munkájukból hiányzik a szükséges statisztikai erő.
A tápanyag-gén kölcsönhatás az egész világon a közegészségügyi politika fontos részévé válik, mivel minden ország a megelőzés stratégiáin keresztül törekszik a leghatékonyabban biztosítani népei egészségét és termelékenységét. Ennek megfelelően a táplálkozási genomikában jártas nyomozók csoportja 21 különböző országból és 5 kontinensről nemzetközi szövetséget szorgalmazott a legfontosabb kérdések megválaszolására (47). A táplálkozási genomika kutatásának koordinálását az Európai Táplálkozási Genomikai Szervezet (48) és a Táplálkozási Genomikai Társaság (49) biztosítja. Amit ezek a csoportok terveznek, az a táplálkozási genomika legfontosabb kérdéseinek kooperatív, multinacionális vizsgálata. Ezt alaposan megvitatták egy 2007-es konferencián: „Kik vagyunk és mit eszünk: A metabolizmus és a táplálkozási genomika szerepe az egészséges ételek és az egészséges életmód létrehozásában” (50) címmel. Ez az együttműködés analóg a binokuláris látás vagy a nagy elrendezésű rádióteleszkópok által nyújtott előnyökkel. A táplálkozási genomika projektjeinek megalkotása, végrehajtása és elemzése azonban nemzetközi szabványoktól függ. Egyelőre folyamatban lévő munka.
Köszönetnyilvánítás
Az UAB Center for Nutrient-Gene Interaction in Cancer Prevention támogatást az Országos Rákkutató Intézet támogatásával nyújtja (U54> CA100949, S. Barnes, PI). A botanikumok és étrend-kiegészítők kutatásának támogatását a Purdue Egyetem-Alabamai Egyetemen, a Birminghami Botanikai Központ az életkorral összefüggő betegségekkel kapcsolatban az Országos Kiegészítő és Alternatív Gyógyászati Központ támogatásával (P50 AT00477, Connie M. Weaver, PI) nyújtják. és az NIH Étrend-kiegészítők Irodája. Ruth DeBusk által a kézirat írása során nyújtott szerkesztőségi tanácsokat melegen értékeljük.
Lábjegyzetek
Kiadói nyilatkozat: Ez egy szerkesztetlen kézirat PDF-fájlja, amelyet kiadásra elfogadtak. Ügyfeleink számára nyújtott szolgáltatásként a kéziratnak ezt a korai változatát biztosítjuk. A kézirat átmásolásán, szedésén és a kapott bizonyíték felülvizsgálatán átesik, mielőtt a végső hivatkozható formában közzétennék. Felhívjuk figyelmét, hogy a gyártási folyamat során olyan hibákat fedezhetnek fel, amelyek befolyásolhatják a tartalmat, és a naplóra vonatkozó minden jogi felelősségvállalás vonatkozik.
- Parazita helminták és azok jótékony hatása az 1. és 2. típusú cukorbetegségre - Berbudi - 2016 -
- Az átlagos felnőtt életében megpróbálja ezt a sokkoló étrendet
- Szociális, demográfiai és magatartási tényezők, valamint azok hatása az 5 éves túlélésre az időskorú személyekben
- Táplálék-kiegészítők A nagy hatású cikkek listája PPts folyóiratok videók
- Növényi étrend szempontjai a környezeti hatással, a fehérje minőségével és az edzés teljesítményével kapcsolatban