Tardív diszkinézia
A tardív dyskinesiák (TD) tartós és gyakran visszafordíthatatlan akaratlan mozgások, amelyek hosszan tartó neuroleptikus terápia után jelentkeznek (Sethi, 2004).
Kapcsolódó kifejezések:
- Clozapine
- Parkinsonizmus
- Tipikus antipszichotikum
- Diszkinézia
- Sztereotip mozgászavar
- Disztónia
- Dopamin
Letöltés PDF formátumban
Erről az oldalról
A diszkinézia kórélettana, farmakológiája és biokémiája
Diederik E. Tenback, Peter N. van Harten, a Neurobiology International Review-ban, 2011
IV. Következtetés
A dopamin blokkolókkal kezelt diagnosztikailag kevert populációkban a TD eltérhet az antipszichotikus naiv, szkizofréniában szenvedő betegeknél a spontán dyskinesiától. A dopamin D2 receptorhoz kisebb affinitású SGA korszakában a TD előfordulása általában alacsonyabbnak tűnik, de továbbra is klinikai aggodalomra ad okot, különösen azért, mert rosszabb klinikai eredménnyel járhat.
A TD előfordulási aránya továbbra is magas, még antipszichotikus naiv betegeknél is, és arra utal, hogy a dopamin blokkolóknak a Dopamine D2 receptorhoz nagy affinitással történő átállítása a D2 receptorhoz kisebb affinitású blokkolókra javíthatja a TD tüneteit. Nem világos, hogy ez a klinikai eredményt is javítja-e.
Nagy mennyiségű szakirodalom található a TD kockázati tényezőiről. Kevés a „kemény” kockázati tényező. Az életkor, a korai EPS és az etnikai hovatartozás valószínű kockázati tényező a TD számára. Van néhány ígéretes gén, amely összefüggést mutat a TD-vel. Ezek a gének vagy a megnövekedett dózishoz kapcsolódnak, amely a káros anyagcseréhez kapcsolódik, vagy hipotézisekhez kapcsolódik a TD patofiziológiai alapjait illetően. Bizonyos óvatossággal kell eljárni, mert ezek keresztmetszeti asszociációk, amelyekről az irodalomban beszámoltak, és nem különböztetik meg a TD megjelenése és tartóssága keverékét.
A TD továbbra is érdekes terület a klinikusok és a kutatások számára, különösen a pszichiátria területén, ahol ez egyike azon kevés tüneteknek, amelyek objektíven mérhetők.
Tardív diszkinézia és egyéb gyógyszerekkel kapcsolatos mozgászavarok
Természettörténet és járványtan
A TD egy változó betegség, de rengeteg adat arra utal, hogy annak természetét anélkül befolyásolhatja a körültekintő neuroleptikus kezelés. A TD feloldódhat, ha a neuroleptikumokat a diagnózis felállítása után azonnal abbahagyják, vagy a TD enyhítheti a neuroleptikus dózis csökkentésével, amely gyakran megvalósíthatóbb alternatíva a klinikai körülmények között. Hosszú távú vizsgálatokban a TD klinikai javulásának valószínűsége korrelál a gyógyszer nélküli időtartammal, vagy pedig a követés időtartamával. Több mint 5 év elteltével az eredményeket vizsgáló tanulmányok mutatják a legnagyobb számot klinikai javulás mellett. Ezen optimista nézetek ellenére a TD egyes esetei a végtelenségig fennállnak, és idővel súlyosbodhatnak.
Az 1980-as években általában egyetértettek abban, hogy a pszichiátriai betegek körében a TD prevalenciája 20% -os. Gardos és Cole becslése szerint a TD kialakulásának kockázata egy skizofrén betegben, amelyet neuroleptikumokkal kezeltek 1 folyamatos éven keresztül, körülbelül 5% volt. Kane és mtsai. 4 éves kezelés után 20% -os kumulatív gyakoriságot idézett (nagyjából évi 5%, Gardos és Cole egyetértésével).
Újabban a figyelem a TD kialakulásának valószínűségével kapcsolatos kérdésekre terelődött át a négy FDA által jóváhagyott atipikus antipszichotikum egyikének kezelésével: klozapin, risperidon, olanzapin és kvetiapin. Kane 28 beteget követett, akik legalább 1 évig kaptak klozapint. Két betegnél, akik mindketten korábban tipikus neuroleptikumokat szedtek, a klozapin enyhe TD-t mutatott. 122 risperidonnal és haloperidollal kezelt idősebb felnőttek (mindegyik csoportban 61) prospektív vizsgálata arra a következtetésre jutott, hogy a TD kockázata lényegesen kisebb volt a risperidonnál; életciklus-elemzést alkalmaztak 9 hónapos megfigyelési időszak alapján. Egy nagy, kettős-vak, prospektív vizsgálatban, amelyben összehasonlították az 1 éves olanzapin-kezelést a haloperidol-kezeléssel, az olanzapin-csoportban a TD-kockázat tizede volt a haloperidol-csoportétól, és becslések szerint az olanzapin-kezelés során a TD éves kockázata kisebb volt mint 1%. A kvetiapin-kezelés alatt a TD esetjelentését közzétették, de szisztematikus adatok egyelőre nem állnak rendelkezésre. Összefoglalva, a TD még mindig előfordulhat atipikus antipszichotikumokkal történő kezelés során, de a valószínűség lényegesen kisebbnek tűnik, mint azt tipikus antipszichotikumokkal jelentették.
Kábítószer okozta mozgászavarok
JOSEPH H. FRIEDMAN, HUBERT H. FERNANDEZ, a mozgászavarok állatmodelljeiben, 2005
A. Klasszikus tardív diszkinézia
A TD-t először 5 éven belül írták le, miután az első DRBA, a klórpromazin széles körben elérhetővé vált az 1950-es években [71]. A tardív diszkinézia kifejezést Faurbye és mtsai először 1964-ben hozták létre. aki hangsúlyozta a krónikus expozícióval megnövekedett TD előfordulását [72]. A klasszikus TD-t arra a TD-re használják, amely gyors, ismétlődő, sztereotip mozgásokkal jár, amelyek magukban foglalják a szájüreget, a szájüreget és a nyelvet. Ritmikus choreának és tardív sztereotípiának is nevezték, inkább ismétlődő, mint véletlenszerű jellege miatt [73].
A TD a DRBA-k - elsősorban a pszichózis kezelésére használt gyógyszerek - krónikus expozíciójának eredménye. A dopamincsökkentőkkel (pl. Reserpin) nem számoltak be TD-ről, és atipikus antipszichotikus gyógyszerekkel kapcsolatban ritkán jelentettek. Néhány hányinger (pl. Metoklopramid vagy proklorperazin) és depresszió (például amoxapin) elleni gyógyszerek valójában DRBA-k, és ezért TD-t okozhatnak (3. táblázat).
3. TÁBLÁZAT Kábítószer-szindrómát okozó gyógyszerek
Amoxapin (triciklusos antidepresszáns)
Cinnarizin (kalciumcsatorna-blokkoló)
Flunarizin (kalciumcsatorna-blokkoló)
A soha nem gyógyszeres skizofrén betegeknél előforduló TD-szerű mozgások felvetik azt a kérdést, hogy a TD-t kizárólag DRBA-knak tulajdonítják-e, vagy a skizofrénia megnyilvánulása-e [75, 76], amelyet valószínűleg a DRBA leplezett le. Ez utóbbi alternatív hipotézis legfőbb aggodalma a neuroleptikus mentes expozíciós jelentések pontossága és a TD diagnózis pontossága. Videokazetta-bemutatók nélkül nehéz lenne meghatározni, hogy ezek valójában oromandibularis disztónia, edentuláris diszkinézia, Huntington-kór, sztereotípiák stb. hányinger.
A TD előfordulási gyakorisága és prevalencia aránya a populációtól, a vizsgálat felépítésétől és az alkalmazott diagnosztikai kritériumoktól függően nagyban változik. Az éves előfordulási arány a fiatalabb népesség (átlagéletkor, 28 év) 5% -ától [77] az idősebb csoportban (átlagéletkor, 56 év) 12% -ig terjed [78]. A hagyományos antipszichotikus korszakban a neuroleptikumokkal kezelt betegek legalább 20% -át érintette TD, és körülbelül 5% -uknál minden évben neuroleptikus kezelés alakult ki [79]. 5 év után azonban a prevalencia stabil marad, mert a remissziós arányok kiegyenlítik az incidencia arányát [80].
Az elmúlt 2 évtized során jelentős változások történtek a skizofrénia kezelésében, elmozdulás a járóbeteg-ellátás és az atipikus antipszichotikus szerek alkalmazása felé, amelyek állítólag kevesebb extrapiramidális mellékhatást okoznak. A skót Nithsdale-ban (1999–2000) végzett skizofrén betegek mozgásszervi megbetegedéseinek gyakoriságáról szóló tanulmány 1999–2000-ben azt mutatta, hogy 136 beteg közül a TD prevalenciája 43%, a parkinsonizmusé 35%, az akathisiaé pedig 15% volt. [81]. A TD-vel kimutatott betegek 52 százaléka csak atipikus antipszichotikus szereket kapott; azonban sokan korábban is szedtek neuroleptikumokat. Így az atipikus antipszichotikus szerek bevezetése ellenére a TD továbbra is problémát jelent.
Az életkor a legkonzisztensebb kockázati tényező a TD számára. Magasabb incidenciát és alacsonyabb remissziós arányt figyeltek meg az idősebb betegeknél, különösen a nők körében [77, 82, 83]. Egyéb állítólagos kockázati tényezők közé tartoznak az affektív rendellenességek, a gyenge kezelési válasz, a korábbi agykárosodás, a nagyobb teljes gyógyszer-expozíció, a meglévő parkinsonizmus és az alkoholizmus [84, 85]. Az olyan tényezőket, mint a gyógyszer időtartama, a neuroleptikus szer típusa és a gyógyszermentes intervallumok, nehéz korrelálni a TD komplex természeti története és a gyógyszer pontos rögzítésének nehézsége miatt.
A TD természetét nem könnyű meghatározni, mert a TD-t okozó DRBA-k is hajlamosak elnyomni. Tanulmányok kimutatták, hogy a TD természetes lefolyása fennmarad [86], általában javulni fog [87, 88], vagy kiszámíthatatlan a lefolyása [89]. A követés változó hossza és a vizsgálati populációk különbségei magyarázhatják a TD-tanfolyam változékonyságát [90]. A kiindulási TD-vel rendelkező és anélkül szenvedő alanyok bevonásával végzett vizsgálatok az átlagos TD-értékelési pontszám növekedését mutatták, mivel az új TD-esetek száma felülmúlta a TD javulását azok között, akiket az első értékelés már érintett. A tanulmányok többségében csak olyan alanyokat vontak be, akiknél a kiinduláskor TD volt, és azt mutatták, hogy a TD általában javul vagy csökken. Egy tanulmány, amelyben 53 pszichiátriai fekvőbeteget vizsgáltak nagy dózisú, hosszú távú neuroleptikumokkal, 14 év után átértékelték, az AIMS pontszám átlagban 4,0 pontos javulást mutatott. 53 betegből harmincháromban teljesen megszűnt a TD. Ugyanakkor a parkinsonizmus jelentősen súlyosbodott, az extrapiramidális jelek besorolásának skálája átlagosan 3,5 ponttal nőtt, ami arra utal, hogy a TD-t elfedik [91].
Bár állatmodellek szerint bizonyított, hogy a dopaminreceptorok krónikus blokkolása fokozott receptorérzékenységhez vezet [92, 93], humán vizsgálatok ezt még soha nem találták meg.
A TD jelöltgén-vizsgálataival kapcsolatos legérdekesebb és következetes eredmények a dopamin D3 receptor génre (DRD3) összpontosultak. Számos csoport összefüggést jelentett a DRD3 gén 1. exonjában a szerin-glicin polimorfizmus és a TD között. Pontosabban, mindegyik csoport azt találta, hogy vagy a glicin/glicin genotípus, vagy a glicin allél magasabb kockázatot jelent a TD-hez képest a szerin/szerin homozigótákhoz képest. Az egyik tanulmány az ilyen típusú homozigozitás magas gyakoriságát (22–24%) találta meg a TD-ben szenvedő betegeknél, összehasonlítva e genotípus relatív alulreprezentációjával (4–6%) TD nélküli betegeknél [94]. Ez magyarázatot adhat a TD-re való hajlamra egyes betegeknél.
A DRBA hatása nem korlátozódhat a dopaminerg rendszerre. Más neurotranszmitterek, például GABA és noradrenalin is érintettek. Az oxiradikumok is érintettek [95, 96]. Ez azon az elgondoláson alapszik, hogy a DRBA-k növelik a dopaminforgalmat, ami megnövekedett hidrogén-peroxid szintézist eredményez, amely oxiradikálisokat képez, amelyek károsítják a sejtkomponenseket.
A TD megelőzésének egyetlen módja az etiológiai szerek elkerülése. A DRBA nem alkalmazható nem pszichotikus rendellenességek, például szorongás esetén. A DRBA hosszú távú használatát a lehető legnagyobb mértékben korlátozni kell. A betegeket figyelmeztetni kell a TD-szindróma kockázatára, mielőtt 3 hónapot meghaladó fenntartó kezelésre kerülnének a gyógyszerre. A neuroleptikus terápia szükségességét rendszeresen felül kell vizsgálni, hogy a TD jelei vannak-e vagy sem. A kívánt hatás eléréséhez szükséges legalacsonyabb szinten kell tartani, és a lehető leghamarabb vissza kell vonni. Az atipikus antipszichotikumok közül a klozapin, az olanzapin és a kvetiapin esetében a legkisebb a TD előfordulási gyakorisága, és általánosságban nem számoltak be róla, hogy meggyőzően közölnék TD-t okozó betegek között, akik soha nem voltak kitéve más neuroleptikumoknak. Az újabb atípusos anyagok, például a ziprazidon és az aripiprazol alkalmazására vonatkozó hosszú távú epidemiológiai adatok nem állnak rendelkezésre.
A diszkinézia kórélettana, farmakológiája és biokémiája
Peter N. van Harten, PhD, Diederik E. Tenback, PhD, a Neurobiology International Review-ban, 2011
D Kolinerg gyógyszeres kezelés
A TD tartalmazhat központi kolinerg hiányt. Ezért kolinerg gyógyszereket (arekolin, kolin, deanol, lecitin, meclofenoxát, fizosztigmin, RS 86, takrin, metoxitakrin, galantamin, ipidakrin, donepezil, rivasztigmin, eptasztigmin, metrifonát, xanomeline, cevimeline) alkalmaztak a TD kezelésére. A kolinerg gyógyszereket tartalmazó RCT-k egyike sem mutatott jelentős jótékony hatást a TD-re. A legtöbb vizsgálat mintanagysága azonban kicsi volt (5–20), és az új kolinerg Alzheimer-gyógyszereket még nem tesztelték (Tammenmaa et al., 2004).
Agy stimulálása
Mély agyi stimuláció tardív diszkinézia esetén
A tardív dyskinesia (TD) krónikus hiperkinetikus rendellenesség, amely ritkán követheti a dopamin blokkoló gyógyszerek beadását. Leggyakrabban az orofacialis izomzatot érinti. A közelmúltban végzett multicentrikus, vak vizsgálat a bilaterális pallidális DBS-ről 10, gyógyszeres kezelésre refrakter TD-ben szenvedő betegnél több mint 50% -os csökkenést mutatott az önkéntelen mozgásokban, mind az Extrapyramidal Symptoms Rating Scale (ESRS), mind az Abnormal Involuntary Movement Scale (AIMS) skálán. 6 hónappal a beültetés után (Damier et al., 2007). Ez a tanulmány általában megerősítette a korábbi esetjelentések ígéretes eredményeit (Eltahawy et al., 2004; Schrader et al., 2004). Így a pallidális stimuláció kezelési lehetőségnek tekinthető súlyos, régóta fennálló TD-ben szenvedő betegeknél. A DBS egyéb DBS-célkitűzéseit nem tárták fel.
Ginkgo biloba kivonatok a neurológiai rendellenességek terápiájában
Tardív diszkinézia
A diszkinézia kórélettana, farmakológiája és biokémiája
I. Bevezetés
A tardív diszkinézia (TD) súlyos mellékhatás, amelyet alkalmanként tapasztalhatnak antipszichotikus gyógyszerekkel kezelt skizofrén betegek. Jóllehet a prevalencia arányokat nehéz megbecsülni, és állítólag különböznek a vizsgálatok között, egy metaanalízis, amelybe 76 vizsgálatból 39 187 személy vett részt, 24,2% -os általános prevalenciát talált (Yassa és Jeste, 1992). A TD legjellemzőbb jele az akaratlan orofacialis dyskinesia, de a törzs és a végtagok is érintettek lehetnek. A TD-t általában antipszichotikumok okozzák, különösen az első generációs antipszichotikumok (FGA-k), de néha a második generációs antipszichotikumok (SGA-k) is. Bár számos SGA-t fejlesztettek ki és egyre inkább alkalmaznak, az FGA-kat még mindig széles körben írják elő olyan tényezők miatt, mint például az antipszichotikum két generációjának hatékonyságában mutatkozó jelentős különbségek hiánya (Lieberman, 2007), az SGA-k mellékhatásai (mint pl. metabolikus szindróma), és az FGA-k alacsonyabb beszerzési költségei.
A TD okait multifaktoriálisnak tekintik; sokféle demográfiai okot javasolnak, beleértve az életkorot, a nemet, az adagolást, az etnikai hovatartozást és az antipszichotikumoknak való kitettség időtartamát, és számos patofiziológiai okot is javasoltak, amelyek közül egyiket sem tekintették meggyőzőnek. Számos biológiai mechanizmust javasoltak a TD patofiziológiájának hátterében, beleértve a dopamin receptorok túlérzékenységét (Tarsy és Baldessarini, 1977), a szerotonerg diszfunkciót (Meltzer, 1994), a γ-aminovajsav (GABA) elégtelenségét (Casey és mtsai, 1980) és az antioxidáns védelem zavarai (Andreassen és Jorgensen, 2000). A TD kóros fiziológiája azonban még mindig kevéssé ismert.
Számos tanulmány bizonyítékot szolgáltatott arra, hogy a TD genetikai és családi okokkal jár. Konkrétan azt találták, hogy a TD csak néhány antipszichotikumot szedő páciensnél fordul elő, és hogy ezek az események családi hajlamot mutatnak, ami biológiai vagy genetikai tényezőt jelez (Tamminga et al., 1990; Yassa és Ananth, 1981). Ez a háttér a TD sok genetikai vizsgálatát ösztönözte, amelyek főleg az antipszichotikumok farmakogenetikai vizsgálatait tartalmazzák. Egy másik ok, amiért sok tanulmány megvizsgálta a TD farmakogenetikáját, az az, hogy a TD a potenciálisan irreverzibilis mellékhatás, és nagyon nehéz megjósolni, hogy kit fog befolyásolni. Ezenkívül a TD súlyos szenvedést okoz a betegekben, és a farmakoterápia be nem tartásához vezet. Az e mellékhatásra való genetikai érzékenység részleteinek tisztázása lehetővé tenné a genotipizálás és a biomarker-vezérelt előrejelzés utáni receptírást (Ozdemir et al., 2006). A jövőben lehetővé válik a TD kialakulásának valószínűségének kiszámítása bizonyos kapcsolódó változók (azaz gének és demográfiai paraméterek) jelenlétének figyelembevételével. Ezenkívül a TD farmakogenetikai vizsgálata hozzájárul a rendellenes dyskinetikus mozgás és mozgászavarok mögött álló genetikai mechanizmus felfedezéséhez.
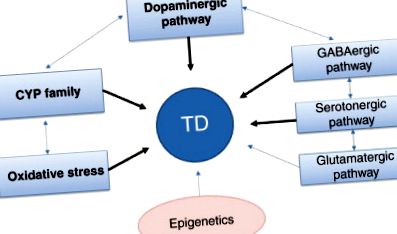
A jelölt gének, amelyekről feltételezik, hogy meghatározzák a TD iránti érzékenységet, a citokróm P450 (CYP), a sokféle neurotranszmitter és az oxidatív stresszel kapcsolatos gének. A gyógyszeres válasz nagyon szorosan kapcsolódik a gyógyszer anyagcseréjéhez, és a CYP géneket alaposan megvizsgálták. Ezenkívül a neurotranszmitterrel kapcsolatos géneket, különös tekintettel a dopaminnal és a szerotoninnal kapcsolatos génekre, lényegesen tanulmányozták, mivel ezeket a neurotranszmittereket az antipszichotikumok célpontjának tekintik. Az oxidatív stresszel kapcsolatos gének több közelmúltbeli tanulmánya bizonyítékot szolgáltatott a TD és az oxidatív stressz közötti kapcsolatra. Ezenkívül számos farmakogenetikai tanulmány vizsgálta a neurotróf faktorokkal, az opioid receptorokkal, az ösztrogén receptorokkal, a GABA útvonallal és a glutaminerg útvonallal kapcsolatos géneket. Az 1. ábra hipotetikus genetikai tényezőket mutat be, amelyek hozzájárulnak a TD-hez.
1. ábra . A TD-hez hozzájáruló genetikai tényezők. A félkövér nyilak azt mutatják, hogy több tanulmány is megismételte a bizonyítékokat. TD, tardív diszkinézia; CYP, citokróm P450. GABA, gamma-amino-vajsav
- Nephrolithiasis - áttekintés a ScienceDirect témákról
- Nephrosclerosis - áttekintés a ScienceDirect témákról
- Skinfold - áttekintés a ScienceDirect témákról
- Nátriummérleg - áttekintés a ScienceDirect témákról
- Pihenő energiaköltségek - áttekintés a ScienceDirect témákról