Új eredmények a nukleáris gangliozidokkal kapcsolatban: áttekintés az anyagcseréről és a működésről
Neurológiai és Idegtudományi Tanszék, New Jersey Medical School, UMDNJ, Newark, New Jersey, USA
Neurológiai és Idegtudományi Tanszék, New Jersey Medical School, UMDNJ, Newark, New Jersey, USA
Neurológiai és Idegtudományi Tanszék, New Jersey Medical School, UMDNJ, Newark, New Jersey, USA
Neurológiai és Idegtudományi Tanszék, New Jersey Medical School, UMDNJ, Newark, New Jersey, USA
Absztrakt
J. Neurochem. (2011) 116, 714–720.
Absztrakt
Használt rövidítések:
A gangliozidok, a glikoszfingolipidek sziálsavat tartalmazó alcsoportja a nukleáris burok (NE) jól megalapozott alkotóeleme, amelyek funkciója ezen a lokuszon fokozatosan egyre jobban megért. A lipidek összességében a mag viszonylag kis részét (~ 5 tömeg%) teszik ki, ami a korlátozott hitelességnek tudható be, és eredetileg azt a javaslatot adta, hogy funkciójuk meghaladhatja a strukturális támogatást. Számos laboratórium munkája az elmúlt években megalapozta a lipidek ma már elismert szerepét, mint fő jelátviteli szubsztrátumot a magban, amint azt a legutóbbi áttekintések összefoglalták (Tamiya ‐ Koizumi 2002; Irvine 2003; Albi és Viola Magni 2004; Ledeen és Wu 2006). Kimutatták, hogy a GM1, az ÉK egyik fő gangliozidjának fő szerepe a Ca 2+ -szabályozásra összpontosít egy Na +/Ca 2+ -cserélő (NCX) potencírozása révén oly módon, hogy az befolyásolja a citoszolos Ca 2+ -ot is. ÉK-ban és a nukleoplazmában (áttekintésre: Ledeen és Wu 2007). Kimutatták, hogy a GD1a, az ÉK másik fő gangliozidja a GM1 prekurzoraként funkcionál a membránhoz kötött neuraminidázzal (N’ase) reagálva, amely ÉNy-i gangliozidokkal (Wang et al. 2009). Ez az áttekintés megkísérli összefoglalni ezeket a megállapításokat, és figyelembe veszi ezeket a nukleáris alkotóelemek által biztosított citoprotektív mechanizmusok tágabb összefüggésében.
Gangliozidok és a sejt neuraminidáza
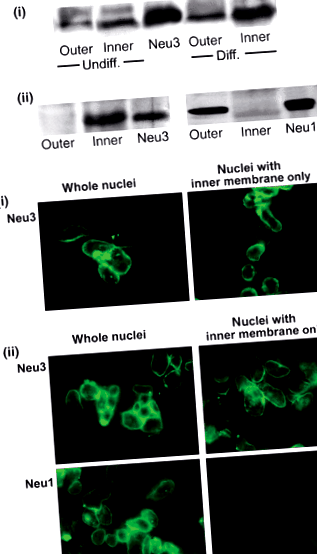
Az NE ezen vizsgálatai során feltárt másik fő gangliozid a GD1a volt, a GM1 neuraminidáz-reaktív prekurzora, amely valójában nagyobb volt, mint az utóbbi. A GD1a egyik fő funkciója a GM1 tartalék prekurzorának mutatkozott, ezt az átalakulást az N’ase (szialidáz) enzim katalizálta, amely szintén kimutatták, hogy ÉK-ban (Saito) et al. 1996). További tanulmányok bizonyították az N’áz jelenlétét az ÉK mindkét membránjában, a Neu3 izoform a burkolat belső és Neu1 külső burkolatában jelenik meg (Wang et al. 2009) (1. ábra). Ezeket a megállapításokat megkönnyítette a két membrán elválasztása Gilchrist és Pierce (1993) eljárása szerint, amely kezünkben a belső és a külső membrán meglehetősen tiszta készítményeit adta. A Neu3 az az izoform, amelyről korábban kimutatták, hogy a plazmamembránban fordul elő, és specifikusan reagál a gangliozidokkal (Miyagi et al. 1999; Monti et al. 2000), míg a Neu1 eredetileg lizoszomális eredetű volt, és később kimutatták, hogy a plazmamembránban is előfordul (Liang et al. 2006); aktivitást mutatott mind a gangliozidokkal, mind a glikoproteinekkel szemben (Pshezhetsky és Ashmarina 2001). Vizsgálatunk kimutatta, hogy az N’ase mindkét helyen képes volt katalizálni a GD1a GM1-vé (Wang et al. 2009). Ezek az eredmények a 2. ábrán bemutatott Neu1 és Neu3 orientációját sugallják.
A neuraminidáz izoformák azonosítása a mag burkolatában. a) Western-blot elemzés. Az i. Panel, a differenciálódott (Diff.) És a differenciálatlan (Diff.) NG108-15 sejtek külső és belső NE membránjait immunoblot vizsgálatnak vetettük alá anti-egér Neu3 Ab alkalmazásával. A Neu3 szabvány látható. A Neu3 festés szignifikánsan nehezebb volt a belső-, mint a külső membránhoz képest, és a differenciálódott és a differenciálatlan magokhoz képest. A (ii) panel, a differenciálatlan SH ‐ SY5Y sejtek NE membránjait a fentieknek megfelelően immunoblot elemzésnek vetettük alá anti-humán Neu3 és Neu1 alkalmazásával. A Neu3 és a Neu1 szabványok láthatók. Az eredmények azt mutatják, hogy a Neu3 az SH-SY5Y sejtek NE belső NE- és külső membránjában expresszálódik. b) Immunocitokémiai elemzés. A differenciálódott NG108-15 sejtekből izolált magokat (i panel) és a differenciálatlan SH-SY5Y sejteket (ii panel), amelyeket citráttal kezeltünk vagy nem kezeltünk az ONM eltávolítása érdekében, anti-humán Neu3 és Neu1 Abs-vel festettük, majd megfelelő 2. Abs kapcsolódik a FITC-hez. A Western blot analízissel összhangban ezek az eredmények azt mutatják, hogy a Neu3 az INM-ben és a Neu1 az ONM-ben. Újranyomtatták Wang engedélyével et al. (2009) a J. Neurochem.
A GM1, a neuraminidáz (Neu1, Neu3) és a Na +/Ca 2+ cserélő (NCX) javasolt topológiája a mag burkolatában (NE, a) és a plazmamembránban (PM, b). Mindkét esetben az 5 és 6 transzmembrán egységek közötti nagy hurok az alacsony Ca 2+ oldalon helyezkedik el, azaz a PM esetében a citoplazma és NE esetében a nukleoplazma. Ez összhangban áll a GM1 és az NCX bizonyított elhelyezkedésével az NE belső membránjában (INM) és a nagy NCX hurok előfordulásával a GM1 oligoszacharid lánc közelében. Javasoltuk, hogy a GM1 és az NCX nagy affinitású asszociációja a N‐Acetil-neuraminsav a GM1-ben, kölcsönhatásban áll az NCX hurok alternatív toldási régiójával (ASR), amelynek egyes izoformái pozitív töltésű aminosavakban dúsulnak. Ilyen asszociáció a PM esetében nem lehetséges, mivel az NCX hurok és a GM1 oligoszacharid a membrán ellentétes oldalán fordul elő. A Neu1 a külső magmembránban (ONM), a Neu3 pedig az INM-ben található. A PM köztudottan tartalmaz Neu3-at, de csak alkalmanként Neu1-et. Részben reprodukálva Ledeen és Wu (2007) felhasználásával J. Neurochem.
Az endonukleáris domének tekintetében a heterokromatin az egér hámsejtjeiben bizonyította a GM1 jelenlétét, amelyet mind a CtxB, mind az anti-GM1 Ab (Parkinson et al. 1989). A β-amiloid peptidnek kitett patkány agykérgi neuronok immunocitokémiai vizsgálata alapján a GD3 heterokromatinban is előfordult (Copani et al. 2002). Ez a viszonylag feltáratlan terület nyilvánvalóan szisztematikus vizsgálatra szorul.
GM1 kölcsönhatás Na +/Ca 2+ cserélővel
Az észak-északi GM1 funkcióval kapcsolatos fontos nyomra derült fény azzal a felfedezéssel, hogy ez a gangliozid nagyon szoros kapcsolatban fordul elő egy Na +/Ca 2+ cserélővel (NCX) (Xie et al. 2002). Ezt a nagy affinitású asszociációt az NE-kivonat anti-NCX Ab immunprecipitációjával, majd immunoblot-analízissel mutattuk ki, amely azt mutatta, hogy a GM1 a nátrium-dodecil-szulfát – poliakrilamid gél elektroforézis során kapcsolatban marad az NCX-szel. Ez az eljárás általában csak a ritka kivételektől elkülöníti a lipideket a fehérjéktől, például GM1 kötődése az ideg növekedési faktorához (Mutoh et al. 1995). Az NE NCX izoformái nyilvánvalóan abban különböztek a plazmamembránban lévőktől, hogy az utóbbiak egyike sem maradt kapcsolatban a GM1-gyel. Az eredmények szerint a GM1 lazábban kapcsolódhat egy vagy több NCX izoformához az adott lokuszon. Az NCX splice-alapú izoformáinak létezését leírták (Kofuji et al. 1994; Ő et al. 1998).
Az NCX-aktivitás GM1-gyel való asszociálódását 45 Ca 2+ felvételi kísérlet jelezte izolált sejtmagokkal, izotóptranszfer nukleoplazmából NE-be (Xie et al. 2002). Ezt a differenciált NG108-15 sejtek (magas NE GM1) sejtjeiben tapasztalható robusztus NCX aktivitás összehasonlításával mutatták ki a differenciálatlan sejtek sejtjeiben tapasztalható lassú aktivitással (kevés vagy egyáltalán nem voltak NE GM1 sejtek). 45 A nukleoplazmától az NE lumenig terjedő Ca 2+ transzfer az NCX/GM1 komplex elhelyezkedését javasolta az NE belső membránjában, és ezt az elválasztott membránok immunblott-analízisével igazolták. Mivel az NCX által történő Ca 2+ transzfert Na + gradiens vezérli, a fentiekben a Na + ÉK-ban megemelkedett in vitro kísérletek a magok Na + -tartalmú közegben történő előzetes inkubálásával, megfelelő ionoforokkal. Az ilyen transzfer természetes módon bekövetkezett egy Na +/K + -ATPáz részéről, amelyről kiderül, hogy az NE belső membránjában fordul elő, amely folyamat magas intraluminális Na + koncentrációt eredményezett (Garner 2002).
A plazmamembránban lévő Na +/Ca 2+ -cserélő három Na + ellentranszportját közvetíti egy Ca 2+ esetén, miközben elősegíti a citoszolos Ca 2+ felfelé történő extrudálását. Ennek az „előre” váltási módnak egyik topológiai követelménye, hogy az 5. és 6. transzmembrán szegmens közötti nagy polipeptid hurok a membrán alacsony Ca 2+ (citoszolos) oldalán található (Philipson és Nicoll 2000). Feltételezve, hogy az NE NCX-re ugyanaz a követelmény, ez a peptidhurok kiterjed a nukleoplazmába, hogy megkönnyítse a nukleoplazmatikus Ca 2+ felfelé történő transzferét a belső magmembránon át az NE lumenen belüli koncentrált Ca 2+ -készletbe. Ez jelentős különbséget eredményezne a GM1 orientációban, ahol a GM1 oligoszacharid lánc és az NCX hurok a plazma membrán ellentétes oldalán, de a belső NE membrán ugyanazon oldalán található (2. ábra). Ez a topológia lehetővé tenné, hogy a GM1 sziálsav negatív töltése kölcsönhatásba lépjen pozitív töltésű aminosavakkal, amelyekről kimutatták, hogy ezen NCX hurok néhány izoformájának alternatívan splicelt régiójában fordulnak elő (He et al. 1998). Ilyen töltés-töltés kölcsönhatás, amelyet kísérletileg javasolnak észak-északi részen bekövetkezni (Xie et al. 2004a) nem lehetséges a plazmamembránban.
A nukleáris NCX/GM1 közvetíti a Ca 2+ transzfert a citoszolból az endoplazmatikus retikulumba
Az intracelluláris rekeszekbe történő Ca 2+ belépés összehasonlítása, amely a NE-ben a GM1-től és az NCX-től függ. Az NE/ER Ca 2+ eltávolítását thapsigarginnal Ca 2+ hozzáadása követte. Az NG108-15 sejtek (GM1-t expresszáló) szignifikánsan több Ca 2+ bejutást mutattak az NE/ER-be, mint az NG-CR72 sejtek (GM1 hiányos) (a-i vs. a-ii). A C6 sejtek (amelyek NC-t expresszálnak NE-ben) robusztus Ca 2+ bejutást tapasztaltak az NE/ER-be (b-i), szemben a Jurkat-sejtekkel (nincs NCX-expresszió), amelyek nem mutattak Ca 2+ -ot NE/ER-be (c-i). A Ca 2+ bejutása a nukleoplazmába hasonló volt a C6 (b-ii) és a Jurkat (c-ii) sejteknél, mint a Ca 2+ citoszolba való belépése esetén is (b-iii, c-iii); A KB ‐ R7943 (KB, NCX gátló) szerény hatást fejtett ki a C6 nukleoplazmájára és citoszoljára, de a Jurkat sejtekre nem volt hatással. A KB-nak nagy hatása volt az NG108-15 (a-i) NE/ER-be történő Ca 2+ bejutására, az NG-CR72 sejtekkel (b-i) pedig kicsi volt a hatása. Sorozatképeket kaptunk ER-cameleont expresszáló NG108-15 sejtekkel, miután a thapsigargin 50 másodpercen keresztül alkalmazta a [Ca 2+] ne/er (d) kimerülését. A CaCl2/KCl hozzáadása 550 mp-nél a [Ca 2+] ne/er emelkedését okozta, amely a perinukleáris (NE) régióból származik (nyílhegyek 592,8 s képnél * -nel), majd az egész NE/ER-re kiterjedtek. Ezt fokozatos Tg-indukált kimerülés követte. Wu-tól adaptálva et al. (2009) engedélyével Proc. Natl Acad. Sci. USA.
A nukleáris NCX/GM1 biztosítja a citovédelmet
A gangliozidokat ma szinte minden gerinces és néhány gerinctelen sejt mindenütt elismert komponenseként ismerik el, számos szabályozó és jelző funkcióval a membránban és a sejtben (Yu és Saito 1989; Ledeen et al. 1998; Hakomori 2001). A nukleáris NCX/GM1 prevalenciáját illetően a mai napig vizsgált sejttípusok többsége rendelkezik ezzel a komplextel, még olyan sejtekben is (pl. C6), amelyek nem tartalmaznak NCX-t a plazmamembránban (Xie et al. 2004a, b). A fő kivétel, amelyet eddig megfigyeltünk, az immunrendszer elsődleges vagy származékos sejtjei, beleértve Jurkatot és az emberi T-sejtek egy alcsoportját (Xie et al. 2004a). Az a tény, hogy egyes sejtek nem rendelkeznek ezzel a citoprotektív mechanizmussal, arra utal, hogy a szervezet érdekében megfelelő időben eliminálódhatnak. Így úgy tűnik, hogy a nukleáris NCX/GM1 jelenléte és hiánya kritikus hatást gyakorol a sejtek viselkedésére és a túlélésre.
Kilátások a jövőre
Elismerés
Ezt a munkát az Országos Egészségügyi Intézet támogatta: 2 RO1 NS033912.
- Az elhízás fiziológiája és a tüdő működésére gyakorolt hatások Journal of Applied Physiology
- A születés utáni 2–11. Nap egy 5-HT-érzékeny periódust jelent, amely hatással van a felnőtt mPFC
- Növényi étkezés Az étrend tisztításának előnyei Yoga Journal
- Elhízás diagnózis és kezelési algoritmus British Columbia Medical Journal
- Izomdiatázis - áttekintés a ScienceDirect témákról