Újszülött nekrotizáló enterocolitis - gyulladás és bél éretlenség
Erika C. Claud
Chicagói Egyetem, Gyermekgyógyászati és Orvostudományi Tanszék, Neonatológiai és Gasztroenterológiai Szakosztályok, 5841 S. Maryland Ave MC6060, Chicago, IL 60637, USA
Absztrakt
Az újszülöttkori nekrotizáló enterocolitis koraszülöttek pusztító gyulladásos bélbetegsége. A patogenezis maradéktalanul megértett marad, és nincs specifikus kezelés. Folyamatban vannak a béléretlenség azon aspektusainak megértése, amelyek hozzájárulnak a betegség iránti fogékonysághoz. Ez az áttekintés a baktériumok kolonizációs mintáira, a bélsorompó működésére és az éretlen enterociták gyulladásos reakcióira összpontosít, amelyek a koraszülött bél egyedüli sérülékenységéhez vezetnek. Ezenkívül megvitatják az emberi tejben és a probiotikus baktériumokban rejlő tényezők lehetséges terápiás lehetőségeit.
BEVEZETÉS
NEKROTIZTIKUS ENTEROCOLITIS
A NEC egy gyulladásos bélnekrózis, amely elsősorban a koraszülötteket sújtja az enterális táplálékok megkezdése után. A NEC a koraszülött csecsemők 13 mikroorganizmusának körülbelül 10% -át érinti, az újszülött bél születéskor steril. Ezenkívül a koraszülött bél üres palájának kolonizációját befolyásolják az újszülött intenzív osztályon (NICU) végzett iatrogén manipulációk. Ez magában foglalja a kórházi környezetet; széles spektrumú antibiotikumok, opioidok és H2-blokkolók gyakori használata; és műszerezés endotracheális csövekkel, etetőcsövekkel és szívócsövekkel. Az eredő megváltozott mikrobiális flóra jelentős következményekkel járhat az éretlen koraszülött bél kialakulására és a NEC-re való hajlamra.
Úgy gondolják, hogy a baktériumok fontosak a NEC patogenezisében; specifikus kórokozót azonban nem azonosítottak. A korábbi vizsgálatokat korlátozta, hogy a hagyományos mikrobiológiai tenyésztési technikák képtelenek voltak alaposan jellemezni az emberi gyomor-bélrendszer mikrobiotáját. Beszámoltak arról, hogy az emberi vastagbél mikrobiota 80% -át nem mutatják be hagyományos tenyésztési módszerek [14]. A mikrobiómák molekuláris profilozása ma már lehetséges a nagymértékben konzervált 16S kis alegységű bakteriális riboszomális RNS gén (rRNS) szekvenálásával, lehetővé téve a korábban nem detektálható mikrobák azonosítását [15]. Ez a megközelítés tehát teljesebb képet nyújt az emberi bél mikrobiota összetételéről.
NEC-vel rendelkező és anélküli csecsemők bélmikrobiomjának szekvenálása megmutatta, hogy a NEC-betegek szekvenciái külön-külön csoportosulnak a kontroll betegek szekvenciáitól, még genetikailag azonos ikerpárok között is [16]. Egy specifikus kórokozót még mindig nem azonosítottak, sokkal inkább a NEC betegek mikrobiális közösségének szerkezete különbözik a mikrobiális fajok sokféleségének jelentős csökkenése, a proteobaktériumok dominanciájának növekedése miatt más koraszülötteknél, és egyetlen nemzetség specifikus virágzása a proteobaktériumok aránya a teljes baktériumösszetétel> 50% -áig [16]. Ezek az adatok arra utalnak, hogy bár a baktériumok fontosak a NEC patogenezisében, a NEC nem tűnik klasszikus értelemben vett fertőzésnek. Egy adott organizmus nem kauzális, sokkal inkább kiváltja a korai bélben lévő gyors gyulladásos kaszkádot, ami a betegség jeleihez és tüneteihez vezet. Ennek az interakciónak két oldala van - a mikroba és a gazdaszervezet.
Házigazda védelme a koraszülöttnél
A koraszülött bél lényegében magzati bél, amely az intrauterin környezet körülményeit várja. Ez magában foglalja a baktériumok hiányát. A koraszülöttek még nem lehetnek felkészülve a baktériumok kölcsönhatására, ha kezdetben gyarmatosítják és táplálják őket, ami potenciálisan nagyobb kockázatot jelent számukra a NEC szempontjából.
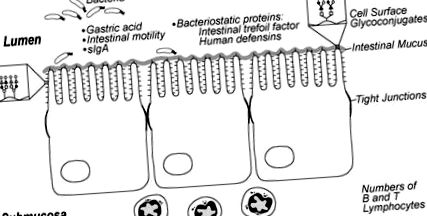
Az érett bélnek számos fizikai gátja van a baktériumok előtt, ideértve a perisztaltikát, a gyomorsavat, a proteolitikus enzimeket, a bélnyálkát, a sejtfelszíni glikokonjugátumokat és a bélhámsejtek szoros csatlakozását. Ezeket úgy tervezték, hogy korlátozzák a baktériumokat a bél lumenjében, és megakadályozzák a bélhámban való kötődést és transzlokációt. Állatkísérletek kimutatták, hogy a kórokozó organizmusok nagyobb mértékben tapadnak és transzlokálódnak a belekben az éretlen és érett állatoknál (1. ábra). Ezeknek a csecsemőknek a rendellenes perisztaltikus aktivitása fokozhatja a baktériumok tapadását, lehetővé téve a baktériumok elszaporodását, ami növelheti az endotoxin expozíciót és hajlamosíthatja a csecsemőt az NEC-re [17–19]. A sejtfelszíni glikokonjugátumok, amelyek különböző mikrobák tapadási helyeként szolgálnak, az éretlen szénhidrátmaradványok mintázata eltér a felnőtt béltől, ami megnövekedett patogén kolonizációt eredményezhet koraszülötteknél [20–22]. Továbbá ismert, hogy a baktériumok és a toxinok inváziója ellen védő bélnyálka a fejlődő állatoknál és talán a koraszülötteknél is eltérő a szénhidrát-összetétel, a sűrűség és esetleg a szekréciós immunglobulin [23] szempontjából.
A koraszülött csecsemő éretlen bélgazdálkodásának szempontjai, amelyek hozzájárulhatnak a nekrotizáló enterocolitis iránti fogékonysághoz. Engedéllyel reprodukálva [146].
Bélsorompó megzavarása
A gyomor-bélrendszer egyedülálló jellemzője, hogy egyetlen hámréteggel béleli, folyamatosan érintkezve a bél baktériumflórájával. Ez a réteg kulcsfontosságú gazdaszervezet-védelmi mechanizmus, amely kritikus fontosságú a kórokozó baktériumoknak a bél lumenjéhez való korlátozásához, ugyanakkor lehetővé teszi a tápanyagok átjutását is. A koraszülöttek fokozott bélpermeabilitással rendelkeznek, ami talán lehetővé teszi a fontos makromolekulák várható átjutását a magzatvízből vagy az anyatejből [32]. Ugyanez a megnövekedett permeabilitás azonban megnövekedett baktériumok transzlokációjához vezethet. Az éretlen bélhámsejtek gyulladásos válaszát akár kommenzális, akár patogén baktériumok válthatják ki [33]. A bélhám gátjának megszakadása növeli ezt az interakciót, és úgy gondolják, hogy a NEC patogenikus kaszkádjának korai eseménye.
A nyálkahártya gátjának megszakadását okozhatja a hámsejtek közötti szoros csatlakozások megszakadása. A bélsorompó általában bélhámsejtekből (IEC) áll, amelyeket mind az intracelluláris (zonula occludin fehérjék ZO-1, ZO-2 és ZO-3), mind a membránt átívelő (okkludin, junction-adhéziós molekula (JAM) és a claudin család) fehérjék [34]. A hámszűk kereszteződés (TJ) szelektíven áteresztő gátat képez, amely lehetővé teszi a folyadékok és oldott anyagok átjutását, miközben védőgátat tart fenn a bél lumenjének egyéb tartalmaival szemben. Az occludin és a claudin-3 kimutatták, hogy megváltozott a NEC állatmodelljeiben [35].
A gát lebontásának másik eszköze a sejtek pusztulása. A sejtpusztulás egyik eszköze az apoptózis vagy a programozott sejthalál. Az apoptózis a sérült sejtek eltávolításának folyamata, amelyet sejtek zsugorodása, kromatin kondenzáció és DNS fragmentáció jellemez. [36] A Caspase proteázok az apoptotikus sejthalál végrehajtói. A kaszpáz-aktiváció szabályozza az endonukleázokat, ami az internukleoszomális DNS hasítását és a sejthalált eredményezi [37]). Ezen kívül vannak olyan kaszpázfüggetlen utak, amelyekben a kaszpázoktól eltérő proteázok indítják el a kromatin hasítását [38]. Míg az apoptózis az enterocitaforgalom normális aspektusa, a felgyorsult apoptózis a kritikus bélnyálkahártya-gát megszakadásához vezethet. Állatmodellekkel végzett vizsgálatok kimutatták, hogy az apoptózis megelőzi a nekrózist a NEC-ben, és az apoptózis gátlása csökkentheti a betegség előfordulását [39].
Az apoptózist mind intrinsic, mind extrinsic útvonal kiválthatja [40]. Az intrinsic úton a sejtstressz a citoplazmatikus proapoptotikus fehérjék, például a Bcl-2 család BAX és BID tagjai kötõdéséhez vezet a mitokondriumhoz. Ez a mitokondriális potenciál összeomlását eredményezi. A citokróm C ezután felszabadul a mitokondriumokból és az apoptotikus proteáz aktiváló 1-es faktorhoz kötődik, ami apoptózis képződést eredményez. A kaszpáz-toborzó domén expozíciója a -9-es kaszpázt toborozza, ami a kaszpáz 3 végső aktiválódását eredményezi, és a DNS-fragmentáció sejtpusztulást eredményez. Az extrinsic útvonalon a Fas ligandum vagy a tumor nekrózis faktor (TNF) receptorhoz történő kötődése a Fas asszociált haláldomén [41] fehérjék toborzását eredményezi. A későbbi kaszpáz 8 toborzása a halált kiváltó szignál komplex (DISC) kialakulását eredményezi. Ez a komplex közvetlenül aktiválhatja a kaszpáz 3-t mitokondriumoktól függetlenül, vagy BID-en keresztül a citokróm C mitokondriális felszabadulását indukálja. Az apoptózis a tartós kalcium-növekedés által kiváltott DNS-fragmentációból is származhat, amely a Ca 2 +/Mg 2+ aktiválásával hat. endonukleáz vagy intracelluláris acidózis, amely fokozhatja a kaszpázok és a pH-érzékeny endonukleázok aktiválódását [42, 43].
A thrombocyta-aktiváló faktor (PAF) egy foszfolipid inter- és intra-celluláris mediátor, amely szerepet játszik a gyulladásos bélbetegség patológiájában, és kimutatták, hogy indukálja a bél hámsejtjeinek apoptózisát. A PAF által kiváltott bélkárosodás mechanizmusa azonban nem teljesen ismert. Ismeretes, hogy a szöveti és/vagy a szérum PAF-szint megemelkedik a Crohn-betegségben, fekélyes vastagbélgyulladásban és NEC-ben szenvedő betegeknél, és a szintek korrelálni látszanak a betegség súlyosságával [44–47]. A NEC állatmodelljeiben a PAF-receptor blokkolása vagy a PAF-lebontó PAF-acetil-hidroláz enzim beadása csökkentette a kísérleti NEC előfordulását [48]. Ezenkívül a NEC humán vizsgálataiban kimutatták, hogy a PAF néhány nappal a klinikai tünetek megjelenése előtt emelkedik néhány betegnél, ami arra utal, hogy ez kritikus, és esetlegesen elindító tényező a betegség kialakulásában [49]. Kimutatták, hogy a PAF szintjét mind a hipoxia, mind az enterális táplálkozás megnöveli, amelyek a NEC-vel kapcsolatos specifikus kockázati tényezők egy része [50, 51].
A szabályozás a receptor szintjén kezdődik, ahol a PAF egy hét transzmembrán domén G-fehérjéhez kapcsolt receptorhoz kötődve hat. Mind a magas, mind az alacsony affinitású PAF receptorokat azonosították [52]. Ezután több jelátviteli kaszkád kapcsolódik a PAF receptorhoz. A beadás módjától és az alkalmazott állatmodelltől függően a PAF különféle hatásokat indukálhat, beleértve a vérlemezke aggregációt, a hipotenziót, a fokozott érpermeabilitást, az érösszehúzódást, a bél ischaemiáját, a neutrofil rekrutációt és a reaktív oxigénfajták termelését [53]. A belekben azt gondolják, hogy a PAF, miután aktiválódott, elindítja más gyulladásos mediátorok, például TNFα, prosztaglandinok, tromboxán, és komplexek termelését, amelyek ezután a gyulladásos bélbetegség klinikai tüneteihez és tüneteihez vezetnek [54–56]. Számos bizonyíték azt sugallja azonban, hogy a bélben a megemelkedett PAF-szint patológiás következményei nemcsak egy gyulladásos kaszkád megindulásának következményei, hanem hogy a PAF maga is közvetlen hatással van a bélhámsejtekre.
Elszigetelt IEC vonalakban és a NEC állatmodelljében kimutatták, hogy a PAF három mechanizmus révén indukál apoptózist [39, 57]. A PAF a BAX transzlokációját indukálja mitokondriumokba, ami a mitokondriális membránpotenciál és a kaszpáz-aktiváció elvesztését eredményezi, ezt a hatást blokkolja az anti-apoptotikus fehérje Bcl2 [57]. A PAF gátolja a foszfatidil-inozitol-3-kináz/protein-kináz B Akt Akt jelátviteli utat is [58]. Végül kimutatták, hogy a PAF intracelluláris acidózist vált ki a Ca 2+ -függő Cl - csatorna ClC-3 aktiválásával, ami az IEC apoptózisát eredményezi [59].
Koraszülött emberi csecsemők NEC-vel végzett bélszövetének vizsgálata további markerekkel rendelkezik, amelyek nyomot adnak a megváltozott gátfunkció mechanizmusáról. Ezek a tanulmányok kimutatták az indukálható nitrogén-monoxid szabályozását, amely korrelált a bélkárosodás mértékével és az apoptotikus magok számával. A citokinek által indukált nitrogén-oxid (NO) helyi béltermelése bél apoptózishoz vezet, ami súlyosbíthatja a bél sérülését [60]. Ezenkívül megnövekedett a magas mobilitású 1. csoport (HMGB1) fehérje szintje, amelyet makrofágok és nekrotikus sejtek szabadítanak fel, és amely fokozott gátműködési zavarokkal és baktériumok transzlokációjával jár együtt [61].
Bélgyulladás és NEC
Az apoptózist követő nekrózis a kiváltott gyulladásos kaszkád progressziójából ered. Az IL-8 egy kemokin, amely stimulálja a neutrofilek migrációját az intravaszkuláris helyekről az interstitialis helyekre, és közvetlenül aktiválhatja a neutrofileket és szabályozhatja a neutrofil adhéziós molekulák expresszióját [62–64]. Az immunsejtek toborzásával és aktiválásával tehát az IL-8 fontos szerepet játszhat a gyulladásban. Korábbi vizsgálatok kimutatták, hogy a szérum IL-8 koncentrációja szignifikánsan megemelkedett a NEC súlyos eseteiben annak megjelenésétől az első 24 óráig [65]. Az akut NEC-vel rendelkező csecsemők bélműtéti mintái az egész serosa, muscularis és a bél hámjában az IL-8 mRNS felregulációját mutatják, összehasonlítva más gyulladásos állapotokkal vagy betegséggel nem rendelkezőkkel [66]. A vizsgálatok azt is kimutatták, hogy a pro-gyulladásos citokinek IL-6 és TNFα szintje megnövekedett NEC-ben szenvedő csecsemőknél [51, 67, 68].
A koraszülötteknél nemcsak megváltozott a baktériumok kolonizációja és az éretlen gazda védekezés, hanem éretlen a baktériumok reakciója is. Az enterociták számára fontos fejlődési lépés lehet a gyulladásos reakcióképesség csökkentése annak érdekében, hogy megakadályozzák a normál flórával szembeni immunvédelmi mechanizmusokat. Előfordulhat, hogy a koraszülöttek nem fejezték be ezt az érést, amikor baktériumok kezdetben táplálták és telepítették őket. A bizonyítékok arra utalnak, hogy a koraszülött újszülött hajlamos lehet a bélgyulladásra. Tanulmányok kimutatták, hogy a felnőtt IEC-hez képest az emberi magzati IEC-ben túlzottan termelődik az IL-8 mind a patogén, mind a kommenzális baktériumok, valamint az endogén gyulladásos mediátorok, például a TNFα és az IL-1γ hatására [69, 70].
Az autópályaszerű receptorok (TLR) a kórokozókkal összefüggő molekuláris mintázatú (PAMP) receptorok erősen konzervált családja, amelyek felismerik a baktériumok összetevőit. A TLR4 specifikusan felismeri a baktériumsejt-komponens lipopoliszacharidot (LPS). Érdekes, hogy a TLR4 expresszió a születés után csökken az egészséges anya patkány kölykeinek belében, de megnő a bél hámjában, ha a kölykök koraszülötteknél szokásos stressznek vannak kitéve, például tápszeres táplálás és asphyxia [71]. Továbbá a NEC állatmodelljei kimutatták, hogy a TLR4 mutáns egerek védettek voltak a NEC-től [71].
- Nekrotizáló enterocolitis cikk
- Nekrotizáló enterocolitis - NORD (Nemzeti Ritka Rendellenességek Szervezete)
- Nekrotizáló enterocolitis tünetei, okai, kezelése
- Nekrotizáló enterocolitis IntechOpen
- Nekrotizáló enterocolitis-csökkentés exkluzív emberi tej-diéta és probiotikum alkalmazásával