A bél mikrobiota elnyomja az inzulin által közvetített zsírfelhalmozódást a GPR43 rövid láncú zsírsavreceptoron keresztül
Tárgyak
Absztrakt
A bél mikrobiota befolyásolja a tápanyagok megszerzését és a gazda energiaszabályozását, és befolyásolhatja az elhízás, az inzulinrezisztencia és a cukorbetegség kialakulását. Az etetés során a bélmikrobák rövid láncú zsírsavakat termelnek, amelyek a gazda számára fontos energiaforrások. Itt megmutatjuk, hogy a GPR43 rövid szénláncú zsírsavreceptor összeköti a bél mikrobiota metabolikus aktivitását a gazda test energiaháztartásával. Kimutattuk, hogy a GPR43-hiányos egerek normális étrenden elhíznak, míg a kifejezetten a zsírszövetben a GPR43-t túlzott mértékben expresszáló egerek zsírtartalmú étrend mellett is soványak maradnak. Csíramentes körülmények között vagy antibiotikumokkal történő kezelés után nevelik, mindkét típusú egér fenotípusa normális. Megmutatjuk továbbá, hogy a GPR43 rövid szénláncú zsírsavközvetített aktivációja elnyomja az inzulinjelzést az adipocitákban, ami gátolja a zsír felhalmozódását a zsírszövetben, és elősegíti a be nem épült lipidek és a glükóz metabolizmusát más szövetekben. Ezek a megállapítások a GPR43-at a túlzott táplálkozási energia szenzoraként hozzák létre, ezáltal szabályozva a test energiafelhasználását, miközben fenntartják az anyagcsere-homeosztázis.
Bevezetés
A bél mikrobiota az emlősök gyomor-bél traktusában élő mikroorganizmusok egy sora, és a legújabb kutatások kimutatták, hogy a bél mikrobiota elhízásban és anyagcserezavarokban vesz részt, 1,2,3,4. A magas zsírtartalmú étrend (HFD) által kiváltott, elhízással kapcsolatos egerek felhasználásával végzett vizsgálatok több mechanizmuson keresztül összekapcsolják a bél mikrobiotájának összetételét az elhízás, az inzulinrezisztencia és a cukorbetegség kialakulásával a gazdaszervezetben, ideértve az étrendből származó megnövekedett energiatermelést és a megváltozott zsírsavat anyagcsere és összetétel a zsírszövetben és a májban 5,6,7,8 .
A bél mikrobiota egyik fontos tevékenysége az élelmi rostok katabolizálása, amelyeket a gazdaenzimek nem teljesen hidrolizálnak 9. Az élelmi rost fő vastagbélbaktérium-fermentációs termékei a rövid szénláncú zsírsavak (SCFA-k), például acetát, propionát és butirát 10; Az SCFA-k felhasználhatók de novo a lipidek és a glükóz 11 szintézise, amelyeket a gazda fő energiaforrásaként használnak.
Az energiaforrások mellett SCFA-kat hoztak létre alapvető tápanyagként, amelyek jelátviteli molekulákként is működnek. A közelmúltban két árva G fehérjéhez kapcsolt receptorról, a GPR41 és GPR43-ról számoltak be, hogy az SCFA-k aktiválódtak 12. A GPR41-ről beszámoltak arról, hogy a heterotrimer G-protein α-alegységeként kapcsolódik a Gi/o-hoz, és bél mikrobiotával kapcsolatos energiaérzékelőként működik a szimpatikus idegrendszerben és a belekben 13,14,15,16. A GPR43 állítólag Gi/o-hoz vagy Gq-hez kapcsolódik, mint a heterotrimetrikus G-fehérje 17,18 másik α-alegysége. Beszámoltak arról, hogy a GPR43 a zsírszövetben, a belekben és az immunszövetekben is kifejeződik. Az immunrendszerben a gyulladásos válaszok GPR43 által történő szabályozása jól tanulmányozott folyamat 20,21,22; a GPR43-at azonban még nem vizsgálták annyira a zsírszövetben. Egyes tanulmányok azt mutatták, hogy a GPR43 elősegíti a leptin szekrécióját, az adipogenezist és a lipolízis gátlását a zsírszövetben és az adipocitákban, ezáltal szabályozva az energia-anyagcserét 19, 23, 24. A HFD-vel táplált GPR43-hiányos egerek javított glükóz-toleranciát és csökkent testzsír-tömeget mutatnak 25. Másrészt más csoport beszámolt arról, hogy a belekben expresszált GPR43 javítja a glükóz toleranciát azáltal, hogy elősegíti a glukagon-szerű peptid-1 (GLP-1; például inkretin) szekrécióját az L sejtekből 26 .
A GPR43 szerepe az anyagcsere folyamatokban még mindig nem világos. Ebben a tanulmányban a GPR43 hiányos egerek felhasználásával és a GPR43 zsírspecifikus túlzott expressziójával bemutatjuk a GPR43 valódi funkcióját a zsírszövetben és a GPR43 szerepét az energiaegyensúly szabályozásában.
Eredmények
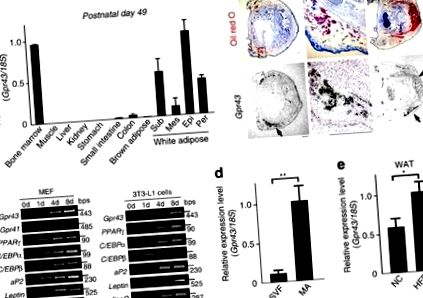
Gpr43 bőségesen kifejeződik a fehér zsírszövetben
Gpr43 főleg a felnőtt egerek immunszövetében és fehér zsírszövetében (WAT) fejeződött ki, amint arról korábban 18,19 számoltak be, a barna zsírszövetben azonban nem (BAT; 1a. ábra). In situ a posztnatális stádiumú hibridizáció (P1) megerősítette ezt Gpr43 a WAT-ban expresszálódott a legjobban, és nem fejeződött ki a BAT-ban (1b. ábra). Adipogenezis során, Gpr43 a differenciálás későbbi szakaszaiban fejeződött ki, mint aP2 és PPARg, érett adipociták (MA) markerei a 3T3-L1 pre-adipocytákban és egér embrionális fibroblasztokban (MEF-ek; 1c. ábra). A felnőtt egér zsírszövetében, Gpr43 bőségesen expresszálódott az MA frakcióban, de nem a stromalis vaszkuláris frakcióban, amely pre-adipocitákat és makrofágokat tartalmazott (1d. ábra). Ráadásul, Gpr43 expresszió szignifikánsan magasabb volt a HFD-vel táplált egerek WAT-jában, mint a normál chow (NC) táplált egerekben (1e. ábra). Így, Gpr43 bőségesen expresszálódott az érett WAT-ban, de nem a BAT-ban vagy pre-adipocytákban.
Gpr43 a kieső egerek elhízást mutatnak
Zsírspecifikus Gpr43 transzgenikus egerek soványak
A GPR43 elnyomja az inzulin jelátvitelt a zsírszövetben
Tovább vizsgáltuk a GPR43 funkció és az inzulinérzékenység összefüggését. A WAT, az izmok és a máj az üzemanyag-metabolizmusban részt vevő három fő szövet Meglepő, hogy bár az inzulinérzékenység javult aP2-Gpr43TG egerek a vad típusú egerekhez képest a HFD-etetéssel összefüggésben (3o. ábra), az inzulin által kiváltott Akt foszforiláció a WAT-ban, az izmok és a máj azonban nem, jelentősen elnyomódott (4a – c. ábra). Az acetát beadása szignifikánsan elnyomta az inzulin által kiváltott Akt foszforilációt a WAT-ban, de a vad típusú egerek izmait vagy máját nem, míg a hatás a WAT-ban nem volt kimutatható. Gpr43 -/- egerek (4d – f. ábra). Ezek az eredmények azt jelezték, hogy a GPR43 jelátvitel csak a WAT-ban szuppresszálta az inzulinjelet.
Következésképpen megvizsgáltuk az SCFA-k és a GPR43 funkcióit a WAT inzulinjelzéssel kapcsolatos bioaktivitáson 29. A GPR43 elősegíti az adipogenezist in vitro 19. Így az adipociták GPR43-hiány által történő differenciálódásának eltéréseinek elkerülése érdekében pioglitazone által kiváltott adipogenezist használtunk 30. A várakozásoknak megfelelően a pioglitazonnal fokozott MEF-eredetű adipocitákban az adipogenezis nem különbözött vad típusú és Gpr43 -/- vagy aP2-GPR43TG egerek (S3a, b kiegészítő ábra). Az acetát jelentősen elnyomta az inzulin által kiváltott glükóz- és zsírsavfelvételt a vad típusú egerek adipocitáiban, de nem Gpr43 -/- egerek (4g. ábra; S3c. kiegészítő ábra), míg tovább fokozódott a aP2-Gpr43TG egerek (4h ábra). Ezenkívül a lipoprotein lipáz (LPL) aktivitása magasabb volt a HFD-vel tápláltaknál Gpr43 -/- egerek, és alacsonyabbak aP2-Gpr43TG a WAT-ban, de nem izomban (4k ábra). A WAT LPL aktivitására gyakorolt hatásait GF körülmények között és antibiotikus kezeléssel megszüntettük (4m. Ábra). Továbbá, Lpl Az mRNS expressziója a WAT-ban összehasonlítható volt Gpr43 -/- egerek, és alacsonyabbak aP2-Gpr43TG egerek (S3d. kiegészítő ábra). Ezek az eredmények együttesen azt jelezték, hogy az inzulin szignalizációjának elnyomása a WAT-ban, de nem az izmokban vagy a májban, megváltoztatta a glükóz és a lipid anyagcserét acetátfüggő GPR43 stimulációval.
A GPR43 elnyomja az inzulin szignalizációt a G (i/o) βγ – PLC – PKC – PTEN segítségével
Továbbá megvizsgáltuk a GPR43 által közvetített intracelluláris jelátvitelt 3T3-L1 pre-adipocita eredetű adipocitákban. A fenil-acetamid (PA) GPR43-szelektív 31 agonistaként ismert, míg a ciklopropánkarbonsav részben szelektív GPR41 agonista (S4a, b kiegészítő ábra). Az acetát és a PA szignifikánsan elnyomta az inzulin által kiváltott Akt foszforilációt, míg a ciklopropánkarbonsav gyengén elnyomta ugyanezt (5a. Ábra). Másrészről, N A 6-ciklopentiladenozin, az adenozin A1 receptor (Gi/o-típusú G fehérjéhez kapcsolt receptor) 32 liganduma nem volt hatással az inzulin által kiváltott Akt foszforilációra (S4c kiegészítő ábra). Az inzulin által kiváltott Akt foszforiláció GPR43 által közvetített szuppresszióját hatékonyan blokkolta pertussis toxinnal (PTX), egy Gi/o típusú G fehérje inaktivátorral 33 végzett kezelés (5b. Ábra), míg a rövid interferáló RNS (siRNS) kezelése A Gq fehérjének (S4d, e kiegészítő ábra) nem volt gátló hatása (5c. Ábra). Ezenkívül az inzulin által kiváltott Akt foszforiláció GPR43 által közvetített szuppresszióját hatékonyan blokkolta a Gallein-kezelés (Gβ-blokkoló), de az NF023 (Ga (i/o) blokkoló 14) nem (5b. Ábra). Jelentések szerint a G (i/o) βγ a PLC – PKC – ERK 34 útvonalhoz közvetít. Az inzulin által kiváltott Akt foszforiláció GPR43 által közvetített szuppresszióját hatékonyan blokkolta az U73122 (PLC-gátló) és a Go6983 (PKC-gátló) kezelés, de az U0126 (MEK-gátló) nem (5d. Ábra).
Ezután megvizsgáltuk, hogy a GPR43 közvetlenül elnyomja-e az inzulin szignalizációt. Az acetát jelentősen elősegítette a PTEN (inzulin/PI3K jelátvitel negatív szabályozója) PTEN (foszfatáz és tenzin homológ) foszforilációját, és a hatást hatékonyan blokkolta a Go6983 és PTX kezelés (5e. Ábra). Ezenkívül az inzulin által kiváltott Akt foszforiláció acetát által közvetített szuppresszióját hatékonyan blokkolták egy bpV-vel (pic), egy PTEN-gátlóval végzett kezeléssel (5f. Ábra). A máj kináz B1 (LKB1) PKC-függő foszforilációja a PTEN foszforilációját segíti elő 36. Az acetát jelentősen elősegítette az LKB1 foszforilációját inzulinnal vagy inzulin nélkül, és a hatást hatékonyan blokkolta a Go6983 és a PTX kezelés (S4f kiegészítő ábra). Másrészt az acetát nem volt hatással az inzulinreceptor szubsztrátumra1, az inzulinjelző adapter fehérje 35) foszforilációjára (S4g kiegészítő ábra). Ezenkívül az acetát jelentősen elnyomta az epidermális növekedési faktor által kiváltott Akt foszforilációt (S4h kiegészítő ábra). Ezenkívül az acetáttal vagy PA-val végzett kezelés jelentősen elnyomta az inzulin által kiváltott glükózfelvételt és az LPL-aktivációt, és ezeket a gátló hatásokat a PTX kezelésével megszüntették (5g. Ábra). Így a GPR43 acetát-mediált aktiválása elnyomja az inzulin bioaktivitását az Akt foszforiláció gátlásával a G (i/o) βγ – PLC – PKC – PTEN útján (5i. Ábra).
A GPR43 elősegíti az energiafelhasználást
Vita
Az SCFA-k, köztük az acetát, a GPR43 ligandumaként működnek, és a bél mikrobiota 12 termeli őket. HFD-vel táplált körülmények között a széklet SCFA- és plazma-acetát-tartalma a HFD-vel táplált egerekben szignifikánsan csökkent az NC-vel táplált egerekénél (S2a. Kiegészítő ábra, b). Ez feltehetően annak köszönhető, hogy a szénhidrátot zsírral helyettesítik a HFD-ben, ami csökkentette az SCFA-termelést a bél mikrobiotájával (S1 kiegészítő táblázat). azonban, Gpr43 expresszió szignifikánsan magasabb volt (kb. kétszer) a HFD-vel táplált egerek WAT-jában, mint az NC-vel táplált egerekben (1e. ábra). Ez azt jelzi, hogy bár csökkent az endogén SCFA ligandumok száma, a GPR43 zsírszövetben való expressziójának növekedése hozzájárult a drámai fenotípushoz Gpr43 -/- egereknél, amelyet tovább súlyosbít a HFD által kiváltott metabolikus fenotípus.
A GPR43 elősegíti a leptin szekrécióját és az adipogenezist, és gátolja a lipolízist in vitro 19,22,23,24. Tanulmányaink azonban, felhasználva Gpr43 -/- egerek és aP2-Gpr43TG egerek, azt mutatták, hogy az adipogenezis összehasonlítható volt a vad típusban, Gpr43 -/- és aP2-Gpr43TG egerek a P1-nél. Ezenkívül a plazma leptin szintje összehasonlítható volt vad típusú és Gpr43 -/- egerek. Ezzel szemben a plazma leptinszintje aP2-Gpr43TG egerek alacsonyabbak voltak, mint a vad típusú egereknél a felnőttkori stádiumban. Ezek az eredmények arra engedtek következtetni, hogy a in vitro a kísérletek nem tükrözték helyesen a fiziológiai feltételeket in vivo. Továbbá a in vivo kísérletek azt mutatták, hogy a GPR43 aktivációval történő lipolízis gátlása csökkentette a plazma szabad-zsírsav szintjét, és a válasz megszűnt. Gpr43 -/- egerek 23. Ezeket a válaszokat a WAT zsírfelvételének elnyomásával lehet magyarázni az inzulinjelzés gátlásával, de nem a lipolízissel. Ezért a GPR43 funkciójának a WAT-ba történő integrálásával, ideértve az LPL-aktivitás gátlását, a glükózfelvételt és a lipidfelvételt, jelenlegi tanulmányunk egyértelművé tette, hogy a GPR43-aktiváció az inzulinszignalizáció elnyomásához vezet, és ezáltal megakadályozza az energia felhalmozódását.
Az SCFA-kat a 42,43 gazda fontos energiaforrásainak tekintik. Másrészt a jelen tanulmányunk feltárta, hogy az SCFA-k jelátviteli molekulaként is működnek az energiaegyensúly fenntartása érdekében. Az etetés növelte a plazma glükóz- és lipidszintjét, és a felesleges zsírsavakat és glükózt hatékonyan raktározták el zsírként. A zsírfelhalmozódás a túlzott táplálkozással azonban elhízáshoz vezet, és számos anyagcserezavarral jár. Eredményeink azt mutatták, hogy a plazma SCFA szintje növekszik az etetés során a plazma glükózszint emelkedését követően. Ennélfogva a GPR43 energiaszenzorként működhet, hogy elősegítse a felesleges energia felhasználását más szövetekben, ahelyett, hogy a felesleges energiát zsírként tárolná a zsírszövetben, ezáltal fenntartva az anyagcserét. Ezenkívül a GF-állapotok és az antibiotikumokkal végzett kezelés teljesen eltörölték a metabolikus diszfunkcióval kapcsolatos fenotípust a GPR43-mutáns egerekben, jelezve, hogy a bél mikrobiota a GPR43 agonisták legfontosabb szállítója, és hogy a GPR43 funkciói szorosan kapcsolódnak a bél mikrobiotájához.
Ebben a tanulmányban megmutattuk, hogy az SCFA-k aktiválják a GPR43-at, hogy szabályozzák az energiafelvételt a WAT-ban, ami más szövetekben, beleértve a májat és az izmokat is, az energiafelhasználás szabályozásához vezet. Beszámoltunk arról is, hogy a GPR41, egy másik SCFA receptor, szabályozza a test energiafelhasználását azáltal, hogy aktiválja a szimpatikus idegrendszert a ganglion 14 szintjén. Ezek a megállapítások azt mutatják, hogy a bélmikrobiota által a GPR41 és a GPR43 aktiválásával előállított SCFA-k fontos szerepet játszanak az étkezés utáni tápanyagfelesleg felismerésében és az energia-kiadások összehangolásában az energiahomeosztázis fenntartása érdekében (7. ábra). Ezenkívül a GPR43-túlexpressziós egér modellünkben elért eredmények azt jelzik, hogy a GPR43 túlstimulációja stratégia lehet az anyagcsere-rendellenességek, beleértve az elhízást és a cukorbetegséget is.
A táplálás után a bélben mikrobiális fermentációval előállított SCFA-k aktiválják a GPR43-at a zsírszövetekben. Az SCFA által közvetített GPR43 aktiváció elnyomja az inzulin által közvetített zsír felhalmozódást, és ezáltal szabályozza az energiaegyensúlyt a felesleges energia felhalmozódásának elnyomásával és a zsírfogyasztás elősegítésével.
- A glükagonszerű peptid 1 receptor agonista és prebiotikum hatékonysága rövid láncú zsírokon
- Telítetlen zsírsavak dúsított étrend a kardiorespirációs fitnesz, az anyagcsere rugalmasságának javítása érdekében
- Milyen ételek tartalmaznak folsavat; News-Medical
- Milyen ételeket kerülni kell a GERD és a savas reflux mellett - A sebészeti klinika
- Milyen gyümölcsöt fogyaszthat, ha zsíros a máj