A bél mikrobiota immunogenetikai szabályozása
Gasztroenterológiai Osztály, Mayo Clinic College of Medicine, Rochester, MN, USA
Gasztroenterológiai Osztály, Mayo Clinic College of Medicine, Rochester, MN, USA
A Mayo Clinic College of Medicine immunológiai és reumatológiai osztálya, Rochester, MN, USA
Levelezés: Dr. Veena Taneja, Immunológiai Osztály, Mayo Klinika, 200 First Street SW, Rochester, MN 55905. E-mail: taneja.veena@mayo.edu
Senior szerző: Veena Taneja
Gasztroenterológiai Osztály, Mayo Clinic College of Medicine, Rochester, MN, USA
Gasztroenterológiai Osztály, Mayo Clinic College of Medicine, Rochester, MN, USA
A Mayo Clinic College of Medicine immunológiai és reumatológiai osztálya, Rochester, MN, USA
Levelezés: Dr. Veena Taneja, Immunológiai Osztály, Mayo Klinika, 200 First Street SW, Rochester, MN 55905. E-mail: taneja.veena@mayo.edu
Senior szerző: Veena Taneja
Összegzés
Az egészséges bélmikrobiom
Környezeti tényezők és a mikrobiom
Nemi elfogultság a mikrobiomban
Az étrend önmagában nem magyarázza meg teljesen az egészséges egyének bélmikrobiomjának összetételében mutatkozó különbségeket, és más erősen meghatározó tényezőket, például a nemet is figyelembe kell venni. Egy nemrégiben végzett kutatás többváltozós elemzést végzett a nem és az étrend két természetes halpopuláció (három gerinces botrányos és eurázsiai sügér) mikrobiotájára gyakorolt hatásáról annak megállapítására, hogy a genotípus és a környezet közötti kölcsönhatás szabályozza-e a bél mikrobiómájának összetételét. 23 Minden halfaj rovarlárvák és zooplankton keverékét fogyasztja. Az egyes fajokon belül azonban az egyedek különböznek e kétféle élelmiszer relatív felhasználásától. Ez egy kontinuumot képez, amely csak a lárvák elfogyasztásától kezdve a vegyes étrend fogyasztásán át a zooplankton elfogyasztásáig terjed. 24 Ez a tanulmány kimutatta, hogy mindkét halfaj csak akkor különbözött a mikrobiom összetételében az étrend tekintetében, ha figyelembe vették a nemet. 23
Kevés tanulmány határozta meg a nemet a bél mikrobiális összetételének előrejelzőjeként, de kimutatták, hogy a nemi hormonok és a nem befolyásolják a bél mikrobiomját, bár a pontos mechanizmus nem ismert. 25, 26 A humanizált egerek nemi alapú különbségeket mutattak a széklet mikrobiális összetételében is. 27 A nemi alapú különbségek jelentősége a mikrobiomban tovább tisztázódott az autoimmun betegségek egérmodelljeiben, ahol a nőstényektől származó mikrobiota genetikailag fogékony egerekben képes vezetni az autoimmunitást. 28, 29
Genetikai tényezők és a mikrobiom
Annak meghatározására, hogy a genetikai tényezők milyen mértékben játszanak szerepet a bél mikrobiota szabályozásában, egy tanulmány összehasonlította a nemesített C57BL/6 egerek és a kinőtt NMRI (Naval Medical Research Institute) egerek bélmikrobiális összetételét (1. táblázat). 39, 40 Ezt a 16s rRNS gén amplifikációjával, majd a székletflóra denaturáló gradiens gélelektroforézis (DGGE) elemzésével végeztük. Ez a tanulmány megállapította, hogy a beltenyésztett C57BL/6 egerek bélmikrobiómái jobban hasonlítanak egymásra, mint a kinőtt NMRI egerekéi (a hasonlósági index 10% -kal magasabb volt a beltenyésztett C57BL/6 egerekben). Ezt az eredményt erőteljesen alátámasztotta egy másik tanulmány, amelyben a szerzők kimutatták, hogy nyolc különböző rekombináns tenyésztett egérvonal bélmikrobiótáit erősebben befolyásolta a genetikai háttér, mint a nem (1. táblázat). Az MHC-ben kódolt 41 HLA-génről szintén kimutatták, hogy befolyásolják a bél 20, 27, 42 mikrobiális összetételét, amint azt az alábbi humán leukocita antigén szakasz tárgyalja.
Genetikai modell Gazdagén hatása a mikrobiotára Referenciák| Nem humanizált egerek | ||
| IgA kiesés | IgG-mediált válasz a bélkommenszalálásokra, amelyek a szisztémás immunrendszer aktiválódását mutatják (hatástalan kompartmentalizáció); megnövekedett számú szegmentált fonalas baktérium | 64, 67, 68 |
| TLR ‐ 5 kiesés | Kapcsolódik a bél mikrobiómájának változásaihoz Metabolikus szindróma; immunválasz oltásra, inaktivált influenza vakcina és gyermekbénulás | 70, 71 |
| MyD88-ki ütni | Hatásos válasz a kórokozókra, dysbiosis három baktériumcsalád vonatkozásában (Lactobacillaceae, Rikenellaceae és Porphyromonadaceae) és az I. típusú cukorbetegség elleni védelem | 52, 55 |
| NOD2-ki ütni | Csökkent termelés α- defenzinek; a Bacteroides, a Firmicutes és a Bacillus számának növekedése és az eltávolítás képességének csökkenése Helicobacter hepaticus | 58 |
| RELMB-ki ütni | A Bacteroidetes, a Proteobacteria és a Firmicutes ritka származásai eltérnek a kontrolloktól | 80 |
| OB-ki ütni | Bacteroides mennyisége a kontrollokkal összehasonlítva | 83. |
| C57/BL6 beltenyésztett versus NMRI kinyert | Magasabb mikrobiota hasonlósági index beltenyésztett C57BL/6 egerekben, összehasonlítva a tenyésztett NMRI egerekkel | 40 |
| MHC gén | Genotípusa a mikrobiom erősebb meghatározója, mint a neme | 41 |
| Humanizált egerek | ||
| α‐Defenzin ‐ 5 túlzott kifejezés | Ellenállás a kihívással Salmonella typhimurium; a szegmentált fonalas baktériumok elvesztése a belekből a kontrollokhoz képest | 56, 60 |
| HLA ‐ DRB1 * 04 | Dominika Clostridium-Szerű baktériumok, alacsony bőségben Porphyromonadaceae család és Bifidobacterium a T típusú 17. segítőprofillal társított bélben; életkor- és nemfüggő bél mikrobiota elvesztése | 27., 42 |
A rétegződéssel és a szétválasztással kapcsolatos gének
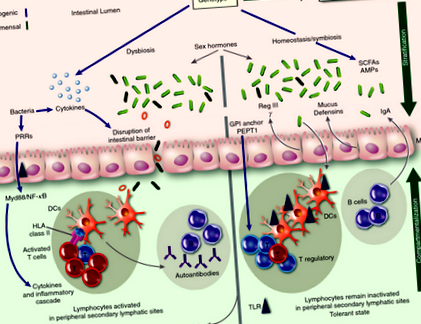
Egyre nagyobb az érdeklődés a bélmikrobák egészségre és betegségekre gyakorolt szerepének meghatározása és megértése iránt. A gazda és a rezidens bélmikrobák közötti interakció egészséges egyénekben szimbiotikus, a baktériumok hozzájárulnak a gazdaszervezet étrendjének metabolizmusához. Ezenkívül az egészséges egyénekben található baktériumok (commensals) döntő szerepet játszanak a bél immunrendszer homeosztázisának fenntartásában, miközben a tápanyagokat a gazdaszervezet étrendjéből nyerik. Az egyik módszer, amellyel fenntartják ezt a homeosztázist, a patogén baktériumok kolonizációjának gátlása. Csak rendellenes körülmények között válnak oportunisztikussá maguk a kommenzálások, amelyek gyulladást és szepszist eredményeznek. A gazdaszervezet immunrendszere ezért arra törekszik, hogy a gazda szöveteinek ezt az opportunista invázióját kommenzálásokkal korlátozza egy rétegződésnek és rekeszizálódásnak nevezett eljárással. 17 A rétegződés a mikroorganizmusok bélhámnak való kitettségének minimalizálására utal, a rekeszmentáció pedig a mikroorganizmusoknak a bélfalba történő bezárására utal, ami megakadályozza őket abban, hogy kölcsönhatásba lépjenek a szisztémás immunrendszerrel.
Az egyik módszer, amellyel a bél immunrendszere eléri a rétegződést, a nyálkaképződés. A glikoproteinekből álló bélnyálkát a bélhámot bélelő speciális sejtek (serlegsejtek) választják ki. A vastagbélben a nyákréteg vastag (
150 µm) és kétrétegű. Bár a külső rétegben rengeteg mikroorganizmus található, a belső nyálka réteg rendkívül ellenálló a behatolással szemben, és megakadályozza, hogy a mikrobiota kölcsönhatásba lépjen a hám bélésével. 37 A bélnyálka képződését a bél mikrobiomjának termékei szabályozzák; csíra mentes egereknek a normál serlegsejtek ellenére a vastagbél erősen gyengített nyákrétege van, és bakteriális lipopoliszacharid vagy peptidoglikán hozzáadása a bélnyálka felszabadulását eredményezi a serlegsejtek által. A nyákréteg szerepét a bélbetegségek megelőzésében jól példázza, hogy az egerek, amelyekből hiányzik a fő mucin gén (MUC ‐ 2) mind a kommenzális, mind a patogén baktériumok fokozott transzlokációja fokozott permeabilitással és a hámréteghez való bakteriális tapadással rendelkezik. 44-46 mint ilyen, ezeknél a MUC ‐ 2-hiányos egereknél spontán alakul ki a vastagbélgyulladás. 47
MyD88
A vastagbélben talált két nyálka réteg azonban nincs a vékonybélben. 45 A vékonybélben történő rétegződést azáltal, hogy a Paneth-sejtek antimikrobiális peptideket (AMP-ket) termelnek, amelyek a vékonybél kriptáinak alapján speciális sejtek. Az AMP-k elengedhetetlenek a baktériumok visszatartásához és a hámsejtekkel való érintkezésük minimalizálásához. Az AMP-k Paneth-sejtek általi felszabadulását az interleukin (IL) ‐22 szabályozza, 48 amelynek szekrécióját a bél mikrobioma befolyásolja. 49 Ezt példázza, hogy a Reg III nevű specifikus AMP kifejeződése γ csíramentes egerekben csökkentnek találták. 50 III γ olyan AMP, amely megakadályozza a vékonybél nyálka rétegének behatolását a mikrobiotába, és így korlátozza a hám felszínével érintkezésbe kerülő mikroorganizmusok számát. 51 Míg a III γ megakadályozza a baktériumok behatolását a bélhámon, nem befolyásolja a bél mikrobiomjának összetételét. Ellentétben, α- az alábbiakban ismertetett defenzinek befolyásolják a bél mikrobiomjának összetételét.
A Reg III termelésének szabályozásának egyik módja γ a myeloid differenciálódás elsődleges válasz gén 88 (MyD88) útjának aktiválása révén a bél mikrobiomja kölcsönhatásba lép a Paneth sejtekkel. Kiütve a MyD88 gén a Reg III termelésének jelentős csökkenéséhez vezet γ, ami a kórokozókkal szembeni hatástalan immunválaszhoz vezet, 52 beleértve a harc kudarcát is Listeria monocytogenes. 53 A T-sejt-intrinsic MyD88 hiányában szenvedő állatok dysbiosist és súlyos bélbetegséget mutatnak. 54 A mikrobióm MyD88-Hiányos egerek mennyiségileg különböznek a kontrolltól három baktériumcsalád tekintetében (Lactobacillaceae, Rikenellaceae és Porphyromonadaceae; Asztal 1). 55
Nukleotidkötő oligomerizációs domén 2 és α-defenzinek
Az α-defenzinek, amelyekről kimutatták, hogy szabályozzák a bélben lévő mikrobiota összetételét, 56 a mikrobiotára reagáló panetsejtek által szabadul fel, ezt a folyamatot a nukleotid-kötő oligomerizációs domén-2 (NOD2) receptor szabályozza. 57 NOD2-Hiányos egereknek is van egy bélmikrobiomája, amely minőségileg és mennyiségileg különbözik a kontroll egerektől. Nem csak a Bacteroides, a Firmicutes és a Bacillus jelentősen megnövekedett számát mutatják be, hanem csökkent képességük is a Helicobacter hepaticus, amely egy patogén baktériumfaj (1. táblázat). 58 Ezenkívül a mutációk NOD2 a legerősebb rizikófaktorok a gyulladásos bélbetegség kialakulásához (2. táblázat). A NOD2 mutációval rendelkező betegeknél szignifikáns dysbiosis, megnövekedett Actinobacteriumok és Proteobacteriumok, valamint a Clostridium IV és XIVa csoport szintjének csökkenése mutatkozik a kontrollokhoz képest. (2. táblázat). 59
Az egereken végzett vizsgálatok tovább tisztázták az α- defenzinek az egészségben és a betegségekben. Egy nemrégiben végzett tanulmány transzgénikus egerekkel, amelyek túlzottan expresszálják az embert α- a defenzin-5 szegmentált fonalas baktériumok veszteséget mutat az 56 kontroll egerekhez képest, és ellenállnak Salmonella typhimurium (Asztal 1). 60 Ezenkívül az egereknek hiánya van a enzim hasításához és aktiválásához szükséges enzimhez α- a defenzinekben kisebb a baktériumok száma a Bacteroidetes-ből, mint a vad típusú egerekben. 56 Bár annak pontos mechanizmusa α- a defenzin-5 szabályozza a mikrobiota összetételét, különféle mechanizmusokat javasoltak. Az egyik lehetséges magyarázat az α- a defenzin-5 közvetlenül a luminalis baktériumokra hat, miután diffundál a nyálka rétegén keresztül. 17 Alternatív megoldásként, α- a defenzin-5 antimikrobiális aktivitását fejtheti ki a nyálka külső rétegeiben elhelyezkedő baktériumokon, amelyek a bél lumenében található baktériumok tárolóként szolgálnak. 17.
6-at tartalmazó NOD-szerű receptorcsalád pirin domén
A vékonybél paneth sejtjein kívül a vastagbél hámsejtjei is ellenőrzik a mikrobiom összetételét. A 6-ot tartalmazó NOD-szerű receptorcsalád pirin doménje (NLRP6) egy intracelluláris fehérje, amelyet a bél hámsejtjei expresszálnak, és asszociálódhatnak a kaszpáz-1-vel, és ezáltal befolyásolhatják a gyulladások működését. 61 NLRP6-hiányos egerek (NLRP6 kiütés) a bél mikrobiomjában megváltozik, ami a Prevotella és csökkenése Lactobacillus. Az NLRP6-hiányos egerek megváltozott mikrobioma növeli a hajlamot a vastagbélgyulladásra (1. táblázat). Ez az NLRP6 hiányból eredő fokozott érzékenység a vastagbélgyulladásra vad típusú egerekre terjed, ami azt jelzi, hogy a megváltozott mikrobiom döntő szerepet játszik a vastagbélgyulladás patogenezisében. Bár az NLRP6 hiányosságának megváltozott mikrobiómát eredményező mechanizmusa nem teljesen ismert, az NLRP6 hiányos egerekben csökkent interleukin-18 szintek figyelhetők meg, ami az interleukin-18 jelentős szerepére utal az NLRP6 downstream eseményeiben. 57
Az immunglobulin A rétegződésben és szétválasztásban
A bél mikrobiomjának specifikus összetételeihez kapcsolódó gazda gének
A gazdaszervezet számos olyan génjét azonosították, amelyek a bél mikrobiota specifikus összetételeivel társultak. Ezek a gének kódolhatják azokat a fehérjéket, amelyek specifikus baktériumtermékek, például Toll-szerű receptor 5 (TLR5) detektálásában vesznek részt, vagy lehetnek olyan gének, amelyek bélbetegségekkel társulnak a bél mikrobiomjának specifikus változásaival, például a mediterrán láz génjével. Sok ilyen gén esetében azonban még mindig nem világos, hogy a kódolt fehérjék hogyan befolyásolják a bél mikrobiom összetételét, például a HLA molekulák.
Útdíj-szerű receptorok
Egy másik TLR, az úgynevezett TLR4 a lipopoliszacharid természetes liganduma, 56 amely a Gram-negatív baktériumok membránjának fontos eleme. Érdekes, hogy a TLR4 aktivációról kiderült, hogy meghatározza a betegség súlyosságát a gyulladásos ízületi gyulladás állatmodelljeiben. 72 Azt is megállapították, hogy összefüggésbe hozható a gyulladásgátló citokinek szekréciójával a szinoviális szövetből. 73 Ezen megfigyelések alapján felvetődött, hogy a TLR4 stimuláció a MyD88-függő utak aktiválódásához vezet, amelyek szabályozzák a gyulladásos génexpressziót, és az adaptív immunrendszer pro-gyulladásos citokinek indukciójához vezetnek. 74 A TLR4 aktiválásával járó gyulladásos ízületi gyulladáshoz hasonlóan a TLR2 (a baktériumokból származó lipoteichoinsav liganduma) csökkent expressziója és a TLR9 (amely baktériumokból származó nukleinsavakat képes megkötni) fokozott expressziója van. cöliákiás gyermekeknél figyeltek meg. 75
Mediterrán láz gén
A mediterrán láz (MEFV) gén a pirin nevű fehérjét kódolja, amely részt vehet a veleszületett immunitás szabályozásában. 76 Ennek a génnek a mutációi autoimmun rendellenességhez, családi mediterrán lázhoz vezetnek, amelyet poliszerozitisz és visszatérő, önkorlátozó láz-epizódok jellemeznek, és a bél mikrobiómájának összetételében bekövetkezett változásokkal társul a kontrollokhoz képest. 76 Ezeket a változásokat a baktériumok alacsony változatossága jellemzi, valamint a Bacteroidetes, Firmicutes és Proteobacteria phyla baktériumok populációiban bekövetkezett jelentős eltolódások (2. táblázat). 77
Rezisztinszerű molekula β
A rezisztinszerű molekula β (RELMB) egy vastagbél serlegsejt-specifikus fehérje 78, amely a gyomor-bél traktusban expresszálódik, és amely szerepet játszhat a bél mikrobiotájára adott veleszületett válaszokban. 79 Javasoljuk továbbá, hogy vonják be a Reg III kifejezésének szabályozásába γ. 50 Egy tanulmány felhasználásával RELMB-Deficit egerek különbséget mutattak a Bacteroidetes, Proteobacteria és Firmicutes néhány ritka származási helyében a bélben, összehasonlítva a vad típusú egerekkel, amikor magas zsírtartalmú étrendet tápláltak (1. táblázat). 80
Elhízott gén
Leptin, az elhízottak által kódolt hormon (OB) gén, kritikus az étvágy, az energiafelhasználás és az anyagcsere szempontjából. A leptin az immunsejtek szabályozásában is részt vesz, és hiánya a fertőzések elleni védelem csökkenésével jár. 82 A leptin szerepét a bél mikrobiomjának szabályozásában a OB gén. A leptinhiányos egerek nemcsak elhízottak, hanem a bél mikrobiómájának változását is mutatják, amelyet rengeteg Bacteroides összehasonlítva a kontrollokkal (1. táblázat). 83.
Humán leukocita antigén
Az MHC a HLA I. és II. Osztályú lókuszokat kódolja, amelyek a legtöbb polimorf gént jelentik az emberben. Az I. és a II. Osztályú gének a HLA lokuszok két fő osztálya, amelyek részt vesznek az antigén bemutatásában és a fertőzések kiürülésében. A HLA gének polimorfizmusa a kórokozók szelektív nyomásának tulajdonítható. Ezért megmaradtak azok a HLA-allélok, amelyek a CD4 + T-sejtek aktiválásával és a citokinek termelésével a fertőzés kiürülését eredményező legtöbb kórokozóval szemben reakciót generálnak. 84 Bizonyos II. Osztályú molekulák azonban társultak gyulladásos betegségekkel. A dysbiosis és a genetikailag hajlamos betegségek társulása a gazda gének szerepére utal a bél mikrobiota alakításában.
Következtetések
Köszönetnyilvánítás
A tanulmányt a Védelmi Minisztérium, a W81XWH ‐ 10‐1–0257 és az NIH AR30752 támogatásával támogatták.
Közzétételek
Minden szerző kijelenti, hogy nincsenek versengő érdekei.
- A csirke bél mikrobiota és a fehérje emésztése közötti kölcsönhatás - ScienceDirect
- A saját anyatej és a tápszer különböző arányainak hatása a bél mikrobiotájára
- Tömegspektrometrián alapuló metabolomika - Dettmer - 2007 - Tömegspektrometriai vélemények - Wiley Online
- Késői megjelenésű hipogonadizmus metabolikus hatása - Grossmann - 2020 - Andrológia - Wiley Online Könyvtár
- A magas energiájú étrend veszélyezteti a férfi termékenységet Rato - 2014 - Elhízási vélemények - Wiley Online Könyvtár