A belek és a vesék: a rossz házasság veszélyes lehet
Absztrakt
Bevezetés: a belek az egészség és a betegség szempontjából
Az a korábbi nézet, miszerint a bél nagyrészt inert szerv, több mint egy évtizede vitatott, mivel a bél mikrobiota olyan alapvető funkciókat lát el, amelyeket az emberi test önmagában nem képes ellátni [1], például az alapvető élelmiszerek betakarítását, az energiát megtakarítás, a xenobiotikumok anyagcseréje, védelem az idegen mikrobák inváziója ellen, a bél hámjának megújulása, vitaminok képződése és az immunfunkció kiegyensúlyozása [1, 2].
A „normális” mikrobiom meghatározása - az egyes személyek közötti szembetűnő különbségekkel, amelyek néha napról-napra olyan elemek miatt következnek be, mint az étrend vagy a testmozgás [3, 4], felvetette a nyilvánvaló kérdést arról, hogy mi történik a betegség során [5, 6] . Már 2003-ban leírták a bél mikrobiómájának változásait a többszervi elégtelenség, a vastagbélrák és a gyulladásos bélbetegségek esetében [2]. Az elmúlt évtizedben ezt a listát a nagyon elterjedt krónikus betegségek hosszú sora egészítette ki. A májbetegség és a bélmikrobiom közötti összefüggésre ezek egymás melletti elhelyezkedésére számíthatunk [7]. Mindazonáltal összefüggést bizonyítottak okként vagy következményként a cukorbetegség, az elhízás, az inzulinrezisztencia, a metabolikus szindróma, az öregedés, a mikro-gyulladás és a szív- és érrendszeri betegségek között [6, 8, 9].
Arra a tudatosságra, hogy a krónikus vesebetegség (CKD) is összefügg a bél állapotával, viszonylag későn érkezett [10], és részben abból a felismerésből fakadt, hogy számos uraemiás szindrómában aktív toxin a bélből származik [11, 12].
A bél mikrobiomjának változásaihoz kapcsolódó fent említett krónikus állapotok közül sok veseelégtelenséggel is összefügg, vagy annak okaként tekintenek rá. Felmerült a kérdés, hogy a bélmikrobiom lehet-e az egyik közös nevező, amely összekapcsolja ezeket az elemeket [13, 14]. Lehetséges, hogy a bélben keletkező oldott anyagok és a jelenleg uraemiás toxinok egy része normálisan működő vese esetén is mérgező hatású [15], és így nemcsak uraemiás toxinok, hanem általában toxinok is. Ezt a hipotézist azonban meg kell erősíteni.
Így jó okok vannak arra, hogy alaposan megvizsgáljuk a bél és a vesék közötti kölcsönhatást, különösen azért, mert a mechanizmusok megértése lehetőséget teremthet új, célzott terápiás beavatkozások kidolgozására [13, 16]. Ebben a narratív áttekintésben megvizsgáljuk a témában a technika jelenlegi állását, ideértve a bél és az uraemiás toxicitás kétirányú kölcsönhatását, a bél uraemiás toxintermelésben betöltött szerepének koncepciójának bizonyítékát, a generált molekulák és a rendelkezésre álló terápiás lehetőségek átfogó áttekintése, kulcsfontosságú elemnek tekintve az uraemiás toxicitást/toxinokat.
Kétirányú interferencia a bél és az uraemia között
A bél felelős a patofiziológiai hatású uraemiás retenciós vegyületek előállításáért, míg az uraemia önmagában strukturális és funkcionális bélváltozásokat okoz, amelyek közvetetten morbiditást és mortalitást okoznak [17] azáltal, hogy gyulladást váltanak ki különböző utakon [10]. Tehát az uraemia és a belek közötti áthallás két különböző elemen alapul, de a következmények ugyanazok, kettős hatáson alapulnak: a mikragyulladás indukciója, amely együtt jár az előre aktivált immunrendszer képtelenségével az ingerekkel való megbirkózás érdekében [10, 18], ami fokozott fertőzésveszélyt eredményez, amely a végén ismét gyulladásgátló. A gyulladás továbbra is a szövődmények és a halál egyik fő oka a CKD-ben, de a nem CKD-ben is.
A bél mint az uraemiás toxinok forrása
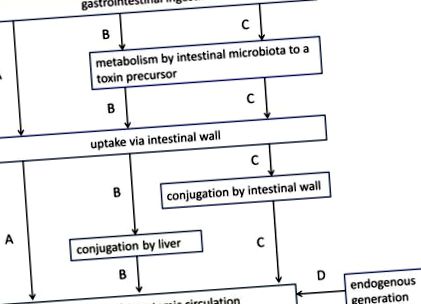
Az urémiás toxinok többféle módon keletkeznek (1. ábra): (i) némelyikük (pl. Peptidek) a szervezetben a bél hozzájárulása nélkül termelődik; (ii) mások (pl. a fejlett glikációs végtermékek - AGE-k) a táplálékelemek bél általi módosítatlan felszívódása révén jutnak be a szervezetbe; (iii) végül lényegében fehérjéhez kötött oldott anyagok, például fenolok, indolok vagy hippurátok, de a trimetil-amin-oxid (TMAO) is metabolikusan keletkeznek mikrobiális fermentációból származó prekurzorokból [12, 19]. Számos retenciós oldott anyag (pl. AGE, húgysav) részben a bélből, részben a testből származik.
Az uraemiás toxin-képződésben résztvevő fő metabolikus utak. (A) lenyelés a gyomor-bél traktuson keresztül és a bélfalon keresztüli közvetlen módosítatlan felvétel a szisztémás keringésbe (pl. fejlett glikációs végtermékek); (B) egy prekurzor (például aminosav) gyomor-bél általi felvétele, amelyet a bél mikrobiota átalakít egy másik prekurzorrá (például indol); a bélfalon és a portális vénán keresztül történő felvétele után ezt az elődöt a máj tovább konjugálja (pl. indoxil-szulfát), mielőtt átkerülne a szisztémás keringésbe; (C) egy prekurzor (például aminosav) gyomor-bél általi felvétele, amelyet a bél mikrobiota átalakít egy másik prekurzorrá (például indol); a prekurzor a bélfalon keresztül történő felvétele során konjugálódik (pl. indoxil-szulfát), majd további módosítás nélkül a májon keresztül a szisztémás keringésbe kerül; (D) endogén generáció a gyomor-bél traktus hozzájárulása nélkül (pl. β2-mikroglobulin). Módosítva: Schepers et al. [12].
A bél aktív szerepe különösen hangsúlyos a fehérjéhez kötött uraemiás toxinok (pl. Indoxil-szulfát és p-krezil-szulfát) képződésében (1. ábra, B és C útvonal). Eredetükben olyan aminosavak találhatók (casu triptofánban és tirozinban), amelyek a bél mikrobiotájában uraemiás toxinok, például indol és p-krezol prekurzorává alakulnak. Ezeket azután konjugálják a felszívódás során a bélfalban, vagy tovább a májban, mielőtt a szisztémás keringésbe kerülnének [12]. A leggyakoribb konjugátumok a szulfátok, bár sok más szerkezeti változat is lehetséges (1. táblázat). Ezenkívül különböző funkciós csoportok, például metil- vagy hidroxilcsoportok is hozzáadhatók. Egyes vegyületek változatlanok maradnak (pl. Kinurenin).
Asztal 1.
A bélben keletkezett uraemiás metabolitokat alkotó prekurzorok és konjugátumok a
| Elődök |
| Indol |
| Fenol |
| Cresol |
| Hippurate |
| Metil-amin |
| Konjugátumok |
| Szulfát |
| Laktát |
| Acetát |
| Glükuronid |
| Propionát |
| Acetilglicin |
| Propionilglicin |
| Oxid |
a A lista nem teljes.
További járulékos tényezők
Az urémiában az úgynevezett asszimilációs folyamatban részt vevő számos további bélmódosítás az uraemiás toxinok termelésének növekedését okozza a normális állapothoz képest. Először is, ha az aminosavak kevésbé jól felszívódnak a gyomor-bél traktus mentén, több szubsztrátot mutatnak a bélben a mikrobiális anyagcseréhez [12]. Másodszor, a bél mikrobiota egyensúlya elmozdul a proteolitikus mikroorganizmusok javára, amelyek fermentációval több toxin prekurzort termelnek (lásd alább) [20–22]. Végül a rendellenes bélmozgás, amely meghosszabbítja a vastagbél tranzitját [23, 24], megfosztja a vastagbélt a szénhidráttól, ami a proteolitikus fajok upstream expanzióját indukálja, növelve a bakteriális toxinok képződését és növelve azok felszívódásának idejét [23]. Egy elegáns tanulmányban Bammens et al. értékelte a p-krezol, a krezil-konjugátumok prekurzorának és a nemzedékük helyettesítőjének vizelettel történő kiválasztását: 24 órán keresztül kb. kétszer annyi p-krezol ürült ki előrehaladott CKD-s betegek vizeletében, mint a normál vesefunkcióval rendelkező kontrolloké, és a vizelet p-krezol kiválasztása negatívan korrelált a GFR-rel [25].
Ez egy fejjel lefelé fordított világ: a belek uraemia következtében bekövetkező változásai
A bél nem csak szerepet játszik az uraemiás toxinok képződésében, hanem az uraemia (és ezen túlmenően az uraemiás toxinok) fordítottja is funkcionális és strukturális változásokat okozhat a bélben, pato-fiziológiai következményekkel járva.
Először is, azok a baktériumfajok, amelyek erjesztéssel hajlamosak az uraemiás toxinok előállítására, kiváltságosak az urémiában (2. táblázat), és túl vannak azokban a védőfajokban, mint a laktobacillusok [20, 21]. Eddig csak három tanulmány hasonlította össze az uraemiás és a kontroll betegek bél mikrobiotájának összetételét bakteriális genomikai elemzéssel: mindegyik egyensúlyhiányt talált a bélbaktériumok arányos eloszlásában a kóros hatású fajok túlsúlyával és/vagy a azok, amelyeknek nincs káros hatása [21, 26, 27], azonosak az uraemiás patkányoknál korábban bemutatottakkal [26]. Korábbi, nem genomi technikákat alkalmazó vizsgálatok azt is meghatározták, hogy számos proteolitikus fermentációra hajlamos baktériumfaj, köztük a clostridia fajok is nagyobb számban fordulnak elő [20].
2. táblázat.
Bélbaktérium-fajok erjesztése a
| Clostridia |
| Clostridium bifermentans |
| Clostridium sporogenes |
| Clostridium clostridiforme |
| Clostridium leptum |
| Peptostreptococcus asaccholyticus |
| Peptostreptococcus indolicus |
| Bacteroidetes |
| Bacteroides thetalotaomicron |
| Bacteroides putredinis |
| Egyéb |
| Fusobacterium nucleatum |
| Actinomyces israelii |
| Megalosfaera elsdinii |
| Propionibacterium acnes |
a Smith és MacFarlane alapján [20].
Másodszor, az uraemiában a vastagbélbaktériumok hajlamosak olyan testrészekre költözni, ahol általában nincsenek jelen, hacsak nem nagyon alacsony mennyiségben (transzlokáció). Ez magában foglalja a mikrobák vándorlását a jejunumba [23], a mesentericus nyirokcsomókba, majd tovább lefelé a vérbe és a test többi részébe [22, 28–31]. Bossola és mtsai. bakteriális eredetű DNS-fragmenseket talált a hemodializált betegek vérében, de mivel a dializátumban baktériumokat is kimutattak, nem zárható ki egy bélen kívüli forrás, azaz a szennyezett dializátum [28]. Wang és mtsai. hasonló eredményekről számolt be nem dializált CKD-s betegeknél, rámutatva arra a tényre, hogy a dializátumtól eltérő források is felelősek lehetnek ezekért a DNS-fragmensekért uraemiás betegeknél, és ebben az esetben a belek az elsődleges tettesjelöltek [22]. Meggyőzőbben, hogy a vérben talált összes baktérium DNS megegyezett a bélben lévő nemzetségekéivel [22]. Urémiás patkányokban az enterális fajok bakteriális DNS-ét bizonyították a mesenterialis nyirokcsomókban, a vérben, sőt a májban és a lépben is [30]. Embereknél és állatoknál egyaránt ez a baktériumok elszaporodása és transzlokációja mikro-gyulladással járt [22, 30].
Harmadszor, meggyőző érvek a bélvédő gát elvesztését támogatják uraemia esetén. Az 1991-ben publikált első ilyen irányú eredmények után [32] Vaziri és munkatársai in vitro és ex vivo bizonyították, hogy az uraemiás környezet megzavarta a bélhám védelmét [21, 33] azáltal, hogy kimerítette a szűk kereszteződések fehérje alkotóelemeit (Zona Occludens- 1 (ZO-1), Claudin-1 és Occludin). Az ezt követő szivárgás gyulladást okozhat, ha az endotoxin transzfert továbbterjeszti a véráramba. Vaziri és mtsai. azt is bizonyítani tudta, hogy a karbamid ugyanazt a hatást váltotta ki [34], további fokozással az ureáz hozzáadásával, ami arra utal, hogy az ammóniát termelő ureazt termelő baktériumok ezt a hatást felerősítik [34]. Ugyanezek a szerzők azt is bizonyították, hogy az AST-120 (Kremezin R) szorbens beadása védte a bélgátat urémiás patkányokban [35]. Mivel az AST-120 lényegében a fehérjéhez kötött uraemiás oldott anyagok koncentrációjának csökkentéséről ismert, nem pedig a karbamid koncentrációjáról, ésszerűen feltételezhető, hogy a karbamidon kívül más uraemiás oldott anyagok is, vagy ezek prekurzorai, megzavarják a bélgátat.
Összefoglalva tehát az uraemia egy sor bélváltozást okoz (bakteriális transzlokáció, a bélgát szivárgása és a fehérjéhez kötött uraemiás toxinok képződése), amelyek mind gyulladáshoz vezetnek, ami a morbiditás és a mortalitás egyik fő oka, mind a CKD, mind a nem CKD populáció.
A koncepció igazolása
Az elméletet, miszerint a bélmikrobiota hozzájárul az uraemiás toxinképződéshez az étrendi fehérjebevitelből származó bomlástermékek metabolizálásával, számos, koncepciót bizonyító tanulmány megerősítette.
1965-ben Einheber és Carter kimutatták, hogy a csíra nélküli patkányok anephricát hosszabb ideig túléltek és kevesebb súlyt vesztettek, mint bél mikroorganizmusokkal rendelkező társaik [37]. 1982-ben Yokoyama és mtsai. kimutatta, hogy a bél sterilizálása antibiotikumok kombinációjával normál veséjű elválasztó sertéseknél csökkentette a fenolos és aromás bakteriális metabolitok ürülékkel és vizelettel történő kiválasztását, és növelte testtömegüket [38]. Egy nemrégiben elvégzett tanulmány kimutatta, hogy a neutropenia epizódjainak antibiotikus profilaxisa olyan betegeknél, akik allogén őssejt-transzplantációt kaptak, a bél mikrobiota elmozdulását és a vizelet indoxil-szulfát koncentrációjának drámai csökkenését eredményezte [39].
Nemrégiben Wikoff és mtsai. céltalan metabolomikus tömegspektrometriával összehasonlítva a normál veseműködésű csíramentes egerek plazmáját a normál széklet mikrobiotájú állatok plazmájával, és számos megkülönböztető tényezőt jelezhet, amelyek között számos fehérjéhez kötött urémiás toxinként ismert vegyület, például indoxil-szulfát, hippursav és fenilecetsav [40], amelyek szintén a vese tubuláris szerves anion transzporterek (OAT) szubsztrátjai, és megmagyarázzák azok megmaradását veseelégtelenségben, ha a tubulusok sérültek [41].
Aronov és mtsai. tömegspektrometriás metabolometriás elemzést végzett hat vastagbél nélküli hemodialízisben szenvedő beteg plazmakoncentrátumainak koncentrációjának összehasonlítására kilenc vastagbélben szenvedő beteg koncentrációjával [42], e célból megkülönböztetve a metabolitokat. A 30 diszkriminátor között számos fehérjéhez kötött uraemiás retenciós termék volt. A legtöbb esetben a 20 évvel ezelőtti plazmakoncentrációk aránya alacsonyabb szérumkoncentrációt, valamint fenol és p-krezol székletvesztését mutatta veganistáknál [44]. A hemodialízisben szenvedő betegek randomizált, kontrollált vizsgálatában (RCT) 6 hétig rezisztens keményítő adagolásának növelése az étkezési rostbevitelben csökkentette a plazma nélküli indoxil-szulfát mennyiségét, míg a szabad p-krezil-szulfát csökkenésének tendenciája figyelhető meg [45].
Eloot és mtsai. értékelte a kapcsolatot több, lényegében fehérjéhez kötött uraemiás toxin pre-dialízis koncentrációja és számos potenciális befolyásoló tényező között, mint például a Kt/Vurea, mint a dialízis megfelelőségi mutatója, a normalizált fehérje katabolikus ráta (nPCR), mint az étrendi fehérje bevitel indexe, a maradék vesefunkció, az életkor, a cukorbetegség, a nem, a testtömeg és a dialízis évjárata [46]. Korrelációt találtak, lényegében a reziduális vesefunkció és az nPCR szempontjából, és nem a többi tényezőre, köztük a Kt/Vurea-re, ami ismét arra utal, hogy az étrendi fehérjék emésztése szerepet játszik az uraemiás toxinok képződésében és koncentrációjában, sőt felülírja a dialízis megfelelőségének hatását.
A bél eredetű vegyületek toxicitása
Anélkül, hogy ugyanazt a merev megközelítést követtük volna, mint amelyet az említett szisztematikus áttekintésben alkalmaztak [48], legalább öt újabb közleményt találtunk, amelyek megfelelnek az utóbbi tanulmány felvételi kritériumainak, amelyek a gyógyszer-anyagcsere gátlására vonatkoznak [55]; fokozott áthallás a leukociták és az endothelium között, a glycocalyx lebomlása és az erek szivárgása [56]; az oszteoblasztok apoptózisa [57]; tubuláris endoteliális növekedési faktor receptor indukciója, amely szöveti átalakuláshoz vezet [58] és az angiotenzin II lebomlásának gátlása [59].
Hasonló hatásokat írtak le más fehérjéhez kötött toxinokra is [60], mint például a hippursav [61–63], az indol-ecetsav [61, 62, 64–67], a fenil-ecetsav [61, 67, 68]; p-krezil-glükuronid [56, 67, 69] és kinurénsav [61, 67] (3. táblázat).
3. táblázat.
Proteinhez kötött uraemiás toxinok, kivéve az indoxil-szulfátot és a p-krezil-szulfátot, toxikus hatással a
- A szintetikus bélés jobb gyógyszert juttat a vékonybélbe; Harvard Közlöny
- Az alacsony fehérjetartalmú étrend védőhatása a tubulo-interstitialis károsodások ellen a diabéteszes vesékben
- A vesék egészségének megőrzésének módjai
- Az állati fehérje hatása a vesékre
- Miért fáj a vesém, ha szódát iszom