A butirát három különböző alkalmazási útjának összehasonlítása a vastagbél anasztomotikus erejének javítása érdekében patkányokban
J. W. A. M. Bosmans
1 Általános Sebészeti Osztály, Maastrichti Egyetem Orvosi Központ, P.O. Box 5800, 6202 AZ Maastricht, Hollandia
2 NUTRIM táplálkozási és fordítási anyagcsere-kutatási iskola, Maastrichti Egyetem, Maastricht, Hollandia
A. C. H. M. Jongen
1 Általános Sebészeti Osztály, Maastrichti Egyetem Orvosi Központ, P.O. Box 5800, 6202 AZ Maastricht, Hollandia
2 NUTRIM táplálkozási és fordítási anyagcsere-kutatási iskola, Maastrichti Egyetem, Maastricht, Hollandia
B. T. C. Boonen
1 Általános Sebészeti Osztály, Maastrichti Egyetem Orvosi Központ, P.O. Box 5800, 6202 AZ Maastricht, Hollandia
S. van Rijn
1 Általános Sebészeti Osztály, Maastrichti Egyetem Orvosi Központ, P.O. Box 5800, 6202 AZ Maastricht, Hollandia
2 NUTRIM anyagcsere táplálkozási és fordítási kutatási iskolája, Maastrichti Egyetem, Maastricht, Hollandia
F. Scognamiglio
3 Trieszt Egyetem, Élettudományi Tanszék, Trieszt, Olaszország
L. Stucchi
4 SIGEA Srl, AREA Science Park, Trieszt, Olaszország
M. J. J. Gijbels
5 Patológiai és Molekuláris Genetikai Tanszék, CARIM, Maastrichti Egyetem, Maastricht, Hollandia
6 Orvosi Biokémiai Tanszék, Akadémiai Orvosi Központ, Maastricht, Hollandia
E. Marsich
7 Orvosi, Sebészeti és Egészségtudományi Tanszék, Trieszt Egyetem, Trieszt, Olaszország
N. D. Bouvy
1 Általános Sebészeti Osztály, Maastrichti Egyetem Orvosi Központ, P.O. Box 5800, 6202 AZ Maastricht, Hollandia
2 NUTRIM táplálkozási és fordítási anyagcsere-kutatási iskola, Maastrichti Egyetem, Maastricht, Hollandia
Társított adatok
Absztrakt
Bevezetés
A kiterjedt kutatások ellenére az anasztomotikus szivárgás (AL) továbbra is az egyik legféltettebb szövődmény a vastagbél-műtét után. Mivel a butirát beöntésekről ismert, hogy fokozzák az anasztomotikus gyógyulást, ebben a tanulmányban számos beadási módot tártak fel.
Mód
Három, butirátot magában foglaló intraluminális megközelítést vizsgáltak: (1) butirint tisztító tapasz, (2) egyszeri hialuronán-butirát injekció (HA-But) a proximális anastomosis felépítése előtt és (3) rektális hyaluronan-butyrate (HA-But) ) beöntések, amelyeket disztális anasztomózisokhoz terveztek. A fő eredmény AL volt, a másodlagos eredmények pedig a repedés nyomása, az anastomosis szövettani elemzése, az MMP aktivitás detektálására szolgáló zymográfia és az MMP2, MMP9, MUC2 és TFF3 génexpressziójának qPCR-je.
Eredmények
Sem a tapaszok, sem az injekciók nem vezettek az AL csökkenéséhez az 1. és a 2. kísérletben. A 3. kísérletben az AL szignifikáns csökkenését érték el a (HA-But) beöntéssel a kontroll csoporthoz képest, magasabb repedési nyomással együtt. A szövettani elemzés a 2. kísérletben csak fokozott gyulladást mutatott ki a hialuronán injekciós csoportban a kontroll csoporthoz képest. A sebgyógyulás tekintetében nem találtunk más különbséget. A zymográfia az MMP9 csökkent proenzimjét azonosította, amikor a HA-Butt rektális beöntésként adták be. A qPCR egyetlen kísérletben sem mutatott szignifikáns különbséget a csoportok között.
Következtetés
A butirát beöntések hatékonyak a vastagbél anasztomózisának fokozásában. Az AL csökkentésére szolgáló, továbbfejlesztett butirátalapú megközelítések mind a proximális, mind a disztális anasztomózis esetében nem voltak hatékonyabbak, mint önmagában a butirát beöntések. A további kutatásoknak arra kell összpontosítaniuk, hogy az exogén butirát hogyan javíthatja az anasztomotikus gyógyulást a gyomor-bélműtét után.
Elektronikus kiegészítő anyag
A cikk online verziója (doi: 10.1007/s00384-016-2718-z) kiegészítő anyagot tartalmaz, amely az engedélyezett felhasználók számára elérhető.
Bevezetés
A kiterjedt kutatások ellenére az anasztomotikus szivárgás (AL) továbbra is az egyik legféltettebb szövődmény a vastagbél-műtét után. Ez továbbra is magas morbiditást és halálozást eredményez, hosszan tartó kórházi tartózkodást és magas egészségügyi költségeket okoz [1–3]. Számos tanulmány készült ezzel a témával kapcsolatban, amelyek mindegyike az anasztomotikus gyógyulás javítására irányul, és ezáltal megakadályozza a szivárgást. Mivel az anasztomotikus szivárgás előfordulása az évek során nem csökkent, a megoldás iránti igény továbbra is fennáll [4, 5].
Korábbi állatkísérletek kimutatták, hogy a butirát - a túlsúlyos rövid láncú zsírsavak (SCFA-k) egyikének - rektális beadása magasabb vastagbél anasztomózisokban jelentkező repedési nyomással jár, fokozottabb szilárdságot igényelve, amely megakadályozhatja az anasztomotikus szivárgást [6–8].
Ezek a pozitív eredmények nem változtattak a jelenlegi gyakorlaton, és olyan humán vizsgálatokról sem számoltak be, amelyekben a betegek posztoperatív butirát-beöntést kaptak az anasztomotikus erő fokozása érdekében. Ez nem meglepő, ha figyelembe vesszük, hogy a klinikusok nem szívesen látják a beöntést közvetlenül a műtét után, különösen akkor, ha törékeny végbél anasztomózisról van szó. A vízben oldódó kontraszt beöntéseket gyakran használják a colorectalis AL jelenlétének meghatározására, főleg végbél reszekció után. Ezeket a beöntéseket azonban soha nem adják meg a nagyon korai posztoperatív szakaszban (
Egy nemrégiben készült tanulmány azonban kimutatta, hogy a butirátnak figyelemre méltó gyulladáscsökkentő és regeneráló hatása van, javítva a bélnyálkahártya helyreállítását vastagbélgyulladásban szenvedő patkányokban [9]. A butirát serkenti az új hámképződést, és befolyásolhatja a kollagén lízisét a mátrix metalloproteináz (MMP) felszabadulásának csökkentésével [10]. A butirát a baktériumok fermentációs folyamatának terméke, amely főleg a disztális vastagbélben fordul elő. Mivel ez a kolonociták legfontosabb energiaforrásaként szolgál [11], hipotézisünk az, hogy a butirát koncentrációjának növelése fokozott anasztomotikus gyógyulást eredményez a vastagbélben. Számos tanulmány azt jelzi, hogy a butirát befolyásolja a vastagbél nyálka rétegének összetételét és vastagságát a mucin gén expressziójának megváltoztatásával [12] és a vastagbél hámjának táplálkozási hiányával, és hogy a butirát specifikus G-fehérjéhez kapcsolt jelátviteli molekulaként is működhet. receptorok, amelyek részt vesznek a vastagbél nyálkahártyájának mikrobiális aktivitással szembeni immunfelügyeletében [13]. Újabban kimutatták, hogy azok az egerek, amelyeknek a vastagbél nyálkahártyáján (Muc2 -/-) elégtelen nyálkaréteg van, a kontroll egerekhez képest gyakrabban szenvedtek anasztomotikus szivárgástól [14].
Továbbá állatkísérletek azt mutatták, hogy a butirát beöntések jelentős pozitív hatással vannak a bal vastagbél anasztomózisaira, de ez a hatás gyengébb volt a vastagbél jobb oldalán [8]. Nyilvánvaló, hogy nem azonos térfogat éri el a proximális anasztomotikus helyet a disztális anastomosishoz képest, ami megmagyarázhatja ezeket a megállapításokat. Egy másik magyarázat az lehet, hogy a butirátot termelő baktériumok főleg a vastagbél disztális részén található nyálka rétegben helyezkednek el, hogy a proximális vastagbél nem reagál nagyobb mennyiségű butirátra, egyszerűen azért, mert a proximális enterociták nem ismerik ezt az energiát forrás elérhető, és nem tudják használni. A butirát jótékony hatásának növelése érdekében hialuronánt (HA), egy glikozaminoglikánt adtunk hozzá, amelyről ismert, hogy elősegíti a neovaszkularizációt, fokozza a hegesedés folyamatát, és jótékony hatással van a sejtek proliferációjára több szövetben [15, 16]. A hialuronán a gyulladásos válasz visszaszorításában is szerepet játszik. Úgy tűnik, hogy szabad gyökfogó és antioxidáns tulajdonságai, valamint a proteinázokra, például az MMP-kre gyakorolt, feltételezett gátló hatása felelős ezért a visszaszorításért, stabilizálva a granulációs szövetet a gyógyulási folyamat során [16].
Ebben a tanulmányban számos módszert vizsgáltunk a proximális anasztomotikus erő javítására azáltal, hogy butirátot alkalmaztunk az anastomosis közelében: tapasz, injekciók és beöntések segítségével. Célunk egy olyan módszer kifejlesztése volt, amely alacsonyabb anasztomotikus szivárgási arányt eredményezett, és praktikusabb módszerek, amelyek a mindennapi klinikai gyakorlatban alkalmazhatók.
Mód
Állatok
Nyolcvannégy Wistar patkányt használtunk, testtömegük 250-300 g. Az állatokat a Maastrichti Egyetem központi állattartó intézményében helyezték el és gondozták. Minden állat számára ad libitum hozzáférést biztosítottak az élelemhez és a vízhez, és a helyi előírásoknak megfelelően gondozták őket. A műtét után a jóléti értékelést naponta kétszer, standardizált módszerrel végezték el, és az állatoknak fájdalomcsillapítót kaptak kellemetlenség esetén. A kísérleti protokoll megfelelt a holland állatkísérleti törvénynek, és a Maastrichti Egyetem Orvosi Központ állatkísérleti bizottsága jóváhagyta. Az in vivo kísérletek jelentésére vonatkozó ARRIVE irányelveket követték [17] (lásd még az S1 kiegészítő adatokat).
Dizájnt tanulni
A vizsgálat elsődleges célja annak vizsgálata, hogy az anasztomotikus szivárgás csökkenthető-e szivárgásmodellben intraluminális butirint eluáló tapasz, butyrate egyszeri intraluminális beadása vagy napi HA-But beöntés alkalmazásával. A proximális anasztomózisokhoz mind intraluminális, butirint eluáló tapaszt használtunk, amely lefedte az anastomózist, mind pedig egyszeri intraluminális hialuronán-butirátot (HA-But). Mivel a legtöbb kutatást a vastagbél disztális részén végezzük, a HA-But beöntések tesztelésére egy bal-vastagbél anasztomózis modellt is alkalmaztunk. Ez a következő három kísérletet eredményezte:
Butirint eluáló tapaszok (20 massa% tributirin) szemben a placebo tapaszokkal (n = 12/csoport)
HA-But injekció (5% HA, 60 mM butirát) szemben a HA injekcióval (5% HA) szemben sóoldat injekcióval (0,9% NaCl) (n = 8/csoport)
Öt milliliter HA-But beöntés (5% HA, 60 mM butirát) és 5 ml nátrium-butirát (60 mM) beöntés, szemben egy kontrollcsoporttal, amely nem kapott beöntést (n = 12/csoport)
A tapaszokat szívesen adta a Polyganics (Groningen, Hollandia), beöntéseket és injekciókat pedig a Sigea (trieszti, olaszországi) készített.
Valamennyi kísérlet során a követés 7 nap volt.
Sebészeti eljárás
Valamennyi patkány 0,05 mg/kg buprenorfint kapott fájdalomcsillapítóként, és izofluránnal altattuk őket. A hasüreghez való hozzáférés érdekében minden kísérletben 5 cm-es craniocaudalis középső metszést végeztek a bőrön és a hasizmokon. A vakbélt ezután azonosították, és a peritoneális üregen kívül steril gézekre helyezték, amelyeket steril sóoldattal hidratáltak a kiszáradás megakadályozása érdekében. A proximális anasztomózisok esetében a vastagbélt két centiméter távolságban transzformálták a vakbéltől, és négy egymástól megszakított polipropilén 6/0 varrat (Prolene, Ethicon, Johnson & Johnson) segítségével végpontok közötti végső anasztomózist hoztak létre (Exp 1 és 2, lásd az S1 kiegészítő adatokat ). A 3. kísérletben az anastomózist hasonló módon, de 4 cm ab ani-nál hajtották végre. Az anastomosis elvégzése után a beleket újrapozícionálták, és a hasat két rétegben lezárták, egy futó varrattal az izomréteg számára (Vicryl 4-0, Ethicon, Inc.) és megszakított varratokkal a bőr számára (Monocryl 4-0, Ethicon, Inc. ).
Makroszkopikus végpontok
Az anasztomotikus szivárgást úgy határoztuk meg, hogy (1) nincs anasztomotikus szivárgás, (2) kicsi tályog a 3. anasztomotikus helyen, (3) nagy (> 1 cm 3) tályog az anastomotikus helyen vagy (4) teljes dehiscencia peritonitisszel/halál széklettel hashártyagyulladás. Az anasztomotikus helyre tapadásokat van der Ham és mtsai. [18]
Repesztő nyomás
A repedési nyomást a korábban leírtak szerint mértük [19]. Röviden, egy 5 cm-es bélszegmenst, beleértve az anastomózist a tapadó szervekkel, blokkoltuk, és az anastomosis disztális részét megszorítottuk. Műanyag csövet illesztettek a proximális végbe, és egyetlen poligaktin 4/0 varrattal ligáltuk (Vicryl, Ethicon). A teljes anasztomózist foszfáttal pufferolt sóoldatba merítettük, míg a levegőt manométerrel (IDEE, Maastrichti Egyetem, Hollandia) infúzióval infúzióztuk, és a vastagbél felfújásával manuálisan megnöveltük a nyomást. A repesztési nyomást az intraluminális nyomásként definiálták, amelynél az anastomosis (mBar) eredetileg légszivárgást figyelt meg.
A szövet előkészítése
Érzéstelenített patkányokban az anasztomotikus helyet (a repesztési nyomás mérése után) 0,5 cm-es margóval boncoltuk az anastomosis minden helyén. A szövetmintákat három egyenlő részre osztottuk: egyet qPCR-re, egyet zymográfiai célokra és egyet immunhisztokémiai célokra. Ez utóbbit hosszanti irányban levágták, és a szöveteket kifeszítették és egy parafa rétegre rögzítették annak érdekében, hogy biztosítsák az egyenes anasztomotikus vonalat és javítsák a szövettani értékelés minőségét a formalinban történő rögzítés előtt (S2 kiegészítő adatok). A szövettani festés elvégzése előtt a metszeteket para-xinmentesítettük xilolban, és etil-alkoholos oldatban desztillált vízre rehidratáltuk. A qPCR elemzésre szánt részt gyorsan fagyasztottuk folyékony nitrogénben, és -80 ° C-on tároltuk, amíg az mRNS izolálásához szükség volt.
Szövettan és immunhisztokémia
A metszeteket standard haematoxilin-eozinnal és Picro Sirius Red-rel festettük Direct Red 80 és Picric Acid oldattal (Sigma-Aldrich, Hollandia).
Független, tapasztalt állatpatológus vak szövettani értékelést végzett a kapott szöveten, pontozva (0-tól 4-ig) a gyulladás, a granulocita beáramlás, a fibroblaszt aktivitás és a kollagén lerakódás szövettani szakaszait. A kollagénadagot házon belüli szoftver alkalmazásával számítottuk ki polarizált fénymikroszkóppal készített képeken (Leica DM5000B, Leica Microsystems, Wetzlar, Németország).
MMP2, pro-MMP9 és MMP9 aktivitáselemzés zymográfia segítségével
Az MMP2 és MMP9 aktivitásokat zselatin zymográfiával értékeltük, mivel az MMP aktivitásának növekedése szerepet játszik az AL patogenezisében [20]. A mintákat a szövetekből lizáltuk és zselatint tartalmazó poliakrilamid gélre töltöttük (10% Ready Zymogram Gel, Bio-Rad, Hollandia). A gélelektroforézist 100 V feszültségen 30 percig végeztük. Ezt követően a gélt 2,5% Triton X-100-mal inkubáltuk MQ-ban 30 percig szobahőmérsékleten. A gélt ezután 37 ° C-on fejlődő pufferba helyeztük °C éjszakán át. A gélt a következő este PAGE-Blue fehérjefestő oldattal (Thermo Scientific, Hollandia) színeztük. A 3. napon a festést MQ-val színtelenítettük, felfedve az MMP2 és MMP9 aktivitást. A géleket Bio-Rad GS-800 denzitométerrel szkenneltük, és a digitális kvantifikációt ImageJ szoftverrel (ImageJ Software, U.S. National Institute of Health, Bethesda, Maryland, USA) végeztük.
MMP2, MMP9, TFF3 és Muc2 expressziós elemzés qPCR segítségével
Asztal 1
QPCR kísérletekhez használt primer szekvenciák
| r-MMP9-F1 | AGCCGACGTCACTGTAACTG |
| r-MMP9-R1 | AACAGGCTGTACCCTTGGTC |
| r-MMP2-F1 | ACAACAGCTGTACCACCGAG |
| r-MMP2-R1 | GGACATAGCAGTCTCTGGGC |
| R-MUC-F1 | CGAAGTGAAGAGTGAGCACG |
| R-MUC-R1 | GATCCGGGTGGTATTCAGCA |
| R-Tff-F1 | GGCCTATCTCCAAGCCAATGT |
| R-Tff-R1 | TGCAGAGGTTTGAAGCACCA |
| GAPDH FW | GGAAGCTCACTGGCATGGC |
| GAPDH RV | CCTGCTTCACCACCTTCTTG |
| Béta-aktin FW | GACAGGATGCAGAAGGAGATTACTG |
| Béta-aktin RV | CCACCGATCCACACAGAGTACTT |
statisztikai elemzések
A statisztikai elemzést a Prism 5.0 for Mac (Graphpad szoftver, San Diego, Kalifornia) alkalmazásával végeztük. A normalitást Kolmogorov-Smirnov alkalmazásával teszteltük. Valamennyi folytonos változót az átlag átlagának és standard hibájának (SEM) mutatjuk be, és összehasonlítjuk a hallgató t tesztjével vagy adott esetben Mann Whitney U alkalmazásával. A dichotóm változókat Chi-négyzet próbával hasonlítottuk össze.
Eredmények
Makroszkópos eredmények
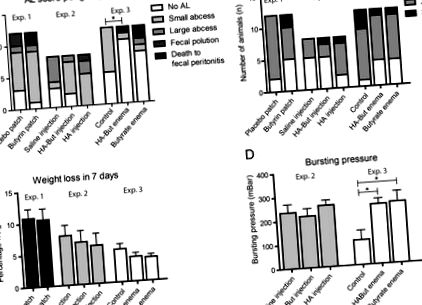
Az 1. kísérletben a butirin tapasz csoport két patkánya elpusztult, mielőtt a nyomon követést befejezte a fekális peritonitis miatt. A 2. kísérletben szereplő összes állat befejezte a 7 napos követést. A 3. kísérletben három patkányt (egyet a HA-But csoportban, hármat a But csoportban) eutanizáltak, mivel a fekális peritonitis miatt humánus végpontokat értek el. Az anastomotikus szivárgás típusainak áttekintése az egyes kísérleti csoportokon belül az 1a. Ábrán található. 1 a. Tapadások minden kísérletben előfordultak, és nem voltak szignifikáns különbségek a kísérletek között (proximális vagy disztális anasztomózisok) és az egyes kísérleteken belül sem (ábra (1b ábra). 1 b). Nyilvánvalóvá vált, hogy a tapaszt kapó állatok (akár butirin eluáló, akár placebo) alacsonyabb jóléti pontszámokkal és szignifikánsan nagyobb súlyveszteséggel bírtak, mint a beöntést kapó állatok (lásd: 1. ábra (C ábra, 1 C)), valószínűleg a bél meghosszabbított proximális következtében. a tapasz helyére áldozat után.
A butiráttal dúsított beöntések csökkentették az AL-t az exp. 3, egyetlen más butirátalapú beavatkozás sem okozta az AL-arány csökkenését (a). Az adhéziós pontszámok nem különböztek szignifikánsan az Exp. 1., 2. vagy 3. (b). A súlycsökkenés leginkább a Exp. 1 ahol a tapaszok elhelyezése hirtelen megváltoztatta a vastagbél kaliberét; a beöntést kapó állatoknál a legkisebb a súlyvesztés, de más típusú anastomosisban is részesültek, mint az Exp. 1. és 2. (disztális, illetve proximális) (c). A butirát beöntések beadása az exp. Anasztomózisának jelentősen nagyobb repesztő nyomását okozta. 3 a kontroll csoporthoz képest. Az Exp. 2 és az Exp. 1; nem mértek BP-t a porózus, kitágult belek miatt
- A súlycsökkentő étrend összehasonlítása különböző zsír-, fehérje- és szénhidrát-összetételekkel -
- Az ivóvízkezelő létesítmények különböző felületi fertőtlenítési kezeléseinek összehasonlítása a
- A diéta és a depresszió, amit eszel, javíthatja a hangulatot, új tanulmány megállapítja, hogy a só NPR
- Koktélnév: 14 különböző típus, amelyet kipróbálhat a következő partin! NDTV Étel
- Az étrendnek, az élelmiszertermelésnek radikálisan meg kell változnia az egészség javítása érdekében, elkerülve a potenciálisan katasztrofális eseményeket