A cirkadián rendszer nutrigenetikája és nutrimiromikája: Az emberi egészség ideje
Absztrakt
1. Bemutatkozás
Bár az élet ritmikus rezgései már régóta ismertek, az ilyen pontos biológiai órát alkotó molekuladarabok lassan feltárulnak. A cirkadián ritmusok gyakorlatilag minden organizmusban léteznek, beépülnek fiziológiánkba, és így fontos szerepet játszanak életünk ritmusában. Ezért a cirkadián rendszer szorosan kapcsolódik az emberi egészséghez. Állat- és emberpopulációs vizsgálatok kimutatták, hogy a cirkadián zavarok olyan betegségekhez kapcsolódnak, mint a metabolikus szindróma (MetS) [1], a 2-es típusú diabetes mellitus (T2DM), az elhízás [2], a szív- és érrendszeri betegségek (CVD) [3] és a rák [4]. Más tanulmányok összefüggést mutattak a kronobiológia és a súlycsökkentő programok sikere között, ami azt sugallja, hogy a kronobiológiát figyelembe kell venni a táplálkozási gyakorlatban [5,6,7,8].
A cirkadián ritmus és a sejtfiziológia kapcsolatát az elmúlt évtizedben alaposan tanulmányozták, és számos vonatkozó tanulmány rávilágított a szabályozásra, valamint a cirkadián rendszer téves szabályozásának okaira és következményeire. A cirkadián útvonalat leírták, és jelenleg tisztázzák, mivel új oszcilláló gének és új cirkadián poszttranszkripciós szabályozók találhatók. Sok gén és metabolit oszcillál a cirkadián ciklust követően, és cirkadián módon szabályozódik [9,10,11].
Mint említettük, a cirkadián ritmusok olyan anyagcserebetegségekkel társulnak, mint a T2DM, az elhízás és a MetS, amelyek mindegyike a CVD, a világszerte vezető halálozási ok kockázati tényezője. Ezért ezeknek a betegségeknek a kronobiológiai jellemzése nagyon fontos a kronobiológiai megközelítés meghatározása érdekében. A kronobiológiai rendszer genetikai és epigenetikai jellemzése különösen érdekes, mivel ezt egy transzkripciós/transzlációs visszacsatolási hurok szabályozza [12]. Néhány változatot a cirkadiánnal kapcsolatos génekben írtak le, amelyek társultak a betegség kockázatával. Ezenfelül ezeknek a változatoknak néhány gén-diéta kölcsönhatását írták le. Ezenkívül számos mikroRNS modulálja a cirkadián rendszert, és néhányukat diéta is modulálja.
Ebben az áttekintésben összefoglaljuk az étrend és a kronobiológia kapcsolatának korszerűségét a táplálkozási genomika perspektívájából, és megvitatjuk a kronoterápia lehetőségeit a személyre szabott táplálkozásban.
2. A cirkadián ritmusokat vezérlő transzkripciós/transzlációs visszacsatolási hurok
A cirkadián ritmusokat egy központi óra szabályozza, amely a hipotalamusz szupraquiasmatikus magjában (SCN) helyezkedik el [3,14,15,16,17]. Ez a központi pacemaker olyan bemeneteket kap a környezettől, amelyek ingerként szolgálnak a ritmusok szinkronizálásához a külvilággal. Az SCN ezeket a zeitgebereket használja a perifériás órák szinkronizálására más szövetekben, például májban, tüdőben, szívben, gyomorban vagy a belekben [18]. Ezen jelek között a fény a legerősebb. A fény eléri a retina fotoreceptorait, és a jel a retinohypothalamicus traktuson keresztül jut el az SCN-be. A hőmérséklet, a böjt/étkezés és a pihenés/tevékenység mások zeitgeberek [14].
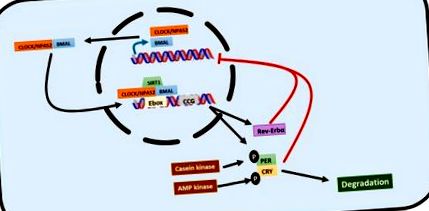
A cirkadián ritmusokat transzkripciós/transzlációs visszacsatolási hurkok szabályozzák, amelyekben az úgynevezett óra gének kulcsszerepet játszanak [3,16,17] (1. ábra). A cirkadián mozgásszervi kimeneti ciklusok a kaput (CLOCK) vagy annak alternatív neuronális PAS domén fehérjéje 2 (NPAS2), valamint az agy és az izom ARNT-szerű fehérjéje 1 (BMAL1) jelentik a jelátviteli utat kiváltó mag-gének. Az CLOCK és a BMAL1 dimerizálódik a citoszolban, és transzlokálódik a sejtmagba, ahol az E-box szekvenciákhoz kötődnek számos óra gén promóter régióiban, stimulálva azok expresszióját. Így a periódusgének (PER1, PER2 és PER3), a kriptokróm gének (CRY1 és CRY2) megfordítják az erythroblastosis vírus α génjét (REV-ERBα), a retinoidokkal rokon árva receptor α gént (RORα) és más, órával vezérelt géneket (CCG) kifejezésre kerülnek. A CLOCK és az RORα szintén indukálja a BMAL1 expressziót. Ezzel szemben van egy visszacsatolás-gátlás: a periódus és a kriptokróm gének dimerizálódnak a citoszolban, transzlokálódnak a sejtmagba és gátolják a BMAL1 expresszióját. A REV-ERBα részt vesz a BMAL1 gátlásában is [3,16,17].
A cirkadián ritmust szabályozó transzkripciós/transzlációs visszacsatolási hurok grafikus ábrázolása. A CLOCK/BMAL1 heterodimer képezi az első hatásvonalat. A célgének promóterében lévő E-boxokhoz kötődik, hogy aktiválja őket. Célgénjei között vannak olyan kriptokróm és periódus gének, amelyek egy heterodimert alkotnak, amely negatív visszacsatolási ciklusban negatívan szabályozza a CLOCK/BMAL1 működését. A REV-ERBα-t szintén a CLOCK/BMAL1 célozza meg, és szintén negatívan szabályozza annak működését. Ezt a hálózatot poszttranszkripciós úton is szabályozzák a kriptokróm és a periódus gének foszforiláció által közvetített lebontása.
Az óra génjei is transztranszkriptíven szabályozottak. A kazein-kináz foszforilálja a PER-t, az ubiquitin-komplexen keresztül történő lebontásra célozva [19,20]. A CRY-t az AMP-kináz foszforilálja, a 26-os proteaszóma pedig lebontja [19]. A Sirtuin 1 (SIRT1) egy hiszton-dezacetiláz, amely kölcsönhatásba lép a CLOCK-szal és a BMAL1-gyel, amikor az óra által vezérelt gének promóter-szekvenciájához kötődnek, lehetővé téve a fehérjék ritmikus expresszióját a májban, és szinkronizálva a sejtek anyagcseréjét a cirkadián ritmusokkal [20]. A CLOCK egy hiszton-acetil-transzferáz is, amely acetilálja a BMAL1-et és a HDAC-t, egy hiszton-dezacetilázt, amely a REV-ERBα-val együtt szabályozza a cirkadián lipid-anyagcserét [19].
3. Perifériás órák, táplálkozás ideje és a kronodegradáció metabolikus következményei
A specifikus tápanyagok megváltoztathatják az óra által vezérelt gének expresszióját is. A glükóz szabályozhatja a BMAL1 szintjét és a periódus expresszióját [39], és a magas zsírtartalmú étrenddel táplált egerek megváltoztatták a lipid metabolizmus gén expresszióját [13]. Eckel-Mahn és munkatársai által végzett tanulmány. kimutatta, hogy a legtöbb máj metabolit cirkadián ritmust követve oszcillál, és hogy ezt az oszcillációt az óra transzkriptóm és az étkezési/koplalási ciklusok szabályozzák, és hozzájárulnak a máj homeosztázisának fenntartásához [9].
4. Génváltozatok és gén-diéta kölcsönhatások a cirkadiánnal kapcsolatos, a betegséghez kapcsolódó génekben
Egyes génvariánsok hajlamosíthatják az egyéneket a különböző betegségekre. Ez a helyzet az FTO (zsírtömeghez és elhízáshoz társuló) génnél és annak összefüggésében az elhízással és a kapcsolódó tulajdonságokkal [41,42,43] vagy a TCF7L2 génnel és a T2DM-mel való társulásával [44,45,46]. Sőt, a jól ismert betegséggel kapcsolatos génvariánsok egy része kölcsönhatásba lép az étrenddel és az étrendi vegyületekkel, hogy módosítsa az ilyen hajlamot [47,48]. Más génvariánsok modulálják a súlycsökkentő programra adott egyéni választ a súly, a testtömeg-index (BMI) vagy a derék kerületének csökkentése szempontjából [49,50]. Tekintettel arra, hogy a kronobiológia milyen szerepet játszik az emberi egészségben, és tekintettel arra, hogy a cirkadián rendszer egy bonyolult génhálózatból áll, amely ellenőrzi az oszcilláló génexpressziót, feltételezték, hogy a cirkadiánnal kapcsolatos génvariánsok különböző betegségekkel társulhatnak. Emiatt a táplálkozási genomikai tanulmányok a közelmúltban a cirkadiánnal kapcsolatos gének és tápanyagok kölcsönhatásaira összpontosítottak, hogy módosítsák a betegség kockázatát és az egyéni változékonyságot a súlycsökkentő programokban.
4.1. A genetikai kroncsolódás állatmodelljeinek tanulságai
A Per1 mutáns egerek nagyobb táplálékfelvételt mutattak, de alacsonyabb testtömeg és fokozott glükóz-anyagcsere [58]. Ezzel szemben a Per2 mutáns egerek elhízottak, bár a táplálékbevitel nem magasabb, mint a vad típusú egereknél [59]. Ezeknek a mutáns egereknek glükokortikoid ritmusuk és napi étvágykontrolljuk van. Az alváskorlátozás a fehér zsírszövet transzkripciós újraprogramozását indukálja, amely fokozott lipogenezishez, a leptin szekréciójához és az élelmiszer-bevitelhez vezet, mindezek az elhízás és a kapcsolódó leptin-rezisztencia jellemzői. Úgy tűnik azonban, hogy a kettős Per1/Per2 mutánsok védettek az alváskorlátozó hatásoktól [60].
A Rev-erbα knockout egerek fáziseltolódást mutattak a lipid metabolizmusban részt vevő gének expressziójában, ami a máj koleszterinszintjének és az epesav metabolizmusának diszregulációjához vezetett [61]. Ezeknek a knockout egereknek károsodott a Srebp által közvetített koleszterin metabolizmusa az Insig2 Rev-erbα általi gátlása miatt. Ezzel szemben a Cry1-hiányos egerek ellenálltak a magas zsírtartalmú étrend okozta elhízásnak, annak ellenére, hogy hasonló a kalóriabevitel, mint az azonos étrendet tápláló vad típusú egereknél [62].
4.2. A cirkadiánnal kapcsolatos génváltozatok anyagcserezavarokkal társulnak, és modulálják az étrendre adott egyéni választ: Emberi populáció vizsgálatok
A táplálkozási genomika alkalmazása kronobiológiai vizsgálatokban arra tanít minket, hogy a cirkadiánnal kapcsolatos gének génváltozatai hogyan növelhetik az anyagcsere-rendellenességek és a kapcsolódó betegségek, például az elhízás, a T2DM vagy a CVD kockázatát. A cirkadiánnal kapcsolatos génvariánsok társulnak olyan CVD tulajdonságokkal is, mint a magas vérnyomás (1. táblázat). Dashti és mtsai. elemezte 18 cirkadiánnal kapcsolatos gén 5004 egy nukleotid polimorfizmusának (SNP) vérnyomással való összefüggését és megállapította, hogy bár ezek az SNP-k nem járultak hozzá a diasztolés vérnyomás egyéni varianciájához, együttesen magyarázták a szisztolés vér varianciájának 7,1% -át nyomás a lipidszint-csökkentő gyógyszerek genetikájában és a táplálkozási hálózat populációjában (GOLDN) és a bostoni Puerto Ricói Egészségügyi Tanulmány Népesség (BPRHS) populációiban [63]. Sőt, a cirkadiánnal kapcsolatos gének variánsai és az anyagcsere-rendellenességek közötti egyes összefüggések közül néhány diétával modulálható.
Asztal 1
Az elhízáshoz kapcsolódó cirkadiánnal kapcsolatos gének variánsainak összefoglalása.
4.2.1. Változatok az ÓRA Génben
4.2.2. Változatok más cirkadiánnal kapcsolatos génekben
Az időszaki gének polimorfizmusai cirkadián és viselkedésbeli változásokkal társultak. Ezek a változások szerepet játszhatnak a PER1 génben előforduló közös variánsok és a rendkívüli elhízás [83], valamint az rs2304672 és rs4663302 SNP-k PER2-ben és a hasi elhízás [84,85] közötti megfigyelt összefüggésben (1. táblázat). Ezenkívül Kelly és mtsai. kimutatta, hogy az rs7602358 G allél a PER2 közelében negatívan társult a T2DM-hez, míg a BMAL1 rs11022775 T allél a betegség fokozott kockázatához kapcsolódott a pandzsábi kohorszban. Ezeket az asszociációkat azonban egyik sem replikálta a SAT2D vagy a DIAGRAM adatkészletekben [82]. A BMAL1-ben lévő rs6486121 és rs7950226 SNP-k szintén társultak magas vérnyomáshoz és T2DM-hez, a Diabetes in Families (DIF) 424 brit T2D család 1304 egyénéből, a DIF-ben (DIF). Ezek az asszociációk azonban nem voltak szignifikánsak a többszörös tesztelés utáni korrekció után [86]. Az rs6486121, rs3789327 és rs969485 CCA haplotípusok szignifikánsan társultak a magas vérnyomáshoz [86] (1. táblázat).
Három friss tanulmány kimutatta, hogy összefüggés van a REV-ERBα gén variánsai és az elhízás között (1. táblázat). Garaulet és munkatársai által végzett tanulmány. 2014-ben kimutatta, hogy a REV-ERBα1-ben található rs2314339 két európai eredetű populációban (mediterrán és észak-amerikai) hasi elhízással jár. A kisebb allélhordozóknál alacsonyabb volt a derékbőség és a BMI, és kevésbé voltak hajlamosak a hasi elhízásra. Ezt az összefüggést modulálta a mediterrán populáció MUFA-bevitele (amely magasabb MUFA-bevitelt mutatott), mivel a kisebb allélhez társuló alacsonyabb BMI csak akkor volt szignifikáns, amikor a MUFA-bevitel a teljes zsír ≥ 55% -a volt [87]. Ruano és mtsai. kimutatta, hogy az rs939347 A alléljának homozigóta hordozói hajlamosak az elhízásra. Ez az összefüggés azonban csak férfiaknál volt szignifikáns [88]. Végül Goumidi és mtsai. kimutatta, hogy az rs2071427 kisebb T allélje magasabb BMI-vel társult felnőtteknél és serdülőknél [89].
Ezek a tanulmányok kiterjesztik a CLOCK variánsokkal, az elhízással és a T2DM-rel kapcsolatos korábbi ismereteinket más cirkadiánnal kapcsolatos génekre is. Azonban a legtöbb esetben ezek a különbségek nem voltak statisztikailag szignifikánsak, vagy nem találtak összefüggést a nem kaukázusi populációkban. Ezért ezeket az eredményeket további validálásra van szükség, mielőtt ezeket az SNP-ket felvennék a személyre szabott táplálkozási stratégiákba. Ezenkívül az etnicitás fontos kérdés, amely azt sugallja, hogy a személyre szabott táplálkozási stratégiáknak figyelembe kell venniük az etnikai hátteret.
5. A cirkadián rendszer nutrimiromikája
A mikroRNS-ek a génexpresszió fontos modulátorai, amelyek számos sejtes és fiziológiai folyamatot szabályoznak [104], és közülük néhány olyan betegséggel társult, mint a rák [105], a T2DM, az érelmeszesedés vagy a diszlipidémia [106, 107]. A mikroRNS-ek szerepe az emberi betegségekben kapcsolódik számos fiziológiai folyamatban való részvételükhöz, mint például a koleszterin metabolizmushoz [108], az inzulin szignalizációhoz [109], a gyulladáshoz és az endotheliális funkcióhoz [107], és a legújabb jelentések megmutatták hatásukat a cirkadián ritmusban [110 ]. A mikroRNS-eket a betegség kialakulásának és progressziójának potenciális biomarkereként is felismerték, mivel ezek jelen vannak a plazmában és más biofolyadékokban, például vizeletben vagy cerebrospinalis folyadékban. A véráramban a mikroRNS-ek lipoproteinekhez, exoszómákhoz és fehérjekomplexekhez társulhatnak, amelyek megakadályozzák őket az RNázok általi lebontásban [111].
5.1. A mikroRNS-ek cirkadián expressziója
A hormonokhoz, génekhez, fehérjékhez és metabolitokhoz hasonlóan sok mikroRNS cirkadián módon oszcillál [8,10] (2. ábra). Figyelemre méltó példa a miR-96/miR-182/miR-183 alkotta mikroRNS-klaszter, amely rágcsálómodellben napi változást mutat és részt vesz a tobozmirigy melatonintermelésében [112]. Ezen hatás mellett ezen klaszter felszabályozása szerepet játszik hepatocelluláris karcinómában és emlőrákban is [113, 114]. Ezenkívül Kinoshita és mtsai. megmutatta a miR-96-5p ritmikus oszcillációinak fontosságát a glutation szintjének szabályozásában az 1-es gerjesztő aminosav hordozó (EAAC1) révén, amelyek védő szerepet játszanak az agyban [115].
- Puha; Rágós zabpelyhes mazsolás sütik Egyetem egészségügyi ellátórendszere
- Gyermekkori testsúly-szabályozás Nemours Children's Health System
- A legjobb probiotikus ételek az Ön bélrendszerének egészségéhez TIME
- Az egészség dohányzása A dohányzás segít a fogyásban
- Határozzuk meg, hogy 9 alapelvet tanítanak az orvosi fogyókúrás jéggerinc egészségügyi rendszerében