A cukorbetegség és az inzulin hatása a betain-homociszteinre S-metil-transzferáz expresszió patkány májban
Absztrakt
A homocisztein homeosztázisra adott BHMT reakció jelentősége a közelmúltban nagy érdeklődésre fókuszál. Ezt hangsúlyozza de Costa és mtsai tanulmánya. (4), amely kimutatta a plazma homocisztein növekedését kolinhiányos egyéneknél. Cisztationin-β-szintáz (CBS) vagy metilén-tetrahidrofolát-reduktáz (MTHFR) hiányban szenvedő egyéneknél az orális betainpótlás a teljes homocisztein jelentős csökkenését eredményezi (29, 35, 36, 45). Ennek a kezelésnek a sikere a BHMT-n keresztüli megnövekedett fluxusnak tulajdonítható. Jelentős negatív összefüggést mutattak a plazma betain és a homocisztein koncentrációi között szív- és érrendszeri betegségben szenvedő embereknél (35).
Jelentős bizonyíték van arra, hogy a homocisztein metabolizmusát számos hormon szabályozhatja. A hidrokortizon fokozta a máj BHMT-aktivitását, míg a tiroxin-kezelések ennek az enzimaktivitásnak a jelentős csökkenését eredményezték (5). Mi (16, 26) korábban kimutattuk, hogy a transzszulfurációs útvonal fokozódik a streptozotocin által kiváltott diabéteszes patkányokban és a glükokortikoidokkal stimulált patkány hepatoma sejtekben, és inzulinkezeléssel elnyomja. Nemrégiben (46) azt tapasztaltuk, hogy a BHMT aktivitása és expressziója megemelkedett Zucker diabéteszes zsíros patkányokban, ami kiváló modell a 2-es típusú cukorbetegséghez. Neiman és mtsai. (24) a streptozotocin-diabéteszes patkányok májának BHMT-aktivitásának növekedését figyelte meg, ez egy modell az 1. típusú cukorbetegségre. Bár a BHMT étrendi szabályozása jól dokumentált, a hormonális változások és a BHMT szabályozás közötti közvetlen kapcsolat alapja továbbra sem megoldott. Jelen tanulmány célja az inzulin és a glükokortikoidok szerepének vizsgálata a BHMT aktivitásának és a génexpresszió szabályozásában 1-es típusú (streptozotocin által kiváltott) diabéteszes patkány modell és patkány hepatoma sejtvonal felhasználásával.
Anyagok.
A hím Sprague-Dawley patkányokat a Memorial University of Newfoundland állattenyésztési egységéből szerezték be. A Novolin ultralente humán inzulin Eli Lilly-től (Indianapolis, IN) származott. Rádiójelzett [metil- 14 C] betain és [metil- 14 C] kolin-kloridot az American Radiochemical-től (St. Louis, MO) vásároltunk. A Dowex 50W-X4 ioncserélő gyanta a Bio-Rad cégtől (Hercules, Kalifornia). A H4IIE (patkány hepatoma) sejteket az American Type Culture Collection-től (Manassas, VA) szereztük be. A Dulbecco által módosított Eagle táptalajt (DMEM), a tripszin-EDTA-t, a szarvasmarha magzatának szérumát (FBS), a penicillint, a sztreptomicint és az egyéb szöveti tenyészetet az Invitrogen Canada-tól (Burlington, ON, Kanada) vásároltuk. A triamcinolon és az inzulin a Sigma Chemicals-tól (Oakville, ON, Kanada) származik. Az RNAlater az Ambion (Austin, TX) cégtől származik. Az egylépéses RT-PCR készlet Qiagen-től (Mississauga, ON, Kanada) volt. A BHMT primereket az Invitrogen Canada gyártotta. A patkány β-aktin amplimer készleteket a CloneTech-től (Palo Alto, Kalifornia) szereztük be. A bicinchonininsav (BCA) fehérje vizsgálati készlet a Pierce Chemical cégtől (Rockford, IL) származik. Az összes többi alkalmazott reagens kereskedelmi forgalomban volt, és a rendelkezésre álló legmagasabb tisztaságú volt.
Állatok és in vivo eljárások.
Sejtkultúra.
A H4IIE sejteket 75 cm2-es tenyésztőlombikokban tenyésztettük 10 térfogat/térfogat% FBS-t, 100 E/ml penicillint és 100 μg/ml sztreptomicint tartalmazó DMEM-ben. 5% CO2 alatt, párásított inkubátorban, 37 ° C-on tenyésztettük, amíg a sejtek 70–75% -ban összefolytak. A táptalajt 0,5% FBS-t tartalmazó DMEM-re változtattuk, és egy éjszakán át tenyésztettük. A sejteket 1 órán át inkubáltuk 0,5% FBS-t tartalmazó friss táptalajban, ekkor a táptalajt ismét 0,5% FBS-t és megfelelő koncentrációjú hormonokat tartalmazó táptalajra cseréltük. A lemezeket ezután hormonokkal vagy anélkül inkubáltuk 37 ° C-on, 0 és 48 óra közötti időtartamig. Az inkubáció végén a táptalajt leszívtuk, és a sejteket egyszer jéghideg foszfáttal pufferolt sóoldattal mostuk. A sejtek életképességét a tripánkék kizárási teszttel követtük, és azt találtuk, hogy> 98% (7).
Analitikai eljárások.
A homocisztein koncentrációit HPLC-vel határoztuk meg (42). Ez a módszer a teljes homociszteint (mind szabad, mind fehérjéhez kötött formát) méri. A plazma glükózt enzimatikusan határoztuk meg (1). A májminták fehérjekoncentrációját Biuret módszerrel határoztuk meg szarvasmarha szérum albumin (BSA) alkalmazásával. A fehérje koncentrációt a H4IIE sejtkivonatokban BCA fehérje vizsgálattal mértük (39).
Enzimvizsgálatok.
A májban a BHMT-vizsgálatokat az előzőekben leírtak szerint hajtották végre (8). A H4IIE sejtkivonatokat a BHMT szempontjából lényegében a (8) leírás szerint vizsgáltuk, azzal a különbséggel, hogy magasabb betainkoncentrációt alkalmaztunk (250 μM, 1 μCi), és az inkubációkat 3 órán át végeztük. A kolin-dehidrogenázt (CDH) a máj homogenizátumaiban meghatároztuk, lényegében a leírtak szerint, néhány módosítással (10). Röviden, vizsgálatonként 0,15 mg fehérjét használtunk fel, és az inkubálást 7,5 percig folytattuk 3,5 mM Tris-ben (pH 7,6), 350 μM EDTA-ban, 700 μM β-merkaptoetanolban, 350 μM CaCl2-ban, 0,3% (tömeg/térfogat) fenazinban. metoszulfát és 500 μM [metil- 14 C] kolin (0,2 μCi) 50 μl össztérfogatban. Miután a reakciót a csövek jégfürdőbe helyezésével leállítottuk, 20 μl jéghideg NaOH-t és 15 μl 30% H2O2-t adtunk hozzá, és az elegyet 1 órán át szobahőmérsékleten hagytuk állni. 415 μl jéghideg víz hozzáadása után a teljes reakcióelegyet 50W-X4 100–200 mesh (H +) gyantát tartalmazó minikoloncákba (0,9 × 2,0 cm) (előzetesen 1 M LiOH-val hígítva) töltöttük. Az oszlopokat hatszor mostuk 833 μl vízzel. A mosófolyadékokat egyesítettük, aliquot részt (2,5 ml) adtunk 17 ml Scintiverse szcintillációs folyadékhoz (Fisher Scientific, Ottawa, ON, Kanada), és a radioaktivitást megszámoltuk egy LKB Wallac 1214 RackBeta szcintillációs számlálóval.
S-adenozil-1-metionin és S-adenozil-1-homocisztein meghatározása.
A fagyasztással befogott májat jéghideg 8% -os triklór-ecetsavban homogenizálták. A homogenátumokat 13 000-nél centrifugáltuk g 5 percig 4 ° C-on. A felülúszókat HPLC-vel analizáltuk Vydac C18 oszlopon (2187P54 modell), amelyet egyensúlyban volt a puffer A (50 mM NaH2PO4, amely 10 mM heptánszulfonsavat tartalmaz, pH = 3,2) és 4% acetonitrilt tartalmaz. SAM és S-Az adenozil-1-homociszteint (SAH) az elegy 96-80% -os gradiensének alkalmazásával választottuk el. puffer A és 4-20% acetonitrilt 15 percig. A SAM és SAH csúcsokat 258 nM koncentrációban detektáltuk, és a Millennium 32 (2. verzió) szoftver (Waters, Milford, MA) segítségével számszerűsítettük.
Fordított transzkriptáz-polimeráz láncreakció.
A teljes RNS-t a H4IIE sejtekből izoláltuk a leírtak szerint (26). A teljes RNS-t fagyasztva kapcsolt májból állítottuk elő gyors guanidinium-tiocianát módszerrel (2). A teljes RNS-t (2 μg) reverz átírással írtuk le egylépéses reverz transzkripciós készlet alkalmazásával, és amplifikáltuk. A BHMT 1219 bázispár méretű fragmensét (a kezdő kodonhoz képest +5 és +1224 közötti nukleotidok) amplifikáltuk a következő primerek alkalmazásával: 5'-ACCGATTGCCGGCAAGAA-3 'és 5'-CTGTGCGGATTTGAATTTTTG-3'. A patkány β-aktin 764 bp-os fragmensét amplifikált primerek alkalmazásával koamplifikáljuk. A PCR-termékeket 1% agarózon választottuk el. Az etidium-bromiddal festett sávokat UV-megvilágítással tettük láthatóvá. A blotokat a ChemiImager 4000 készülékkel szkenneltük, és az Alphaease szoftverrel (Alpha Innotech, San Leandro, CA) számszerűsítettük.
PCR-alapú atomfuttatási elemzés.
Statisztikai analízis.
Az összes adatot a GraphPad Prism szoftver elemezte. Az adatokat hat egyedi kísérlet átlagának ± SD-ként adjuk meg, hacsak másképp nem jelöljük. A statisztikai összehasonlításokat egyirányú varianciaanalízissel végeztük, amelyet Newman-Keuls többszörös összehasonlító teszt követett. A P értéke 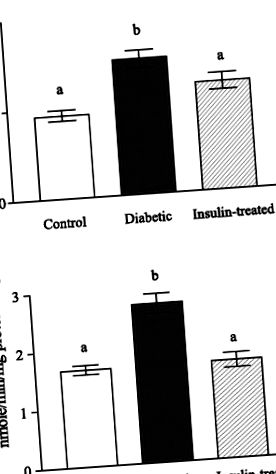
1. ábra.A: betain-homocisztein-metil-transzferáz (BHMT) aktivitás kontroll, kezeletlen cukorbeteg és inzulinnal kezelt cukorbeteg patkányokban. B: kolin-dehidrogenáz aktivitás kontroll, kezeletlen cukorbeteg és inzulinnal kezelt cukorbeteg patkányokban. Az adatokat átlagként (SD) fejezzük ki; n = 6. A betűk közötti különbség a sávok felett jelentős különbségeket jelez (P
2. ábra.A: A teljes máj RNS RT-PCR elemzése kontroll és diabéteszes patkányokban. B: a BHMT mRNS denzitometrikus kvantitatív meghatározása. A BHMT mRNS-t β-aktin szintre normalizáltuk. Az adatok reprezentálják az eszközöket (SD); n = 6. A betűk közötti különbség a sávok felett jelentős különbségeket jelez (P
A cukorbetegség hatása a SAM és az SAH májkoncentrációira.
A SAM és a SAH májkoncentrációja szignifikánsan megemelkedett a streptozotocin által kiváltott diabéteszes patkányokban; A SAM-koncentrációk 25% -kal meghaladták a kontroll értékeket, és az SAH-koncentrációk 122% -kal növekedtek. Noha az inzulinkezelés csökkentette mind a SAM, mind az SAH szintjét, azok szintje a normálisnál magasabb maradt. A SAM/SAH arány csökkent a cukorbetegségben. Az inzulinkezelés a SAM/SAH arány növekedését eredményezte. Azonban alacsonyabb maradt, mint a kontrollértékek (1. táblázat).
Asztal 1. Máj SAM és SAH kontroll, diabéteszes és inzulinnal kezelt cukorbeteg patkányokban
Az eredményeket 6 állat átlagában (SD) fejezzük ki. SAM, S-adenozil-1-metionin; SAH, S-adenozil-1-homocisztein. A felső indexű betűk közötti különbségek jelentős különbségeket jelentenek a sorokon belül, P
3. ábra.A: BHMT aktivitás H4IIE sejtekben, triamcinolonnal (1 μM) kezelve inzulin (1 μM) jelenlétében vagy hiányában 18 órán át. Az adatok 6 különálló kísérlet átlagát (SD) jelentik. Az eredményeket U/mg-ban fejezzük ki, ahol egységként 1 nmol termelt metionint (betainfogyasztást) adunk óránként. A betűk közötti különbségek a sávok felett jelentős különbségeket jeleznek (P
4. ábra.A: A BHMT mRNS RT-PCR analízise H4IIE sejtekben növekvő koncentrációjú triamcinolonnal stimulálva. B: BHMT mRNS RT-PCR elemzése triamcinolonban (1 μM) kezelt H4IIE sejtekben növekvő inzulin koncentrációk jelenlétében.
A triamcinolon és az inzulin hatása a BHMT transzkripció sebességére.
A BHMT transzkripció sebességének változását a glükokortikoidokra és az inzulinra adott válaszként PCR-alapú magfuttatási kísérletek segítségével határoztuk meg. Ezeknek a hormonoknak a BHMT transzkripciós sebességre gyakorolt hatása párhuzamosan befolyásolta a BHMT mRNS szintjét (5. ábra). A triamcinolon növelte a BHMT transzkripció sebességét, és az inzulin eltörölte ezt a hatást. Ezért az inzulin közvetlen szerepet játszik a BHMT transzkripció szabályozásában.
5. ábra.A BHMT transzkripciós arány nukleáris futásanalízise H4IIE sejtekben. A: a kontroll, a triamcinolon és a triamcinolon + inzulinnal kezelt sejtek sejtmagjait izoláltuk, és PCR-alapú nukleáris run-on transzkripciós vizsgálatot végeztünk. Az RNTP-k jelenlétében vagy hiányában elvégzett BHMT és β-aktin relatív transzkripciós arányait mutatjuk be. B: a BHMT transzkripciós arány densitometriai elemzése. Az adatok 3 külön kísérlet átlagát (SD) jelentik. A betűk közötti különbségek a sávok felett jelentős különbségeket jeleznek (P
Összegzésként elmondhatjuk, hogy a glükokortikoidok közvetlen és specifikus hatása a BHMT indukciójára és inzulin általi elnyomására ebben a munkában új betekintést enged abba a mechanizmusba, amely révén az inzulin szabályozza a homocisztein, egy erősen atherogén aminosav metabolizmusát. Azt a specifikus mechanizmust, amellyel az inzulin közvetíti gátló hatását a BHMT transzkripcióra, még meg kell határozni.
Ezt a munkát támogatta a kanadai egészségügyi kutatóintézetek (JT Brosnan), a kanadai Diabetes Szövetség (Neil M. Miller támogatás JT Brosnan és ME Brosnan részére), valamint a DK-52501 Nemzeti Diabétesz- és Emésztőrendszeri és Vesebetegségi Intézet támogatása hogy TA Garrow. S. Ratnam Audrey B. Cashman posztdoktori díjat kapott a kanadai Diabetes Szövetségtől, E. P. Wijekoon pedig diplomás ösztöndíjat kapott a Newfoundlandi Memorial Egyetemen.
LÁBJEGYZETEK
A cikk megjelenésének költségeit részben az oldaldíjak megfizetése fedezte. A cikket ezért ezennel fel kell tüntetni:hirdetés”Szerint a 18 U.S.C. Az 1734. § kizárólag ennek a ténynek a feltüntetésére.
Hálásan köszönjük Jana Strakova szakértői technikai segítségét.
- A citrusfélék segíthetnek az elhízással összefüggő szívbetegségek, májbetegségek, cukorbetegség megelőzésében -
- A cukorbetegség számláló szénhidrátja, ha az inzulin CS Mott Children s Hospital Michigan Medicine-t használja
- Cukorbetegség és az alkohol hatása a cukorbetegségre
- Cukorbetegség nyomon követése vércukor, inzulin, szénhidrát Napló MyNetDiary
- A magas zsírtartalmú étrend hatása a rágcsálók máj bioenergetikájára és az oxidatív egyensúlyhiányra - ScienceDirect