A Ghrelin elhízás lehetséges klinikai alkalmazásának legújabb eredményei
1 Biológiai kémiai és táplálkozási laboratórium, Orvostudományi Kar, Université libre de Bruxelles, 1070 Brüsszel, Belgium
Absztrakt
A Ghrelin a növekedési hormon szekretagóg receptorának (GHS-R1a) természetes liganduma. A Ghrelin egy 28 aminosavú peptid, amely egyedülálló acileződéssel rendelkezik a 3. pozícióban levő szerinnel, amelyet a ghrelin katalizál. O-aciltranszferáz (GOAT). A Ghrelin serkenti a növekedési hormon szekrécióját, de emellett étvágyat, táplálékfelvételt, súlygyarapodást és a gyomor kiürülését is. A Ghrelin részt vesz a súlyszabályozásban, az elhízásban, a 2-es típusú cukorbetegségben és a metabolikus szindrómában. Ezenkívül a ghrelin biológia jobb megértése vezetett a ghrelin szintjét és/vagy annak biológiai hatásait moduláló molekuláris célpontok azonosításához: GOAT, ghrelin és GHS-R1a. Ezenkívül egy közelmúltbeli felfedezés, amely megmutatta a T2R keserű ízreceptor szerepét a ghrelin szekréciójában és/vagy szintézisében és táplálékfelvételében, arra utalt, hogy a T2R további érdekes molekuláris célpontot jelenthet. Az elhízás kezelésére szolgáló ghrelinhez kapcsolódó farmakológiai eszközök több osztályát fejlesztették ki vagy fejlesztették ki az azonosított molekuláris célpontok modulálására.
1. Bemutatkozás
A Ghrelin, a növekedési hormon szekretagóg receptorának (GHS-R1a) természetes liganduma [1], a növekedési hormon szekréciójának hatékony stimulátora [2, 3]. Ezenkívül a ghrelin étvágystimuláló hormon is, amely táplálékfelvételt és súlygyarapodást vált ki az emberben [4–6], és elősegíti a gyomor kiürülését [7]. A Ghrelin egy 28 aminosav-peptid, amelyet túlnyomórészt az endokrin gyomor nyálkahártya-sejtjei termelnek és szekretálnak a patkányokban az „X/A-szerűnek” nevezett endokrin gyomor-nyálkahártya-sejtek [8, 9] és az emberek P/D1-sejtjei [10]. A Ghrelin sajátossága, hogy a 3. helyzetben lévő szerinnel acilezni kell [1]. A preproghrelin feldolgozása során mind az 1-28-as, mind az 1-27-es ghrelin eredményezheti, majd a Ser3 hidroxilcsoportjának acilezésének vetik alá [11]. Az acilezést, egy egyedülálló peptidmódosítást, a ghrelin katalizálja O-aciltranszferáz, a membránhoz kötött tag O-aciltranszferáz család, a peptid feldolgozása során [2, 3]. Az acilezést leggyakrabban egy oktanoil-csoporttal (C8: 0), ritkábban egy dekanoil- (C10: 0) vagy egy decenoil- (C10: 1) csoporttal végzik [11]. A ghrelin acilezése fokozható közepes láncú zsírsavak vagy közepes láncú triacil-gliceridek bevitelével [12].
A ghrelin patkányoknak történő beadása az élelmiszer-fogyasztás stimulálásához és az energiafelhasználás csökkenéséhez vezet, figyelembe véve a testtömeg-növekedést [6, 22–25]. Az intravénás ghrelin beadása embernél is növeli az étvágyat és serkenti a táplálékfelvételt [6]. A plazma ghrelin szintje negatívan korrelál a BMI-vel, és kompenzáló módon ingadozik a testtömeg változásaival szemben [26]. Valójában az anorexia nervosa és a cachexia esetében a plazma ghrelin szintje megnő, az elhízás pedig csökken [27]. A ghrelin szint csökken a túlzott táplálkozás [28], terhesség [29], olanzapin kezelés [30] vagy magas zsírtartalmú étrend [31] súlygyarapodásával. A magas zsírtartalmú étrendben szenvedő patkányok centrális ghrelin-adagolása nem eredményez nagyobb táplálékfelvételt, míg a fehér zsírszövetben fokozott zsírszint alakul ki [32]. A fehér zsírszövetben a ghrelin stimulálja a lipogén enzimek, például a sztearoil-CoA-deszaturáz, az acetil-CoA-karboxiláz és a zsírsav-szintáz gén expresszióját. Ezek az adatok arra utalnak, hogy a központi ghrelin különféle mechanizmusok révén egyidejűleg szabályozza az élelmiszer-bevitelt és a zsírszövet-anyagcserét [32].
Úgy tűnik, hogy az akut táplálkozási választ a GHS-R1a közvetíti [33]. A ghrelin krónikus súlygyarapodási hatását modulálhatja mind a GHS-R1a [34], mind a ghrelin egy még nem azonosított receptora, mivel mind a ghrelin, mind a ghrelin antagonista indukálta a testtömeg-növekedést [35]. Ennek ellenére további vizsgálatokra lenne szükség a kérdés tisztázása érdekében.
A des-acil-ghrelint nemrégiben úgy vették figyelembe, mint az élelmiszer-bevitel modulátorát, amely egy még nem azonosított receptoron keresztül hathat [36, 37]. Úgy tűnik azonban, hogy a des-acil-ghrelin ellentmondásos hatással van a táplálékfelvételre [36, 37]. Valóban, a GOAT kiütéses egerek zsírtartalma csökkent volt a megnövekedett des-acil-ghrelinszint ellenére [38]. A spekulált des-acil-ghrelin receptorok azonosítása mélyen növelheti ismereteinket a peptid mechanizmusairól és cselekvési helyeiről.
Magas plazma ghrelin-szintről számoltak be Prader-Willi-szindrómában (PWS) szenvedő betegeknél, amely genetikai rendellenesség mentális retardációval és súlyos elhízáshoz vezető hyperphagia jellemzi [39, 40]. Ebben a rendellenességben a ghrelin lehet felelős, legalábbis részben a betegek kielégíthetetlen étvágyáért és elhízásáért.
Molekuláris biológiai szempontból érdekes megjegyezni, hogy mind a ghrelin, mind annak receptorai (GHSR) génjei a 3. kromoszómán találhatók olyan régiókban, amelyek az elhízáshoz kapcsolódtak [41, 42]. Mind a ghrelin, mind a GHSR1a receptor polimorfizmusait tanulmányozták elhízásban [43–52]. Ugyanakkor további vizsgálatokra van szükség ezen mutációk funkcionális jelentőségének egyértelmű értékeléséhez az elhízás patogenezisében.
A plazma ghrelinszint és az inzulinszint, valamint az inzulinrezisztencia közötti megfigyelt összefüggés miatt [53–56] felvetették, hogy a ghrelin szekréció és/vagy a GHS-R1a gátlása hasznos kezelés és/vagy megelőzés lehet a 2. típusú cukorbetegség. Ebben a tekintetben a közelmúltban számos, a ghrelin glükóz-inzulin homeosztázisra gyakorolt hatását értékelő tanulmány adatait tekintették át [57, 58].
A ghrelin bevonása az elhízásba számos, a grelinnel kapcsolatos farmakológiai eszköz kifejlesztéséhez vezetett az elhízás kezelésére. Jelen áttekintés a ghrelin elhízásban történő lehetséges klinikai alkalmazásának közelmúltbeli előrelépéseire összpontosít.
2. Ghrelin O-Aciltranszferáz: Farmakológiai cél az acilezett Ghrelin szint csökkentésére
A GOAT egy erősen hidrofób fehérje, nyolc feltételezett membrán-átívelő hélixszel, amely a gerincesek között magas fokú szekvencia-megőrzéssel rendelkezik. A kecskét acil-grelinnel együtt expresszálják a ghrelin-expresszáló szövetekben [59]. A GOAT előnyben részesíti a hexanoil-CoA-t az oktanoil-CoA-val szemben, mint acil-donor [60]. Az acil-CoA endoplazmatikus retikulum lumenébe való bejutásához vezető pontos mechanizmus azonban továbbra sem ismert. Az egyik hipotézis szerint a GOAT esetleg megkötheti az acil-CoA-t, és hidrofób tulajdonságai miatt lehetővé teszi a ghrelin acilezését az endoplazmatikus retikulum lumenében.
A GOAT-aktivitás in vitro biokémiai vizsgálata [3] feltárta a proghrelinben lévő számos aminosav (glicin-1, szerin-3 és fenilalanin-4) megfelelő felismerésének fontosságát a GOAT-aktivitás szempontjából [61].
A koplalás és a jóllakottság módosíthatja a GOAT aktivitását, mivel a ghrelin szint étkezés előtt emelkedik [4, 62], és csökken az étel bevitelével [5]. Ezenkívül a hosszú távú éhezés gátolja a ghrelin acilezését, de nem a teljes ghrelin szekréciót, míg az etetés elnyomja mind az acil, mind a des-acil grelint [63]. Az éhezés és az etetés hatása a GOAT mRNS szintjére azonban továbbra sem tisztázott [38, 64]. A kísérleti bizonyítékok azt mutatták, hogy a GOAT egy leptinnel szabályozott gén [38]. A hosszú távú krónikus alultápláltságra adott válaszként megnövekedett GOAT mRNS-szint [64] jelentheti az anorexia nervosa-ban az acilezett ghrelinszint megnövekedéséért felelős mechanizmust [26].
Az étrendi lipidek kritikus fontosságúak a GOAT aktiválódásában, következésképpen a ghrelin acilezésében. Valójában a 10% közepes láncú trigliceridet tartalmazó étrendnek alávetett GOAT knock-out egerek kisebb testtömeggel rendelkeznek, ami a vad típusú egerekhez képest alacsonyabb zsírtömeggel magyarázható [38]. Ezenkívül a GOAT transzgénikus egerek csak közepes láncú triglicerid-kiegészítéssel tápláltak nagy mennyiségű acil-ghrelint [38].
A ghrelin alapvető funkciója lehet az életképesség fenntartása éhínség időszakában. Ezt a hipotézist alátámasztják azok az adatok, amelyek azt mutatják, hogy a vad típusú és a GOAT kiütéses egerek 60% kalória-korlátozott étrendnek vetették alá a testtömeg 30% -át és 75% -át [65].
Sok munka vár még arra, hogy teljes mértékben megértsük, hogy a GOAT hogyan illeszkedik az energia homeosztázis szabályozásába. Mind a GOAT fehérje szintjének, mind a GOAT aktivitásának mérése kulcsfontosságú lesz a génexpresszió és a funkcionális szabályozás meghatározásához. Valóban, a GOAT kiütéses egerek értékes eszközt jelentenek az acilezett ghrelin specifikus hiányának fiziológiai következményeinek meghatározásában.
Nemrégiben a GOAT genetikai variációját javasolták bevonni az anorexia nervosa etiológiájába [66]. Érdekes lenne megállapítani, hogy a GOAT genetikai variációja is összekapcsolható-e az elhízással. Ha ez bebizonyosodik, a GOAT-ot célzó személyre szabott orvoslás új terápiás megközelítésként képzelhető el az elhízás kezelésében.
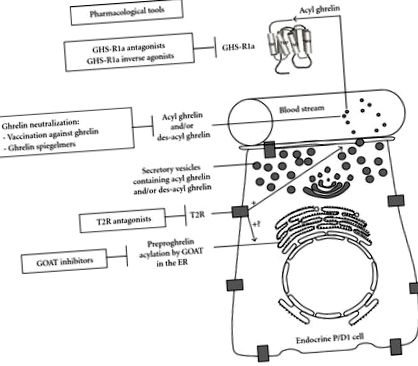
Farmakológiai eszközöket fejlesztettek ki a GOAT gátlásának megcélzására (1. ábra). Valójában egy pentapeptid, amely a ghrelin első öt N-terminális aminosavának felel meg C-terminális végével amidálva, kompetitíve gátolja a GOAT aktivitást egy végtermék gátlási mechanizmus révén. A GOAT gátlása akkor érhető el jobban, ha a pentapeptidek tartalmaznak egy oktanilcsoportot, amely amidkötéssel kapcsolódik a szerin-3-hoz [3]. Ezenkívül a GOAT-ot peptidalapú biszubsztrát analóg, a GO-CoA-Tat is gátolta a tenyésztett sejtekben, valamint az egerekben [67]. Ennek a biszubsztrát analógnak a kialakítása azon az elméleten alapult, hogy a GOAT egy három komplex mechanizmust használhat az oktanoil-CoA és a ghrelin összekapcsolásához. Az intraperitoneális adagolás csökkentette a súlygyarapodást és javította a glükóz toleranciát a vad típusú egerekben, de nem a ghrelin kiütéses egerekben [67]. Annak ellenére, hogy a GO-CoA-Tat peptid alapú gyógyszerként bizonyos korlátozásokat mutat be, valószínűleg a jövőbeni szintetikus származékok maximalizálják farmakológiai tulajdonságait.
Összegzésként elmondható, hogy a GOAT rendkívül ígéretes jelölt az elhízás elleni és/vagy cukorbetegség elleni gyógyszerek kifejlesztésére. Valóban, ez az egyedüli enzim, amely felelős a ghrelin-acilezésért, és modulációja csak a ghrelin-acilezés fiziológiai folyamatát befolyásolja.
3. A Ghrelin semlegesítése
A ghrelin elleni oltás stratégiát jelent a ghrelin hatásainak blokkolására (1. ábra). A ghrelin-hapten immunkonjugátumokkal immunizált patkányok antitestek termeléséhez vezettek, amelyek kifejezetten az acilezett ghrelin ellen irányultak, és csökkentették a testtömeg-növekedést a zsírtömeg előnyös csökkentésével, a csökkent etetési hatékonyság mellett [68]. A ghrelin elleni oltás emberi jelentősége továbbra is bizonytalan. Valójában az I/II. Fázisú CYT 009-Ghr Qb vakcina felhasználásával végzett vizsgálat, a Cytos Biotechnology AG-tól, a hatékony antitest-válasz ellenére sem mutatott súlycsökkentő hatást elhízott embereknél.
A nagy affinitású antiacil-ghrelin-specifikus monoklonális antitestek specifikusan kötik az acil-ghrelint, dózisfüggően gátolják a GHS-R1a-aktivációt in vitro, és in vivo blokkolják a ghrelin-indukálta táplálékfelvételt [69].
A ghrelin semlegesítését spiegelmerek, antiszensz polietilénglikollal módosított L-oligonukleotidok alkalmazásával is sikerült elérni, amelyek képesek specifikusan megkötni a célmolekulát (1. ábra). A spiegelmer NOX-B11-2 csökkentette a táplálékfelvételt és a testsúlyt az étrend okozta elhízott egerekben [70–72]. Egy másik spiegelmer, az NOX-B11-3 hosszan tartó hatást gyakorolt a ghrelin által kiváltott GH felszabadulás gátlására patkányokban [73], de nem blokkolta az éhgyomorra kiváltott idegsejtek aktiválódását a hipotalamusz íves magjában [74]. A keringő ghrelin spiegelmerek általi semlegesítése hasznos lehet a magas ghrelin-szinttel járó betegségek, például a súlyos elhízással jellemzett PWS kezelésére. A Pfizer Inc. átvette az eredetileg a NOXXON Pharma AG által kifejlesztett NOX-B11 spiegelmerek továbbfejlesztését.
Összefoglalva, a ghrelin elleni oltás terápiás hasznossága és a ghrelin spiegelmerek felhasználása az elhízás kezelésében még bizonyítatlan.
4. GHS-R1a: Farmakológiai cél a Ghrelin által kiváltott válaszok antagonizálására
4.1. GHS-R1a antagonisták
A ghrelin jelátvitel gátlása vonzó célpont a 2-es típusú cukorbetegség, az elhízás, különösen a PWS és a metabolikus szindróma farmakológiai kezelésében. Következésképpen számos GHS-R1a antagonista osztályt fejlesztettek ki (1. ábra).
[D-Lys-3] A GHRP-6, egy peptid GHS-R1a antagonista, csökkentette a táplálékfelvételt sovány és elhízott egerekben, és csökkentette a súlygyarapodást [70, 75].
A piperidin-szubsztituált kinazolinon-származékokat a kis GHS-R1a antagonista molekulák újfajta osztályaként azonosították [76]. A fenil- vagy fenoxicsoportok optimális szubsztituensek a kinazolinonmag 6. helyzetében, és a 2. helyzetben lévő fenilcsoportok kis alkilszubsztituensekkel történő helyettesítése hasznosnak bizonyult [76]. A YIL-781, egy piperidin-szubsztituált kinazolinon-származék, amely erős GHS-R1a antagonistaként működik, javította a glükóz által stimulált inzulin szekréciót, és csökkentette az étrend-bevitelt és a fogyást az étrend okozta elhízott egerekben [77].
Egyes háromszubsztituált 1,2,4-triazol szerkezetet hordozó GHS-analógok, mint például a JMV2866 és a JMV2844, GHS-R1a antagonistaként viselkedtek [78, 79]. A közelmúltban további, globális hasonló szerkezetű új GHS-R1a antagonistákat azonosítottak homogén, időben felbontott fluoreszcencia alapú vizsgálati szűrés alkalmazásával [80].
A piperazin-bisamid analógok szintézisének optimalizálása hatásos GHS-R1a antagonistákhoz vezetett. Ezen analógok egyike különösen nagy hatékonysággal, valamint egyéb érdekes farmakológiai tulajdonságokkal rendelkezett, és gátolta a GH felszabadulását ex vivo [81].
Számos karbohidrazid-származékot azonosítottak potens és szelektív GHS-R1a antagonistaként [82]. Ezen vegyületek közül a GSK1614343 kimutatták, hogy a patkány GHS-R1a erős kompetitív antagonistája [83]. Váratlanul a GSK1614343 növelte a táplálékfelvételt és a testsúlyt patkányokban és kutyákban egyaránt [84].
A BIM-28163-t ghrelin antagonistaként azonosították, amely blokkolja a ghrelin által kiváltott GH-szekréciót [85]. A GHS-R1a antagonista krónikus beadása azonban váratlanul testtömeg-növekedést váltott ki [85].
A súlyzavarok, köztük az elhízás kezelésére kifejlesztett egyéb GHS-R1a analógokat továbbra is preklinikai vegyületeknek tekintik (TZP-301, a Tranzyme Pharma és az EX-1350, az Elixir Pharmaceuticals cégtől) [86].
Következtetésekként a GHS-R1a antagonisták több osztályát azonosították, és érdekes farmakológiai eszközöket jelenthetnek az elhízás, valamint a 2-es típusú cukorbetegség és a metabolikus szindróma kezelésében. Azonban az elhízás összefüggésében továbbra is hosszú távú állat- és humán vizsgálatok szükségesek a ghrelin antagonisták jótékony tulajdonságainak megfelelő értékeléséhez.
4.2. GHS-R1a inverz agonisták
A GHS-R1a magas konstitutív aktivitása arra utalt, hogy az inverz GHS-R1a agonisták, csökkentve annak konstitutív aktivitását, hasznosak lehetnek az elhízás kezelésében [87, 88]. A hosszú éhezés a hipotalamuszban fokozta a GHS-R1a expressziót és az egyidejű jelátvitelt, ami nagyobb étvágyat és csökkent energiafelhasználást eredményezett. Ezért a GHS-R1a konstitutív aktivitás inverz agonistával történő csökkentése növelheti az anorexigén hormonok, például a leptin vagy a PYY iránti érzékenységet, és megakadályozhatja az étkezés közötti étkezést [89].
A [D-Arg 1, D-Phe 5, D-Trp7,9, Leu11] P anyagot inverz agonistaként azonosítottuk a GHS-R1a-on [90].
Összefoglalva, a GHR-R1a inverz agonisták érdekes farmakológiai eszközt jelentenek a GHS-R1a aktivitás gátlásához (1. ábra). Ugyanakkor további vizsgálatok szükségesek a vegyületek hosszú távú felhasználásának állatmodellekben történő értékelésére, hogy tisztázzák azok hasznosságát az emberek elhízásának és a kapcsolódó betegségek kezelésében.
5. Új potenciális farmakológiai cél a ghelin szekréciójának csökkentésére
Nemrégiben kimutatták, hogy a keserű ízreceptor (T2R) agonisták szondája növeli az egerek plazma-acil-ghrelinjét a α-gustducin, az α-az ízjelátvitelben részt vevő trimeriás G-fehérje komplex alegysége [91]. Az immunfluoreszcenciás vizsgálatok azt mutatták, hogy a ghrelint expresszáló gyomor endokrin sejtek akár 90–95% -ban kolokalizálódtak α-gustducin. Továbbá a T2R-agonisták szondázása növelte a táplálékfelvételt a vad típusú egerekben, de nem α-a gustducin vagy a GHS-R1a kiütötte az egereket [91]. Jelenleg nem világos, hogy a T2R aktiválódása után kiváltott transzdukciós utak befolyásolhatják-e a GOAT általi ghrelin-acilezést és/vagy a ghrelin felszabadulást.
Összefoglalva, a T2R új érdekes farmakológiai célpontot jelenthet a ghrelin szekréciójának modulálására (1. ábra). Továbbá értékelni kell a T2R antagonisták esetleges alkalmazását az elhízás kezelésére.
6. Általános következtetések
A ghrelin bevonása az elhízásba és a ghrelin biológia jobb megértése vezetett a farmakológiai célok azonosításához és az elhízás és a kapcsolódó betegségek kezelésére szolgáló farmakológiai vegyületek kifejlesztéséhez. Eddig a farmakológiai vegyületeket úgy tervezték, hogy megcélozzák a GOAT-ot, a ghrelin-t és a GHS-R1a-t. Nemrégiben felmerült, hogy a T2R a ghrelin és az elhízás kezelése kapcsán is érdekes célpontot jelenthet.
Köszönetnyilvánítás
Ezt a cikket az Orvosi Tudományos Kutatási Alap (FRSM, Belgium) 3.4510.03 és 3.4561.07 támogatása támogatta. A szerző köszönetet mond Dr. Jason Perretnek a tanulmány elkészítése során nyújtott hasznos beszélgetésekért, támogatásért és kritikai olvasásért.
Hivatkozások
- A diszlipidémia és az elhízás összefüggése a glikált hemoglobinnal Klinikai cukorbetegség és
- Elhízás, hasnyálmirigyen belüli zsírszűrés és hasnyálmirigyrák klinikai rákkutatás
- Elhízás és mentális egészség
- Elhízás és túlevés Hogyan lehet megtörni egy rossz szokást - ABC News
- Elhízás és túlsúlyos Texas Szív Intézet