A GLP-1R G-fehérjéből elfogult agonista autokrin kiválasztása, erős antidiabetikus hatással
Tárgyak
Absztrakt
A glukagonszerű peptid-1 (GLP-1) receptor (GLP-1R) agonisták a 2-es típusú cukorbetegség (T2DM) kezelésének lehetőségeként jelentek meg. A GLP-1R a G-fehérjétől függő és a G-fehérjétől független utakon keresztül jelzi az állványfehérje β-arresztin bekapcsolásával; a ligandumok előnyös szignalizációja ezen ágak egyikén vagy másikán keresztül „ligand torzításként” ismert. Itt beszámolunk a P5 erős és szelektív GLP-1R G-fehérjével elfogult agonista felfedezéséről. A nagy kombinatorikus peptid könyvtárak nagy áteresztőképességű, autokrin alapú szűrésén azonosítottuk a P5-öt, és kimutattuk, hogy a P5 elősegíti a G-fehérje jelátvitelt, hasonlóan a GLP-1-hez és az Exendin-4-hez, de szignifikánsan csökkent β-arrestin választ adott. A T2DM különböző egérmodelljeivel végzett preklinikai vizsgálatok azt mutatják, hogy a P5 gyenge inzulin szekretagóg. Mindazonáltal a diabéteszes egerek P5 krónikus kezelése fokozta az adipogenezist, csökkentette a zsírszövet gyulladását, valamint a máj steatosisát, és hatékonyabban korrigálta a hiperglikémiát és csökkentette a hemoglobin A1c szintjét, mint az Exendin-4, ami arra utal, hogy a GLP-1R G-fehérjével elfogult agonisták új terápiás megközelítést nyújt a T2DM-hez.
Bevezetés
A 2-es típusú diabetes mellitus (T2DM) egy komplex anyagcserezavar, amelyet az elégtelen inzulinszekréció és az inzulinrezisztencia kialakulásának kombinációjából eredő hiperglikémia jellemez. Az inkretin, glükagonszerű peptid-1 (GLP-1) egy endogén peptidhormon, amelyet a bél endokrin sejtjeiből választanak ki az élelmiszer-bevitelre válaszul 1. A GLP-1 csökkenti az étkezés utáni glükóz excurziót azáltal, hogy fokozza a hasnyálmirigy β-sejtjeiből származó glükóz által stimulált inzulin szekrécióját, és nemrégiben kimutatták, hogy elősegíti a β-sejtek túlélését is rágcsálókban. Ezenkívül a GLP-1 hasnyálmirigyen kívüli műveleteket hajt végre, például elősegíti a gyomor kiürülését, a fogyást és növeli az inzulinérzékenységet a perifériás szövetekben 3. Ezért az inkretin alapú terápiák stratégiát jelentenek a T2DM kezelésében.
A GLP-1 a hasnyálmirigyben, más perifériás szövetekben és a központi idegrendszerben expresszálódó GLP-1 receptoron (GLP-1R) 4 keresztül fejti ki hatását. A GLP-1R aktiválása kiváltja a Gαs-fehérje kapcsolást, ami a ciklikus AMP (cAMP) emelkedéséhez vezet, modulálja az intracelluláris 5 kalciumkoncentrációt és β-arresztin toborzást indukál 6,7. Történelmileg úgy gondolták, hogy a β-aresztinek kizárólagos szerepet töltenek be a G-fehérjéhez kapcsolt receptor (GPCR) deszenzitizálásában 8. Azóta azonban bebizonyosodott, hogy a β-aresztinek működhetnek a 9, 10 jelző kaszkádok aktiválására is. Ebben a tekintetben a hasnyálmirigy-β-sejtekben mind a cAMP, mind a citoszolos Ca 2+ és a β-arresztin szignalizációjának emelkedése a GLP-1R aktiválódása után kritikus esemény a glükózfüggő inzulin szekréció elősegítésében.
A közelmúltban megjelent a „funkcionális szelektivitás” vagy a „ligandum torzítás” fogalma, amely szerint a ligandumkötés elősegíti a teljes GPCR jelátviteli repertoárnak csak egy meghatározott részhalmazát, mások kizárásával 11. A GLP-1R pleiotróp jelátvitel és az alapul szolgáló fiziológiai következmények jobb megértése új utakat kínálhat olyan újszerű hatású gyógyszerek kifejlesztéséhez, amelyek nagyobb terápiás értéket biztosíthatnak, miközben elkerülhetik a nem kívánt mellékhatásokat 12, 13. Ezért kifejlesztettünk egy autokrin alapú rendszert a nagy és sokféle, akár 100 millió különböző tagot tartalmazó kombinatorikus peptid könyvtárak szűrésére, azzal a céllal, hogy azonosítsuk a hatékony, szelektív, G-fehérjével elfogult GLP-1R agonistákat. Egy ilyen ligandumot azonosítottunk, amelyet P5-nek nevezünk, és jellemeztük azt in vitro farmakológiai fenotípust, és feltárta annak terápiás potenciálját.
Eredmények
Egy új GLP-1R agonista autokrin alapú kiválasztása
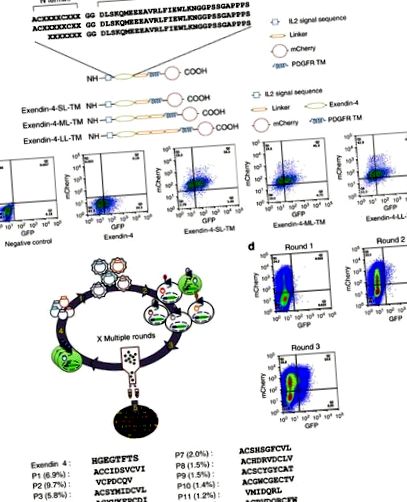
A GLP-1R potenciális G-fehérjével elfogult ligandumainak azonosításához peptidkönyvtárat expresszáltunk a GLP-1R-t és a zöld fluoreszcens fehérje (GFP) riporter gént expresszáló riporter sejtvonal sejtfelszínén egy kontroll alatt. CRE promóter (HEK293-GLP-1R-GFP) a GLP-1R által közvetített cAMP termelést kiváltó peptidek szűrésére. Ez az autokrin rendszer, fluoreszcenciával aktivált sejtrendezéssel (FACS) kapcsolva, óránként 20 millió esemény szűrésére képes. Az Exendin-4 (Ex4) a GLP-1 receptor 39 aminosav peptid agonistája. Az Ex4 C-terminális régiói kölcsönhatásba lépnek a GLP-1R N terminális extracelluláris doménjével, megkönnyítve az Ex4 N terminus és a receptor transzmembrán doménjének kölcsönhatását, ami a receptor aktiválásához vezet. Ezzel szemben az Exendin 9–39 peptid (Ex 9–39; Ex4 hiányzik a 8 első aminosav) kompetitív antagonistaként viselkedik 14. Ezen Exendin-szerkezet-aktivitás felismerések alapján három kombinatorikus peptid könyvtárat állítottak elő, amelyek véletlenszerű 7–10 aminosavból álltak összeolvadva az Ex 39–39 N terminálisához.
Mivel számos GPCR természetes ligandum ciklikus peptid, például kalcitonin, oxitocin és szomatosztatin 15, két ciklusos N-terminális véget kódoló könyvtárat (vagy randomizált tetrapeptidet (CX4C), vagy pentapeptidet (CX5C)) terveztek (1a. Ábra). A harmadik könyvtár hét véletlenszerű aminosavból állt, amelyek az Ex 9–39 N terminálisához fuzionáltak (1a. Ábra). Mindegyik könyvtárat egy hasítható interleukin 2 szignálszekvencia közé illesztettük, amelyet a sejtfelszíni lokalizáció elősegítésére használtunk, és egy linkert, amelyet a vérlemezkéből származó növekedési faktor receptor (PDGFR) transzmembrán domén követett, hogy a könyvtárat rögzítsük a sejt felületén (1a. Ábra). Ezenkívül az mCherry fluoreszcens fehérjét fuzionáltuk a PDGFR szekvencia C terminálisához, hogy lehetővé tegyük a transzdukciós hatékonyság ellenőrzését.
(a) A peptid könyvtárak sematikus ábrázolása. (b) A membránhoz kötött Exendin-4 (felül) vázlatos ábrázolása, valamint az mCherry és a GFP expressziójának FACS-elemzése 2 nappal a HEK293-GLP-1R-GFP sejtek transzdukciója után a membránhoz kötött Exendin-4-vel, különböző linkermérettel (alul) . (c) A kombinatorikus peptid könyvtár autokrin alapú szelekciójának sematikus ábrázolása. A lentivírus peptid könyvtárakat lentivirális plazmidokból állítjuk elő (1. lépés). A CRE-re reagáló GLP-1R riporter sejtvonalat lentivirális könyvtárral transzdukáljuk (2. lépés). A GFP-t expresszáló sejteket szétválogatjuk (3. lépés), és a peptideket kódoló géneket amplifikáljuk a szétválogatott sejtek genomiális DNS-étől, hogy elkészítsük a könyvtárat a következő szelekciós körre (4. lépés). Az iteratív szelekciós körök után a dúsított peptidszekvenciákat mély szekvenálással elemezzük (5. lépés). (d) GFP pozitív sejtek dúsítása a FACS szelekció három körében. (e) A top 13 peptid N terminális szekvenciája (gyakoriság> 1,0% reprezentáció).
Ezt követően megvizsgáltuk a P5 képességét a GLP-1R által közvetített intracelluláris Ca 2+ mobilizáció elősegítésére. A P5 koncentrációfüggő növekedést váltott ki a [Ca 2+] -banén és hasonló hatékonyságot és hatékonyságot mutattak, összehasonlítva az Ex4 referencia ligandummal és (2c. ábra; 1. táblázat). A GLP1-hez viszonyítva a P5 háromszor erősebb volt (1. táblázat). Általánosan elfogadott, hogy a GLP-1R által közvetített [Ca 2+] növekedésén a β-sejtekben a Gαs útvonal GLP-1R aktivációjának köszönhető, amely cAMP- és PLC/Ca 2+ -függő válaszokat indukál, nem pedig Gαq/11 szignáltranszdukcióval. Ennek ellenére a P5 által kiváltott [Ca 2+] növekedésén CHO-GLP-1R-ben expresszáló sejteket az FR900359 szelektív Gαq inhibitor gátolta (17., 18. hivatkozás; Kiegészítő 1d. ábra), megerősítve, hogy a GLP-1R funkcionálisan párosulhat Gαq-val.
Korábbi jelentések kimutatták, hogy a GLP-1R közvetlenül kapcsolódik a β-arrestin 1-hez és -2-hez az Ex4-gyel történő aktiválást követően (6., 7. hivatkozás). Ezért megvizsgáltuk a P5 azon képességét, hogy indukálja-e a β-arrestin 1 és -2 toborzását, olyan sejtvizsgálattal, amely figyeli a β-arrestin és a receptor közvetlen kölcsönhatását. A P5 nagymértékben csökkent hatékonyságot és hatékonyságot mutatott (Emax = 29 és 32%; EC50 = 447 és 529 nM, a β-arrestin 1 és -2 toborzás esetén), összehasonlítva az Ex4 referencia agonistával (EC50 = 29,57 és 5,6 nM a β-arrestin 1 és -2 utánpótlás esetén; 2d. Ábra, e) és a GLP-1 endogén peptidhez (Emax = 71 és 77%; EC50 = 280 és 60 nM a β-arrestin 1 és -2 utánpótlás esetén).
Tovább számszerűsítettük a P5 relatív torzítását egy „egyenértékű” összehasonlítás és az Ex4 referencia ligandum alkalmazásával. A GLP-1 endogén ligandum nem mutatott kimutatható torzítást, míg a P5 torzító tényezőket eredményezett (β), 0,9 és 1,4 a Gαs-fehérje esetében a β-arrestin 1 és -2, illetve 1,7 és 2,4 a Gαq-fehérje esetében a β-arrestin 1 és -2 felett (2f. ábra; 1. kiegészítő táblázat), így megerősítve, hogy a P5 előnyben részesíti a GLP-1R által közvetített G-fehérje aktivációt a β-arresztin toborzással szemben (G-fehérje torzításnak nevezik).
A P5 gyenge inzulin szekretagóg és javítja a glükóz toleranciát
A P5 hatékonyabban szabályozza a krónikus hiperglikémiát
Annak meghatározása, hogy a GLP-1R G-fehérje-elfogult agonistával végzett krónikus kezelés javíthatja-e a hiperglikémiát, ob/ob az egereket naponta 10 μg kg -1 P5 vagy Ex4 kezeléssel kezeltük 3 héten keresztül. Mindkét peptid szignifikánsan csökkentette a táplálékfelvételt (4a. Ábra) és a testtömeget (4b. Ábra) a kezelés kezdeti szakaszában. Mindazonáltal a kezelés 21. napjára, szemben az Ex4-gyel, a P5 nem befolyásolta szignifikánsan a testtömeget vagy a zsírtömeget, összehasonlítva a hordozóval kezelt ob/ob egerek (4b. ábra, c). A P5-kezelés azonban jelentősen csökkent ad libitum-táplált vércukorszint (4d. ábra) anélkül, hogy befolyásolta volna az inzulinszintet (4e. ábra), míg az Ex4 kezelésnek nem volt hatása a glikémiára (4d. ábra). Fontos, hogy az Ex4 és P5 különbségei vannak in vivo A hatékonyságot nem a peptid farmakokinetikájának különbségei okozzák, mivel mindkét peptid hasonló felezési idővel rendelkezik az egér szérumában (kiegészítő ábra. 3). Ezek az adatok arra utalnak, hogy a P5 diabéteszes betegeknél kiemelkedő antihiperglikémiás hatékonysággal rendelkezik ob/ob egerek.
A P5 és Ex4 krónikus kezelése jelentősen csökkentette a méhen kívüli lipid lerakódást a májban, ezt jelzi a lipidcseppek számának csökkenése (6a. Ábra, b), a trigliceridszint csökkentése (6c. Ábra) és a máj súlya (6d. Ábra). A G-fehérjével elfogult agonista ugyanolyan jól teljesített a keringő kis sűrűségű lipoprotein szint csökkentésében anélkül, hogy befolyásolta volna a nagy sűrűségű lipoprotein vagy triglicerid szinteket, összehasonlítva az Ex4 hasonló adagolásával (2. kiegészítő táblázat). Fontos, hogy a krónikus P5-kezelés nem váltott ki hepatocelluláris toxicitást, amit az alanin-aminotranszferáz, az alkalikus foszfatáz és az aszpartát-aminotranszferáz plazmaszintjének változásának hiánya tükröz (6e. Ábra). Összességében ezek az adatok azt sugallják, hogy a GLP-1R G-fehérjével elfogult agonista peptiddel végzett krónikus kezelés fenntartja az eWAT tömegét az adipogenezis növelésével és megakadályozza a magas zsírtartalmú étrend által kiváltott méhen kívüli zsírlerakódást.
Vita
A GPCR peptid ligandumokat mindig szelektivitásuk, hatékonyságuk és gyors optimalizálásuk miatt figyelték meg, azonban tipikusan a peptideket kémiailag szintetizálják, ami alacsony áteresztőképességű folyamat, amelyből eredendően hiányzik a változatosság. Noha az affinitáson alapuló szűrési technológiák, például a fág és az élesztő megjelenítése lehetővé teszik a nagy kombinatorikus peptid könyvtárak nagy áteresztőképességű szűrését, ezek rekombináns fehérje vagy membránkészítmények használatára támaszkodnak, és nem tesznek különbséget agonisták, inverz agonisták és antagonisták között. Ennek megoldására kifejlesztettünk egy funkcionális sejtalapú, autokrin rendszert a nagy intracelluláris kombinatorikus peptid könyvtárakból származó ligandumok kiválasztására. Ez a funkcionális sejtalapú rendszer lehetővé teszi 100 millió peptid szűrését óránként 2 millió eseménynél. Az itt bemutatott koncepciókísérleti kísérletek során három különálló peptid könyvtárat generáltunk és átvilágítottunk, és bemutattuk, hogy ez a módszertan hogyan teszi lehetővé az egyedi, farmakológiailag új GLP-1R ligandumok detektálását és azonosítását. Sőt, ez az autokrin alapú szelekciós rendszer hatékony megközelítés, amely felhasználható az árva GPCR-ek deorfanizálására és más sejtfelszíni receptorokra is alkalmazható.
Akut körülmények között ez a G-fehérjével elfogult agonista jelentősen javította a glikémiás kontrollt metabolikusan egészséges állatokban, valamint a T2DM egérmodelljeiben. Metabolikusan egészséges egerekben a P5 ugyanolyan mértékben javította a vércukor-toleranciát, mint az Ex4 100-szor nagyobb dózisa. Ezek a megfigyelések, valamint a farmakokinetikai tanulmány azt sugallják, hogy a P5 hatékonyságának különbsége a peptid velejárója. Ebben a redukcionista megközelítésben a P5 szignifikánsan megemelte az inzulinszintet a kontrollhoz képest. A P5 szekretagóg aktivitása azonban szignifikánsan csökkent az Ex4 referencia peptidhez képest. Ezek az eredmények arra engednek következtetni in vivo, A β-arrestin 1/2 jelzés a GLP-1R aktiváció után, kritikus szerepet játszik a glükóz által stimulált inzulin szekréció erősítésében. Ezek az adatok összhangban vannak a korábbi jelentésekkel, amelyek azt mutatják, hogy a β-arrestin 1/2 nélkülözhetetlen a GLP-1 potencírozó hatásához a glükóz által stimulált inzulin szekrécióra tenyésztett hasnyálmirigy β sejtekben 6,7 .
Összefoglalva, a kombinatorikus peptid könyvtárak nagy áteresztőképességű, autokrin alapú funkcionális szűrése lehetővé tette egy nagy hatású G-fehérjével elfogult GLP-1R agonista felfedezését, amely új farmakológiai erényeket mutat be. Transzlációs preklinikai vizsgálatok sorozatában bebizonyítottuk, hogy a P5 gyenge inzulin szekretagóg, ugyanakkor kiváló antidiabetikus hatást mutat (7. ábra). Így a GLP-1R G-fehérjével elfogult ligandumok új és nem értékelt előnyöket kínálhatnak a krónikus kezelés összefüggésében, mint például az adipocita hiperplázia elősegítése, az inzulin reakciókészségének helyreállítása és a hosszú távú glikémiás kontroll, miközben megőrzik a hasnyálmirigy β-sejtjeinek működését az inzulin szekréciójának minimalizálásával teher.
A FACS-hez kapcsolt autokrin alapú rendszert felhasználva nagy, sokféle, kombinatorikus peptid könyvtárakat szűrtünk át, és azonosítottuk a P5-et, amely egy erős és szelektív G-fehérjével elfogult GLP-1R agonista. A P5 csökkent inzulininotróp hatást mutatott, ugyanakkor jelentősen javította a glükóz toleranciát és az inzulin reagálóképességét a fehér adipocita szövet hiperplázia elősegítésével.
- Túl sok só hatását érzi?
- A sófelesleg 6 káros hatása a napi étrendben - NDTV étel
- Fekete ribizli felhasználás, mellékhatások, kölcsönhatások, adagolás és figyelmeztetés
- A fekete magolaj előnyei, mellékhatásai, adagolása és kölcsönhatásai
- 6 természetes módszer az antibiotikum mellékhatások elkerülésére és csökkentésére