A háti vagális komplex és a hipotalamusz glia differenciálisan reagál a leptin és az energiaegyensúly diszregulációjára
Tárgyak
Absztrakt
Korábbi tanulmányok meghatározzák a hipotalamusz glia szerepét az energiaegyensúly szabályozásában; A keskeny hipotalamusz-fókusz azonban nem teljes körű megértést ad arról, hogy az agy teljes glia hogyan reagál és szabályozza az energia homeosztázisát. Megvizsgáltuk a hátsó vagális komplexben (DVC) található glia válaszait az adipokin leptinre és a magas zsírtartalmú étrend okozta elhízásra. A DVC asztrociták funkcionálisan expresszálják a leptin receptort; in vivo farmakológiai vizsgálatok arra utalnak, hogy a DVC asztrociták részben közvetítik a leptin anorektikus hatásait sovány, de nem diétával kiváltott elhízott patkányokban. Az ex vivo kalcium képalkotás azt mutatta, hogy ezek a változások összefüggenek az elhízott és sovány állatok DVC-jének leptinre reagáló sejtek alacsonyabb arányával. Végül megvizsgáltuk a DVC mikroglia és asztroglia válaszait a leptinre és az energiamérleg diszregulációjára in vivo: az elhízás csökkentette a DVC asztrogliózisát, míg a Zucker patkányokban a leptin jelzés hiánya a DVC kiterjedt asztrogliózisával és a hipotalamusz mikro- és asztrogliózisának csökkenésével járt. Ezek az adatok új asztrociták funkcionális heterogenitását tárják fel a különböző agymagokban, amelyek relevánsak a leptin szignálozás és az energiaegyensúly szabályozása szempontjából.
Bevezetés
A hipotalamuszon túlra nézve a caudalis agytörzs dorsalis vagális komplexusa (DVC) egy másik központi idegrendszeri csomópontot jelent számos metabolikus és endokrin szignál kimutatásában, integrálásában és feldolgozásában, ideértve a leptint is 27,28,29. A DVC a nucleus tractus solitarius-ból (NTS), a területi postrema-ból (AP) és a vagus hátsó motoros magjából áll. A DVC-ben a leptin receptor szignalizáció elnyomja a táplálékfelvételt, és különösen erősíti az étkezésen belüli gyomor-bélből származó telítettségi jelek (pl. Gyomorfeszülés és kolecisztokinin) bevitelét elnyomó hatásait 28,30,31,32,33,34. Annak ellenére, hogy a DVC egyértelmű szerepet játszik az energia homeosztázisában, nagyon kevés tanulmány jellemzi azokat a specifikus sejtes fenotípusokat, amelyek kifejezik a LepR-t a DVC-ben. Az NTS asztrocitákon a LepR expressziójának bizonyítékai 35 az itt vizsgált jelenlegi hipotézishez vezettek, miszerint a DVC glia a központi leptin szignalizáció elsődleges sejtcélja. Vizsgáltuk a LepR expresszióját asztrocitákon a DVC-ben, és értékeltük a DVC asztrociták szerepét a leptin anorektikus hatásainak közvetítésében. Ezenkívül megvizsgáljuk az elhízás és a leptin szignalizáció zavarainak hatását a glia tájra mind a DVC-ben, mind a hypothalamusban.
Anyagok és metódusok
Állatok
Hím Sprague Dawley patkányokat (250–265 g, Charles River (UPenn) vagy Envigo (PBRC)) standard szokásos (Purina Rodent Chow 5001; Ralston Purina Company, St. Louis, Missouri) vagy 60% zsírtartalmú diéta (HFD; Rágcsáló-étrend D12492; Research Diets, New Brunswick, New Jersey) ad libitum hozzáféréssel a csapvízhez. A Zucker diabéteszes zsíros patkányokat (ZDF; Charles River) standard chow-étrenden tartottuk. Az állatokat függesztett drótketrecekben helyeztük el hőmérséklet-és páratartalom-szabályozott környezetben, fordított 12: 12: 00-os fény-sötét ciklusban. Valamennyi viselkedési kísérletet ellensúlyozott, egyénen belüli tervezéssel hajtották végre, randomizálás nem szükséges. Valamennyi kísérleti eljárást a Pennsylvaniai Egyetem és a Pennington Biomedical Research Center intézményi állatgondozási és felhasználási bizottságainak jóváhagyásával hajtották végre.
Sztereotaxiás műtétek
A patkányokat ketamin (90 mg/kg; Butler Schein), xilazin (2,7 mg/kg; Midwest Veterinary Supply) és acepromazin (0,64 mg/kg; Midwest Veterinary Supply) intramuszkuláris injekcióival altattuk. Sztereotaxiás műtét alkalmazásával a patkányokat egy belső kanülbe (26-os nyomtávú; Plastics One) ültették be, amely a 4. agykamrára irányult (4V; koordináták: középvonalon, 2,5 mm-rel az occipitalis varrat előtt és 7,2 mm-es hasi részen a koponyánál 36. Postoperatív fájdalomcsillapítás (2 mg/kg meloxicam) 2 napig szubkután adtuk, és az állatokat egy hétig hagytuk helyreállni. A helyes elhelyezést és a kanül átjárhatóságát 5-tio-D-glükóz (210 μg) által kiváltott hiperglikémia útján végzett viselkedési tesztelés előtt ellenőrizzük. korábban leírt 37; csak azokat az állatokat tesztelték, amelyek sikeresen megfeleltek az ellenőrzésnek.
Cy5-jelölt leptin szintézise és beadása
Rekombináns egérleptint (2,0 mg; NHPP) feloldottunk 500 μl 50 mM foszfátpufferben (pH 7,4), és óvatosan ringattuk tapadásmentes Eppendorf csövekben (Thermo Scientific, Cat. Sz. 3451). 0,2 mg szulfo-cianin-5 NHS-észtert (Lumiprobe, katalógusszám: 23320) feloldottunk 50 μl DMSO-ban, majd 1 órán át 10 μl-es alikvotokban hozzáadtuk az előoldott leptinhez. A reakcióelegyet szobahőmérsékleten egy éjszakán át keverjük, majd Shimadzu Prominence HPLC-vel tisztítjuk C18 oszloppal (Eclipse XDB-C18 5 μm, 4,6 x 150 mm) és [1% CH3CN/H2O + 0,1% TFA] gradienssel [70% -ig]. % CH3CN/H20 + 0,1% TFA] 15 perc alatt. A terméket a
Az asztrocita LepR fluoreszcens in situ hibridizációja
A leptin receptor igazolásához patkány DVC asztrocitákon egyetlen állat (n = 1) érzéstelenítettük az agy gyors eltávolítása érdekében, és izopentánban fagyasztva flash-jet száraz jég felett. Az agyat 18 μm vastagságú kriosztáton metszettük, csúszdára szereltük és -80 ° C-on tároltuk. A fluoreszcens in situ hibridizációt (FISH) az RNAscope Multiplex Fluorescent Reagent v2 (katalógusszám: 323100; ACDBio, Hayward, CA) gyártói utasítások szerint hajtottuk végre. A detektálást ACDBio által tervezett szondákkal végeztük LepR mRNS-hez (Rn-LepR-C1, Kat. Sz. 415951), az asztrocita-specifikus Aldh1L1 markerhez (Rn-Aldh1L1-C2, Kat. Sz. 459821-C2) és az idegsejt markerhez. RbFox3 (Rn-RbFox3-C3, katalógusszám 436351-C3). Az amplifikációs lépések sorozatát követően a metszeteket DAPI-t tartalmazó rögzítő közeggel (Fluorogel; Fischer Scientific) szereltük fel. A metszeteket Leica SP5 X konfokális mikroszkóppal vizualizáltuk 40x objektívvel. A kép z-veremeket 1 μm lépésmérettel gyűjtöttük össze. Az összegyűjtött z-stack képeket az Imaris 8.1.2 szoftverrel (Bitplane) dolgoztuk fel.
Idegsejtek és asztrociták élő sejt Ca +2 képalkotása NTS szelet készítményekben
Hím Sprague Dawley patkányok (290–420 g; chow n = 4, HFD n = 3) mélyen altattunk uretánnal (1,5 g/kg, intraperitoneális; etil-karbamát, Sigma; ezt az érzéstelenítőt azért választottuk, mert könnyen kimosódott az ex vivo szeletekből 38), és sztereotaxiás keretbe helyeztük. Aszeptikus technika alkalmazásával 4 egyoldalú injekciót (egyenként 40 nL) 0,4% Cal520 (AAT Bioquest), 0,3% sulforhodamine 101 (SR101; Sigma Chemical) és 10% pluronic-DMSO (F-127, Invitrogen) injekcióval adtunk normál Krebs oldatban. a mediális NTS-be. 60 perc elteltével a patkányokat lefejezték, és az agytörzset gyorsan összegyűjtötték. Az előre jelölt agytörzseket 300 μm-es koronaszeletekre vágtuk rezgő mikrotóm (Leica VT1200) felhasználásával, és hidegbe merítettük (
4 ° C) karboxigénezett (95% O2; 5% CO2) vágóoldat. Az NTS szeleteket normál Krebs-oldatba helyeztük, és 95% O2/5% CO2-ot buborékoltattunk állandó hőmérsékleten, 29 ° C-on. A metszeteket a képalkotás előtt 1 órán át hagytuk egyensúlyban lenni .
Az előjelölt idegsejtek és asztrociták élő sejt kalcium képalkotását a korábban leírt 39,40,41 szerint végeztük. Az előzetesen megjelölt Cal-520/SR101 szeleteket egy egyedi 42 képalkotó kamrába vittük át. Korábban beszámoltak az SR101 asztrocitákkal szembeni specifitásának immunhisztokémiai megerősítéséről a DVC-ben 43. A felvevő kamrát folyamatosan perfundáltuk 2,5 ml/perc sebességgel normál Krebs (vagy 100 ng/ml leptint tartalmazó) oldattal 33 ° C állandó hőmérsékleten. A hátsó agyi szeleteket egy normál epifluoreszcencia optikával ellátott Zeiss Axioskop 2 fix színpadú mikroszkóppal, egy Yokogawa CSU21 lézeres konfokális letapogató fejjel és egy Hamamatsu ORCA-ER kamerával néztük meg. Az előzetesen jelölt sejteket vizuálisan epifluoreszcens optikával szelektáltuk, majd konfokális képeket rögzítettünk az ORCA-ER kamerával 1 képkocka/másodperc sebességgel.
A felvevő kamrába kerülve a hátsó agyi szeleteket normál Krebs-oldattal legalább 10 percig perfundáltuk. Kettős expozíciós képeket (azaz 488 nm és 591 nm) gyűjtöttünk közvetlenül az egyes kísérleti kísérletek előtt a rögzített sejttípusok megerősítése érdekében. Ezután az összes szeletet 100 µM ATP és 500 µM glutamát koktéllal hoztuk létre, hogy meghatározzuk, hogy a mező mely sejtjei voltak életképesek 39,44. Az életképességet úgy határoztuk meg, hogy a fluoreszcencia minimális növekedése 7% volt az ATP/glutamát fertőzésre adott válaszként 45. Ezután a szeleteket Krebs oldatának és 100 ng/ml leptinnek tettük ki 30 másodpercig. Az intracelluláris kalciumkoncentráció változását a leptin ingerekre adott válaszként a Cal-520 előre jelzett NST asztrocitákban és az idegsejtekben egyidejűleg rögzítettük a 488 nm-es lézervonalat a Cal-520 gerjesztésére. Az intracelluláris kalciumkoncentrációk növekedését a fluoreszcencia növekedéseként azonosítottuk, és értelmezésük szerint megnövekedett sejtaktivitást jelent. Kísérleti vizsgálatok során az NTS asztrociták és az idegsejtek vegyes területeinek időintervallumú képeit figyelték a leptin-provokációra adott válaszok szempontjából. Mind az asztrociták, mind az idegsejtek intracelluláris kalciumszintjének változásainak időintervallumú lézeres konfokális képeit 1 képkocka/másodperc sebességgel rögzítettük az ORCA-ER segítségével.
Viselkedési kísérletek
A patkányokat mindkét standard állaton tartottuk (n = 10) vagy zsíros diétával 2 hétig (n = 7). Minden állatot a 4. kamrára (4V) irányított kanülbe ültettek be, hogy lehetővé tegye az intracerebroventrikuláris (icv) beadást. A gyógyulási periódus 1 hét volt, és ezalatt a kanül elhelyezését az 5-TG 46,47-re adott hiperglikémiás reakcióval igazolták. Az ételtartályokat eltávolítottuk, és az állatokat körülbelül 1 órával lemértük a sötét megjelenés előtt. Harminc perccel a sötét megjelenés előtt az állatok 4 V icv vivőanyagot (0,1 M PBS) vagy 50 nmol fluor-citrát előkezelést (Sigma Aldrich 40,48,49,50) kaptak, ezt követően vivőanyag (0,1 M NaHCO3) vagy 5 μg/ml leptin (NHPP 51) . A fluorocitrát egy jól bevált farmakológiai szer, amelyet a Kreb ciklusának átmeneti gátlására használnak asztrocita-specifikus módon 48,50,52,53,54. A kiválasztott 50 nmol fluor-citrát dózis asztrocita-specifikus 40,48. Sötét kezdetkor az élelmiszer-tartályokat kicserélték, és az összesített táplálékfelvételt rögzítették 1., 3., 6. és 24. órakor. A testtömegeket az injekció beadása után 0 és 24 órával rögzítettük. A kísérleti injekciókat 72 órás mosási periódussal választottuk el.
A gliozis immunhisztokémiai elemzése
Statisztika
Minden adat az átlag ± az átlag standard hibájaként jelenik meg. A teljesítményelemzést a kísérletek elvégzése előtt 0,05 és 80% -os alfa alkalmazásával végeztük. A qPCR vizsgálatok összehasonlításait egyutas varianciaanalízissel (ANOVA) és Dunnet post hoc tesztekkel végeztük. Az élő kalcium képalkotás szempontjából a jelentőséget egyirányú ANOVA-val határoztuk meg Bonferroni t-tesztekkel. A reagáló sejtek százalékos arányának összehasonlítását Fisher pontos tesztjével végeztük. A táplálékbevitel és a testtömeg viselkedési összehasonlításához ismételt 3-, illetve 2-utas ANOVA-mérést alkalmaztunk Neuman-Keuls post hoc elemzésekkel. Statisztikai szignifikanciát o
Eredmények
A DVC asztrociták expresszálják a leptin receptort
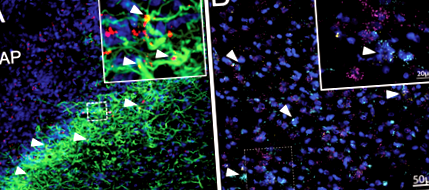
A leptin receptor expressziója hipotalamusz asztrocitákon jól megalapozott patkányokban és egerekben 14, 15,35,59. Kiegészítésként immunhisztokémiát végeztünk a LepR expressziójának megerősítésére DVC asztrocitákon patkányban. A fluoreszcensen jelölt leptin (4,5 ng Cy5-Lep) 4. intracerebroventrikuláris (4V) injekcióját követően együtt lokalizációt figyeltünk meg a DVC asztrocitákkal (GFAP; zöld; 1a. Ábra), túlnyomórészt a subpostrema-nál, az AP és az NTS határán. . A LepR expresszió jelenlétét patkány DVC asztrocitákon FISH detektálta RNS-skála alkalmazásával. A LepR mRNS expresszióját (sárga) mind a neuronokon (bíborvörös), mind az asztrocitákon (cián) megfigyelték a subpostrema és a mediális NTS-ben (1b. Ábra; 1. kiegészítő videó).
a A Cy5-Lep (4V icv 4,5 ng; piros) immunhisztokémiai vizualizációja kolokalizálva DVC asztrocitákra (GFAP; zöld), kékre a DAPI; 63x kép (beillesztve: 2x optikai zoom). b Az LEP-Rb (sárga) expressziójának laterális NTS-jének (AP szintjén) vizualizálása DVC asztrocitákon (ALDH1L1; cián) és neuronokon (RbFox3; bíborvörös). Ellenfestés DAPI-val (kék); 40x kép (beillesztve: 3,4x optikai zoom gausus-szűrővel). A szaggatott vonallal körvonalazott terület 3D forgási képét lásd az 1. kiegészítő videóban.
A magas zsírtartalmú étrend okozta elhízás csökkenti mind a DVC asztrociták, mind az idegsejtek százalékos arányát, amelyek leptin indukálta Ca +2 jelátvitelt mutatnak ex vivo agytörzsi szelet készítményekben
A DVC asztrociták energia homeosztázisban betöltött szerepének jobb jellemzése érdekében ezután a leptin által kiváltott intracelluláris Ca +2 válaszokat vizsgáltuk a DVC idegsejtjeiben, az asztrocitákat pedig ex vivo agytörzsi szelet készítményekben (2. ábra). Ezenkívül megvizsgáltuk, hogy az étrendi állapot és az elhízás megváltoztatta-e a leptin által kiváltott válaszokat (vagyis összehasonlítva a Ca +2 jelátvitelt a sovány patkányok DVC-jén, standard chow-on vagy elhízott patkányokon, akiket 60% magas zsírtartalmú étrend tartottak) . Képalkotó kísérletek chow-fenntartott patkányok előre jelzett hátsó agyszeletein (n = 4) 61 életképes neuront és 35 életképes asztrocitát eredményezett; magas zsírtartalmú étrendben tartott patkányok (n = 3) 37 életképes idegsejtet és 24 életképes asztrocitát eredményezett.
A sovány állatok idegsejtjei és asztrocitái élő sejt Ca +2 fluxust (azaz a citoplazmatikus Ca + 2 növekedését) termelték válaszul a 100 ng/ml leptin fürdő alkalmazására (2h ábra). A magas zsírtartalmú étrend fenntartása gyengítette a DVC neuron Ca + 2 válaszát az asztrocita válaszok befolyásolása nélkül (F3,62 = 4,072; o = 0,01). Továbbá a magas zsírtartalmú étrendnek kitett állatoknál jelentősen csökkent a leptinre reagáló idegsejtek és asztrociták százalékos aránya a sovány állatokhoz képest (2i., J. Ábra). Az asztrocitákban ez inkább a LepR funkcionális expressziójának lehetséges változására utal, mintsem a leptin válaszkészségének változására a sejtek szintjén. Reprezentatív videók az élő kalcium képalkotás vegyes neuro-asztrocita terét mutatják be a leptin beadását követően a chow (Supplementary Video 2) és a HFD (Supplementary Video 3) fenntartású patkányokban.
A DVC asztrociták részben közvetítik a leptin anorektikus hatásait sovány, de nem elhízott patkányokban
A magas zsírtartalmú étrend fenntartása csökkenti a DVC asztrociták aktiválódását
A LepR jelzés elvesztése elősegíti az asztrogliózist a DVC-ben
A Zucker diabéteszes zsíros patkányok (ZDF) olyan mutációval rendelkeznek a leptin receptoron belül, amely megakadályozza a 61,62-es leptinkötést követő szignalizációt. A leptin receptor hiányának ez a formája elhízást, hiperfágiát és hiperglikémiát eredményez (3. ábra). Ezekben a ZDF patkányokban a hiányos leptin receptor szignalizáció miatti elhízás szignifikánsan magasabb asztrogliózissal járt együtt a DVC-ben (5a – d. Ábra), de az íves magban a GFAP-pozitív sejtek sűrűségének jelentős csökkenése a vad típusú kontroll patkányokhoz képest ( 5e. Ábra). A mikroglia sűrűsége szignifikánsan alacsonyabb volt a ZDF patkányok íves magjában, mint a vad típusú patkányokban (5j. Ábra). Ezzel szemben a mikroglia sűrűségében nem észleltek változást a ZDF patkányok DVC-jében a kontroll patkányokhoz képest (5f – i. Ábra).
A jelenlegi adatok másik fontos megállapítása, ha a hipotalamuszról már korábban ismert irodalommal összefüggésben vizsgáljuk, a DVC és a hypothalamus glia sejtek elhízásra adott válaszainak figyelemre méltó eltérése volt. Mivel a mikroglia a központi idegrendszer 74 rezidens immunokompetens sejtjei közé tartozik, és korábban kimutatták, hogy reagál a magas zsírtartalmú étrendre és az elhízásra, megmértük a HFD és a leptinjelzés hiányának a mikroglia sűrűségére gyakorolt hatását. A magas zsírtartalmú étrend önmagában nem vezetett változásokat a mikroglia sűrűségében sem a DVC-ben, sem a hipotalamuszban. A mikroglia állapotának jövőbeni jellemzésére, vagyis a pihenésre és az aktiválásra van szükség annak megállapításához, hogy a diéta és/vagy a leptin növeli-e az aktivált mikroglia számát.
Ezek az eredmények együttvéve alátámasztják azt a hipotézist, miszerint a DVC asztrociták hozzájárulnak az energiaegyensúly szabályozásához, és az étrend okozta elhízásra reagálva bekövetkező maladaptív változások alkotóelemét képezik. Ezenkívül eredményeink azt sugallják, hogy a DVC asztrocitái különösen érzékenyek lehetnek a leptin szignalizáció elvesztésére.
A jelen tanulmánynak számos korlátja volt. Az egyik figyelmeztetés az, hogy a HFD által kiváltott elhízott patkányok hiperglikémiásak, de nem cukorbetegek, míg a ZDF állatok teljes II-es típusú diabéteszes fenotípust mutatnak, ami felveti annak lehetőségét, hogy a hiperglikémia és az inzulinrezisztencia hozzájárulhat az asztrocitákra megfigyelt hatáshoz. A gliozis immunhisztokémiai elemzéseink nem mutatják be az étrend glia sejtekre gyakorolt hatásának finomított jellemzését. Jövőbeni elemzésekre van szükség az étrend által kiváltott, gliogenezisre gyakorolt hatásokról, a glia folyamatainak morfológiai változásairól, a glia aktivációjáról és a neuronális szinapszisokkal való társulásokról. Másodszor, történelmi irodalomra támaszkodtunk, amely a hipotalamusz leptin-asztrocita kölcsönhatását vizsgálta 11,13,14,15. Teljesen lehetséges, hogy a korábbi jelentések mindegyikének tartalmazhat bizonyos részletes módszertani korlátokat az elvégzett IHC-mennyiségi meghatározásokban.
Ezektől a korlátoktól függetlenül a jelenlegi adatok határozottan azt sugallják, hogy a területnek előnyös lenne, ha széles körű ismereteinket bővítenénk a különböző agymagok divergens asztrocita-válaszairól az elhízásra és a leptin szignalizáció változásaira, ha teljes mértékben meg akarjuk érteni az asztrociták által az energiaegyensúly szabályozásában játszott szerepet.
Összefoglalva, a LepR funkcionálisan expresszálódik a DVC asztrocitáin, és más funkcionális szerepet tölt be a DVC-ben, mint a hipotalamuszban. A hipotalamusz asztrocitákkal ellentétben a DVC asztrociták különösen érzékenyek lehetnek a leptin szignálozás hiányára. A jövőbeni erőfeszítéseknek a DVC és a hipotalamusz glia különbözõ funkcionális szerepei által támogatott idegrendszeri utak tisztázására kell összpontosítaniuk, valamint meg kell vizsgálniuk a leptin-asztrocita szignalizáció hozzájárulását más központi idegrendszeri magokban, amelyek relevánsak az energiaegyensúly szabályozásában. A jelenlegi eredmények együttesen új szerepet tárnak fel a DVC asztrociták számára a leptin hatásainak közvetítésében.
- Energiamérleg és testzsírosság A World Cancer Research Fund International
- A csirke adaptív reakciója az alacsony energiájú étrendre a hipotalamusz lipid anyagcseréjének fő szerepe
- Energiamérleg és súlykezelés albizottság táplálkozási bizonyíték szisztematikus áttekintése
- Az energiamérleg és a legeltetett kisrágcsálók SpringerLink m-paramétere, m
- Kettős energiájú ikrek veszik fel az ételallergiákat - a Santa Barbara független