Hepatitis B és hepatitis C vírusok: a vírusgenomok, a vírus által indukált gazdaszervezet immunválaszainak, genotípusos eloszlásának és a világméretű epidemiológia áttekintése
Absztrakt
1. Bemutatkozás
2. Irodalomkeresés
A cikkeket a Google Scholarból és a Pubmed-ből kerestük a HBV kulcsszavaival, valamint a HBV DNS expressziójának elemzésével, a HBV genotípusos eloszlásával és a HBV globális epidemiológiai mintázataival. HCV és a HCV genomjának elemzése, a HCV genotípusos eloszlása és a HCV globális epidemiológiai mintázata. Az értékelt információkat felülvizsgáltuk.
2.1. HBV és genom
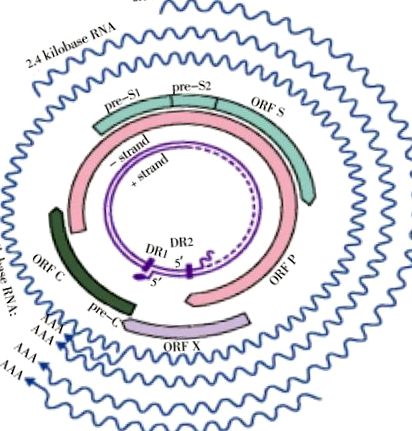
A dán részecske nukleokapszidja körülbelül 28 nm méretű, és a hepatitis B mag antigént alkotja. Részt vesz a vírusgenom csomagolásában. A HBV-részecske és a 22 nm-es részecskék és a tubuláris forma felületén jelen lévő hepatitis B felületi antigén (HBsAg) komplex antigén-determinánsként működik. A fertőző dán részecske bimbózás útján vagy szekréciós transzportmechanizmusok révén szerzi meg a Golgi-készüléket és az endoplazmatikus retikulumot. A külső burkolat membránja HBsAg-t képez, amely három vírusfelszíni fehérjét tartalmaz, amelyek a kis, közepes és nagy méretű HBsAg, HBmAg és HBlAg nagyság szerint vannak megnevezve. Ezeket a fehérjéket ugyanazon a nyitott leolvasási kereten (ORF) kódolják, amely 3 start kodont kódol és átfedéseket kap az ORF polimerázzal [11].
A pregenomikus RNS a legnagyobb transzkriptum, amely templátként szolgál a vírus replikációjához. Az egyetlen enzim, amelyet a vírusgenom kódol, amely reverz átírja a pregenomikus RNS-t, a víruspolimeráz, és ez az enzim szintén a nukleokapszidon belül helyezkedik el [12]. A maggén alternatív transzlációs termékei közé tartozik a hepatitis B magantigén és a hepatitis B burokantigén (HBeAg). A HBeAg fordításához egy upstream pre-core régióra van szükség ATG kodonnal [13]. A HBeAg poszttranszlációs módosításon megy keresztül. Nagyon fontos szerepet játszik a HBV-fertőzés molekuláris diagnosztizálásában, mivel aktív vírusreplikációs markerként működik. A HBeAg (amely antigén determinánsként működik) oldható fehérjeként is kering a szérumban [14]. Két DNS-szál ismert, amelyek hosszú [L (negatív) szál] és rövid [S (pozitív) szál]. Az L szál rögzített hossza 3,2 Kb, de az S szál hossza 3 'végén változó. Az S szál általában az L szál hosszának 50% -ától 100% -áig terjed (1. ábra).
Alapvető információforrás Engleberg és munkatársai, Schaechter's Mechanisms of Microbial Disease.
Négy konzervált, részben átfedő ORF létezik az L szálban, de az S szál esetében nincs részben átfedő ORF [15], [16]. Számos DNS-replikációs szignál mellett a vírusgenom két enhancer elemet, hat start kodont, négy promótert és egy poliadenilációs szignál motívumot is tartalmaz. A vírusgenom csak hét fehérjét kódol, azaz a mag előtti/magfehérjéket, a polimerázt, három felszíni fehérjét (kicsi, közepes és nagy) és a HBX fehérjét is. Az RNS-átiratok többsége zárva van és poliadenilezett, például pre-C/C (3,5 kb hosszú), pre S (2,4 kb), smRNS (2,1 kb) és alkalmanként xmRNS (kb. 0,7 kb). Ezeknek a HBV-átírásoknak 3'-végük van közös, amelyet a mag génjének poliadenilációs szignálja hozott létre [17], [18]. A HBsAg és IgG anti-HBc szintje tartósan kimutatható marad krónikus HBV fertőzés alatt. A HBeAg szintje változékony marad. A HBsAg több mint hat hónapos jelenléte krónikus fertőzés előfordulását jelzi. Az IgM anti-HBc negatív tesztje együttesen és a HBsAg pozitívja ugyanabban a szérummintában a krónikus fertőzés kezdetét jelzi HBV-fertőzött páciensnél [19].
Az elsődleges májrákot a világ 5. leggyakoribb rákjának tekintik, és a májsejtes karcinóma a primer májrák fő típusa. A világ számos területén a hepatocelluláris karcinóma több mint 85% -a megtartja a hepatitisz B és a hepatitis C elleni markereket [23]. Két kezelési lehetőség áll rendelkezésre a HBV elleni profilaxisra, amely magában foglalja a HBV és a hepatitis B immun globint. Az expozíció előtti és utáni expozícióhoz a hepatitis B vakcina ajánlott. A vakcina képes hosszú távú védelemre a HBV-fertőzés ellen. A hepatitis B immun globin csak körülbelül 3-6 hónapig képes ideiglenes védelmet nyújtani. Ez a kezelési lehetőség általában az expozíció utáni beállításokhoz ajánlott [24]. Hepatitis B vírusos mutánsok alakulnak ki néhány betegnél. Ezek a vírusmutánsok rezisztensek egy vagy több vírusellenes gyógyszerrel szemben. A kutatók általában új vírusellenes terápiás lehetőségeket fejlesztenek ki a rezisztencia megelőzése és a vírusterhelés minimalizálása érdekében.
2.2. HCV és genom
A HCV genom mérete 9,5 Kb. A genom 5 ′ és 3 ′ végein egyaránt vannak erősen konzervált, nem transzlált régiók, amelyek nagy transzlációs ORF-et (kb. 9 000 nukleotidot tartalmaznak) képesek 3 000 aminosavból álló poliprotein kódolására. A kb. 340 nukleotidból álló 5 'nem kódolású régió belső riboszomális belépési helyet (IRES) tartalmaz, amely elengedhetetlen a vírusos RNS cap-független transzlációjához. A genom 3 ′ régiója nem kódoló régiókat tartalmaz. A genom által kódolt poliprotein kezdetben egyetlen peptiddé alakul, amelyet később különféle sejtes és vírusos enzimek együtt és utólag transzkripcionálisan dolgoznak fel [9], [25] (2. ábra).
2.3. A HCV indukálta a gazdaszervezet immunválaszát
A HCV fertőzés a gazdaszervezet veleszületett immunválaszainak aktiválódását okozza. Ilyen válaszok általában két nappal a fertőzés után következnek be, fokozottabban érintve az interferonszabályozó tényezőket, a protein-kináz R-t és az antivirális géntermékeket, például az interferonnal indukálható géneket és az immuntranszkripciós faktorokat [27]. A veleszületett immunválaszt minden egyénnél megfigyelték, függetlenül attól, hogy krónikus fertőzés alakult-e ki náluk, vagy kontrollálták a vírust. A krónikus fertőzés kialakulása vírusrezisztenciára utal a veleszületett immunválaszokkal szemben, amelyek valószínűleg a HCV-fehérjék és a veleszületett immunrendszerrel összefüggő utak interferenciája miatt jelentkeznek. In vitro vizsgálatokból beszámoltak arról, hogy az NS5A és az E2 befolyásolja az R protein kinázt. A vírusmagfehérje gátolja a JAK-STAT útvonalat, amely részt vesz az interferon (IFN) szignálozásában. A vírusos NS3/4A blokkolja a foszforilezett interferon-3 szabályozó faktor (IRF-3) felhalmozódását, amely gátolja az interferonnal stimulált gének és az I. típusú IFN expresszióját [27], [33].
2.4. A hepatitis B vírus genotípusos eloszlása
A hepatitis B vírusfertőzés világszerte nyolc különböző genotípus (A-H) formájában oszlik meg [38]. Az újonnan leírt I. genotípus szintén érdeklődésre tart számot a jövőbeli kutatók számára [39]. Legalább 8% -os nukleotidszekvencia eltérés létezik nyolc ismert HBV genotípus között. Pakisztánban a D genotípus a legelterjedtebb, a becsült prevalencia aránya 63,71%. Ez a genotípus általában kevésbé reagál az interferon terápiára. Az A, C, B genotípus előfordulása Pakisztánban 10,036%, 7,550% és 5,335%. A kevert és a tipizálhatatlan genotípusok jelentett prevalenciája 9,93% és 2,37% [40]. Awan és mtsai által végzett legfrissebb tanulmány szerint. beszámoltak arról, hogy a C genotípus a legsúlyosabb májbetegségekkel (cirrhosis) társuló leggyakoribb genotípus. Ennek a genotípusnak a hozzávetőleges előfordulási aránya 27,7%, ami komoly veszélyt jelent a jövő nemzedékeire [41].
2.5. A HCV genotípusos eloszlása
2.6. A HBV globális epidemiológiája
A krónikus HBV-fertőzés epidemiológiája világszerte egyértelmű és sokszínű (3. ábra). A világ különböző területein végzett különféle szeroprevalencia-vizsgálatok könnyen feloszthatók a magasabb, a közepes és az alacsonyabb endemicitás három különálló csoportjába [53]. A nagyobb népességű fejlődő országokban (Délkelet-Ázsia, Szaharától délre fekvő Afrika, Kína, Indonézia, Nigéria és az Amazonas-medence) nagyobb az endemitás előfordulása, a lakosság körülbelül 8% -a a HBV krónikus hordozója. A világ fent említett területein a lakosság 70-95% -a képviseli a HBV elleni jelenlegi vagy korábbi szerológiai markereit. Egy másik tanulmányban arról számoltak be, hogy a világ népességének 60% -a a HBV-fertőzés magas endémiás zónájában található [54] - [56]. A HBV-fertőzés köztes endémiás zónája, Közel-Kelet, Kelet- és Dél-Európa, Dél-Amerika és Japán létezik. Ezen populációk között a becsült fertőzés körülbelül 10-60%, a krónikus hordozó arány 2-7%. A közepes endemicitás régiójában a fertőzések többsége felnőtteknél alakul ki, de a krónikus fertőzések aránya magasabb a csecsemőknél a korai gyermekkori vírusfertőzés következtében [57]. A HBV-fertőzés szeropéldányát Indiában 5% -ról jelentették, míg Olaszországban, Oroszországban és Törökországban a prevalencia aránya 3-10% között mozog [58] - [61].
A legalacsonyabb endemicitású HBV-zóna magában foglalja a legtöbb fejlett országot, például Ausztráliát, Észak-Amerikát, valamint Észak- és Nyugat-Európát. A világ fent említett régióiban a lakosság körülbelül 5-7% -a fertőződik meg HBV-vel, krónikus hordozók közel 0,5% -2,0% -ával. A HBV-fertőzés legvalószínűbb okai fiatal serdülőknél a magas kockázatú népességcsoportok, az injekciós drogfogyasztók, az egészségügyi szakemberek, a szexmunkások és az egészségtelen vérátömlesztésnek való kitettségek lehetnek [62].
2.7. A HCV globális epidemiológiája
Amerikai Egyesült Államok a világ harmadik legnépesebb országának számít, 313 millió lakosával, ami a világ népességének körülbelül 4,47% -át fedi le. Egy 21 214 országosan reprezentatív mintán végzett vizsgálat szerint a HCV szeroprevalenciája 1,8% volt [55], [65]. Indonéziát a negyedik legnépesebb országként tartják számon, körülbelül 237 millió emberrel, ami a világ népességének körülbelül 3,39% -át fedi le. A 7 572 önkéntes véradón végzett tanulmány szerint a HCV szeroprevalenciája 2,1% volt [65], [68]. Brazília a világ ötödik legnépesebb országának számít, amelynek 192 millió lakosa van, ami a világ népességének 2,74% -át fedi le. 66 414 önkéntes véradóval végzett vizsgálat szerint a becsült HCV prevalencia körülbelül 1,1% volt [65], [69]. Pakisztán a világ hatodik legnépesebb országa, hozzávetőlegesen 179 millió lakossal, amely a világ népességének 2,56% -át fedi le. Khattak és mtsai. 103 858 önkéntes véradóval végzett vizsgálatot, arról számoltak be, hogy a HCV szeroprevalenciája 4% volt [65], [70]. Ezért a világ hat legnépesebb nemzetében a HCV-fertőzések elterjedtsége alapján Pakisztánra a legmagasabb HCV-előfordulású országként lehet következtetni a világ többi legnépesebb nemzete között.
A vírusos májgyulladást a világon egyre inkább súlyos egészségügyi problémáknak ismerik el. Ez az áttekintés átfogó információkat nyújt a jövőben értékes kutatási projektek lebonyolításához szükséges HBV és HCV régiókról. Sok erőfeszítésre van szükség a HBV és a HCV teljes felszámolásához ebből a világból, mint a világból (évtizedekkel ezelőtt) felszámolt korábbi apró himlő vírus patogén és a gyermekbénulás vírus, amelyet a közeljövőben felszámolnak a világból. Közismert tény, hogy világszerte minden tizenkettő fertőzött vírusos májgyulladással. Rohamos proliferációja, a vírus kvázifajok és a megnövekedett vírus okozta mortalitások. Várható, hogy a hepatitis vírus hamarosan a legveszélyesebb vírus kórokozóvá válik. A HCV prevalenciája sajnos napról napra növekszik a fejlődő országokban, mivel az általános lakosság körében kevés a tudatosság. A mai napig egyetlen HCV-vakcina sem készült sikeresen, ezért még mindig sok erőfeszítésre van szükség a betegség globális terheinek csökkentése érdekében. A HCV jövőbeli terheinek megelőzésének legfontosabb módja a közegészségügyi szakemberek által kidolgozott prevenciós stratégiákon keresztüli tudás és tudatosság.
Megjegyzések
Hozzászólások
Háttér
A HBV és a HCV a krónikus vírusos hepatitis legfontosabb oka. Világszerte ezer halálesetért felelősek a vírusfertőzéssel összefüggő végstádiumú májbetegségek miatt. Tehát a krónikus hepatitis B és C komoly egészségügyi probléma, és megelőző stratégiákat kell végrehajtani, valamint terápiákat kell alkalmazni a krónikus fertőzések felszámolására HCV esetén, vagy a vírusreplikáció elnyomásának fenntartására HBV esetén.
Kutatási határok
Ez a cikk összefoglal néhány epidemiológiai információt a világ HBV- és HCV-fertőzéséről. A HCV genotípusok osztályozásáról azonban megtévesztő információkat közölnek, például 11 genotípusba sorolást. Ezenkívül a szerzők nem is említik az új Boceprevir és Telaprevir vírusellenes gyógyszereket, amelyeket az 1. genotípusú HCV krónikus fertőzés kezelésére engedélyeztek. Megértettem, hogy a vírusellenes terápia nem a jelen téma középpontjában áll, de mivel a szerzők megemlítik az IFN-ribavarin kezelést, nem hagyhatják figyelmen kívül az új terápiákat.
Kapcsolódó jelentések
Ezekről a témákról évente több áttekintés és konkrét cikk jelenik meg. Például Stroffolini: Emésztési és májbetegségek című tanulmánya, 2005, frissített információkat közöl a HBV előfordulásáról Olaszországban.
Alkalmazások
A HBV és a HCV epidemiológia ismerete segít az egészségügyi hatóságoknak megelőző intézkedések végrehajtásában a krónikus vírusos hepatitis e két fontos oka elleni küzdelemben.
Peer review
Összességében a cikk tájékoztató jellegű, és értékes információkat nyújt a HBV és a HCV epidemiológiájáról és genomiális szervezetéről. A helyes genotípus-meghatározás fontosságának részleteivel tovább kell foglalkozni, mivel a HCV genotípusok eltérően reagálhatnak az antivirális terápiára.
Lábjegyzetek
Összeférhetetlenségi nyilatkozat: Kijelentjük, hogy nincs összeférhetetlenségünk.
- Hepatitis C vírus transzmisszió - vírusos hepatitis és májbetegség
- Kiwi Helix Feeder Review Egészséges táplálkozás bárhol Riding Warehouse Blog
- Az alacsony zsírtartalmú étrend nem a leghatékonyabb a hosszú távú fogyásban A kutatók szisztematikus felülvizsgálatot végeznek
- A kaviárért érdemes megtenni 2020-as áttekintésünket
- A Macro Greens Review dózisa kulcsot jelent az egészség javításához