A hosszú távú cigarettafüst-expozíció és a magas zsírtartalmú étrend kombinálásának káros metabolikus hatásai egerekben
Absztrakt
világszerte 1,1 milliárd felnőtt és a gyermekek 10% -a túlsúlyosnak vagy elhízottnak számít (28). A túlsúly a hatodik legfontosabb kockázati tényező, amely hozzájárul a betegség teljes terheihez. A túlsúly és az elhízás számos anyagcsere-betegségre hajlamosító tényező, beleértve a 2-es típusú cukorbetegséget, az epehólyag-betegséget, az alkoholmentes zsírmájat, a steatohepatitist, a magas vérnyomást, a szív- és érrendszeri betegségeket, valamint a túlsúlyos rák egyes formáit (8). Felmerült (36), hogy a nem megfelelő étrend és a fizikai inaktivitás hamarosan felválthatja a dohányzást, mint az elkerülhető halál fő okát. Emberi vizsgálatok (10) azonban kimutatták, hogy a dohányzás maga a hasi vagy központi elhízás kialakulásához kapcsolódik.
Világszerte a férfi felnőttek körülbelül egyharmada és minden ötödik tizenéves dohányzik, a dohányzással összefüggő betegségek pedig minden tíz felnőtt életét veszélyeztetik; az előrejelzések szerint 2030-ra ez egy hatra nő, ha a jelenlegi tendencia folytatódik (55). A csökkent étvágy és a testsúly a cigarettázás egyik fő motívuma, különösen a fiatal nők körében (2, 9, 23). A dohányzás abbahagyása utáni súlygyarapodás megakadályozza az embereket abban, hogy felhagyjanak a dohányzással, mivel a volt dohányosok több mint 75% -a hízik a leszokás után. A leszokást követő súlygyarapodás elsősorban a kalóriabevitel növekedésének, elsősorban a magas zsír- és cukortartalmú snackek fogyasztásának, az energiafelhasználás csökkenésének és a lipidfelhalmozódás növekedésének köszönhető (20, 25).
A cukorbetegséggel és a szív- és érrendszeri megbetegedésekkel járó egészségügyi kockázatokat a dohányzás növelheti, mivel a dohányosok csökkent magas sűrűségű lipoprotein-koleszterint, magasabb triglicerid-koncentrációt és megnövekedett proinflammatorikus (pl. TNF-α, IL-6) és prokoaguláns markert mutatnak (4, 21, 22, 31). A jelenlegi erős dohányosoknál azonban alacsonyabb halálozási arányról számoltak be (43) a túlsúlyos, de nem elhízott személyeknél, azokhoz képest, akik soha nem dohányoztak. Ezenkívül az elhízást a közelmúltban felismerték a gyulladásos légúti megbetegedések kockázati tényezőjeként (15, 35). A TNF-a elhízott egyéneknél inzulinrezisztenciát okoz az inzulinreceptorok szignalizációjának megzavarásával, ami részben az adiponektin szekréció gátlásának és a csökkent glükóz transzporter GLUT4-nek tudható be (47, 50). A keringő IL-6 nagy része zsírszövetből származik, és a szintek korrelálnak az éhomi plazma glükózszintjével és az inzulinrezisztenciával (5). A zsírsavak triglicerid raktáraiból történő zsírsavak mobilizálásához lipolitikus enzimekre van szükség. A zsír-triglicerid-lipáz (ATGL) az egyetlen enzim, amelyről ismert, hogy mind a fehér, mind a barna zsírszövetben expresszált triglicerideket hidrolizál (58).
Állatok.
A cigarettafüst-expozíciót követő légzőszervi megbetegedések kialakulásának törzsfüggősége miatt (53) ehhez a kísérlethez hím Balb/C egereket választottak. Az egereket (5 hetes korban) az Animal Resource Center-től (Perth, Ausztrália) szereztük be, 20 ± 2 ° C-on steril mikroizolátor ketrecekben tartottuk, és 12: 12-órás világos-sötét ciklusban tartottuk (világítás 0600-kor) . 1 hétig hagyták alkalmazkodni új környezetükhöz, ad libitum hozzáféréssel a szokásos laboratóriumi chow-hoz és vízhez. Az állatokat naponta ellenőriztük. A jelenlegi vizsgálatot a Melbourne-i Egyetem állatkísérleti etikai bizottsága hagyta jóvá.
Kezelés.
Az akklimatizálódás után az egereket véletlenszerűen négy, hasonló átlagos testtömegű csoportba osztották: ál-kitett etetett csaj (színlelt + csaj), ál-kitett táplált HFD (színlelt + HFD), füstnek kitett táplált chow (se + csaj) és se táplált HFD (se + HFD). A füst hatására az állatokat egy 18 literes perspex kamrába helyeztük, és két cigaretta (Winfield Red, ≤16 mg kátrány, ≤1,2 mg nikotin és ≤15 mg szén-monoxid) által előidézett füstnek tettük ki; Philip Morris (Melbourne, Ausztrália) naponta kétszer (1030 és 1630), 6 nap/hét 7 hétig (53). A látszatnak kitett állatokat azonos módon kezelték, de nem voltak kitéve cigarettafüstnek. Az egerek vagy laboratóriumi chow-t (3,54 kcal/g, 12% zsír, 22% fehérje, 66% szénhidrát; chow-táplált kohorsz) vagy HFD-t fogyasztottak [4,32 kcal/g, 32% zsír (17% telített zsír), 18% fehérjét, 50% szénhidrát; HFD-táplált kohort], amely módosított laboratóriumi chow-ból áll, amely édesített sűrített tejet és sertészsírt tartalmaz, amelyet nagyon ízletes cafeteria stílusú ételekkel egészítettek ki, például húsos pitékkel, süteményekkel és kekszekkel (26, 27, 39). Friss ételeket biztosítottak napi 1700-kor. A testtömeget és a 24 órás kalóriabevitelt kétszer/hét mértük.
Minta kollekció.
A kísérlet végén a szöveteket 0900 és 1100 között gyűjtötték be. Az állatok utoljára kamra- vagy cigarettafüstnek voltak kitéve a boncolás előtti napon, 1630-ban. Az egereknek érzéstelenítő túladagolást kaptak (ketamin-xilazin, 180: 32 mg/kg ip), vért gyűjtöttek a hasi vena cava-ból, majd az egereket lefejezték agy- és szövetgyűjtés céljából. A boncolást megelőzően a naso-anális (N-A) és a sípcsont hosszát rögzítettük. A Lee indexet testtömeg (g 0,33)/N-A hossz (mm) formájában számoltuk. Körülbelül 10 μl vért használtak fel a vércukorszint (Accu-Chek Advantage glükózmérő; Roche Diagnostics, Castle Hill, NSW, Ausztrália) és a karboxihemoglobin (CoHb) (54) mérésére. Az elválasztott plazmát -80 ° C-on tároltuk a plazma leptin, inzulin, kortikoszteron és NPY későbbi meghatározásához.
A BAT-t és az RpWAT-ot gyorsfagyasztottuk folyékony nitrogénben, majd -80 ° C-on tároltuk az UCP1, UCP3, TNF-a, IL-6 és ATGL mRNS-jének későbbi mérése céljából. A máj egy részét 10% -os formalinban rögzítettük a hemotoxilin és az eozin (HE) festésére.
A májszakaszok HE festése.
Mindegyik egér bal és középső májkaréjának metszeteit formalinba helyeztük. A mintákat egy éjszakán át feldolgoztuk osztályozott etanolokon keresztül, és paraffin viaszba ágyazottuk. A rögzített szöveteket ezután deparaffinizáltuk és rehidratáltuk. A magokat Harris hemotoxilinnel, a sejtek citoplazmáját pedig eozinnal festettük. A máj zsíros változását egy, a kezelési csoportokra vakon figyelő megfigyelő osztályozta, a foltos szakaszokon jelen lévő fehér vakuolák mennyiségének és méretének felmérésével (0 = normál, 1 = lipid vakuoluol jelen voltak a hepatocitákban, és 2 = megnövekedett vakuolák jelen voltak a hepatocytákban). ). Ezután kiszámították az egyes kezelési csoportok osztályzatainak átlagát.
Valós idejű PCR.
A teljes RNS-t a WAT-ból és a BAT-ból izoláltuk RNeasy kit (Qiagen, Valencia, CA) felhasználásával, a gyártó utasításainak megfelelően. A tisztított teljes RNS-t templátként használtuk az első szálú cDNS-szintézis előállításához SuperScript III (Invitrogen, Carlsbad, CA) alkalmazásával. Az előre optimalizált és validált alkalmazott Biosystem szondát/primereket használtuk a kvantitatív valós idejű PCR-hez (ABI 7900 HT Sequence Detection System; Applied Biosystems, Foster City, CA) (7). Így a génexpressziót egyetlen multiplexelő reakcióban számszerűsítettük, ahol a kérdéses génünket (UCP1, UCP3, TNF-a, IL-6 és ATGL) standardizáltuk a kontroll (18s rRNS) ellenőrzésére. Ezután a kontroll ál-csoport egyedi BAT-mintáját önkényesen rendeltük kalibrátorként, amelyhez viszonyítva az összes többi mintát ötszörös különbségként fejeztük ki (7).
Vizsgálatok.
A különféle agyrégiókból származó endogén NPY-t ecetsavval extraháltuk. Az agyban és a plazmában az NPY-szerű immunreaktivitást radioimmun vizsgálattal mértük, standard szintetikus NPY-t használva (10–1 280 pg/cső; Auspep, Victoria, Ausztrália), az előzőekben leírtak szerint (41). A detektálási határ a radioimmunassay-nél rutinszerűen 2 pg NPY/cső volt, az intra- és az interay vizsgálati variációs együtthatók pedig 6, illetve 13% voltak. Az NPY-t nanogramm NPY-ként fejezzük ki szövetek milligrammjában az egyes agyi régiókban és nanogrammokban NPY-t a hipotalamuszban. A plazma leptin-, inzulin- és kortikoszteron-koncentrációkat kereskedelemben kapható radioimmunoassay-készletek (leptin és inzulin; Linco, St. Charles, MO és kortikoszteron; MP Biomedicals, Irvine, CA) alkalmazásával mértük. A plazma trigliceridet glicerin standard (0–8,46 mM trigliceridnek felel meg; Sigma, St. Louis, MO) és triglicerid reagens (Roche, Nutley, NJ) alkalmazásával mértük. Röviden, a mintákat és a standardokat triglicerid reagenssel inkubáltuk 37 ° C-on 20 percig, és mikrolemez-olvasón (Bio-Rad 680XR) 492 nm-en olvastuk.
statisztikai elemzések.
Az eredményeket átlag ± SE értékben fejezzük ki. A testsúlyt és a kalóriabevitelt idővel egyirányú varianciaanalízissel (ANOVA) elemeztük, ismételt mérésekkel, majd post hoc Fisher legkevesebb szignifikancia különbségtesztjeivel. A zsír- és szervtömeg, a vér és a plazma kémiai koncentrációinak, az agy NPY-koncentrációjának és -tartalmának, valamint a zsír mRNS-expressziójának különbségeit kétirányú ANOVA alkalmazásával, majd post hoc Bonferroni tesztekkel elemeztük. A vér CoHb különbségét a Student párosával elemeztük t-teszt. A máj HE festési pontszámának különbségét Wilcoxon jel-rang teszt segítségével elemeztük.
A táplálékfelvétel és a testsúly pályája.
A befutási időszakban a kalóriabevitelben nem volt különbség a kísérleti csoportok között. Röviddel az étkezési beavatkozás megkezdése után a HFD-ben lévő állatok (színlelt + HFD és se + HFD csoportok) nagyobb kalóriabevitellel rendelkeztek, mint a chow-vel etetett állatok (ál + csó és se + csa). A füst expozíció csökkentette a kalóriabevitelt mind a chow-, mind a HFD-vel táplált kohorszokban (1. ábra). A kalóriabevitel csökkenése következett be a chow-étrendben lévő egerekben a füst expozíció első hetében, és a se + chow bevitele alacsonyabbnak tűnt, mint az ál + chow csoport a kísérleti időszakban (1. ábra). Ezzel azonban nem sikerült statisztikai szignifikanciát elérni az ANOVA alkalmazásával, ismételt mérésekkel. A HFD-t fogyasztó állatokban a cigarettafüst-expozíció a kalóriabevitel jelentős csökkenéséhez vezetett a negyedik héttől kezdve, és 7 hét után 36% -os csökkenést figyeltek meg (se + HFD csoport; 1. ábra). A 7 hét kísérleti időszak alatt a HFD 2,29-szeresére növelte az átlagos kalóriabevitelt mind a színlelt, mind a füstnek kitett kohorszokban (P 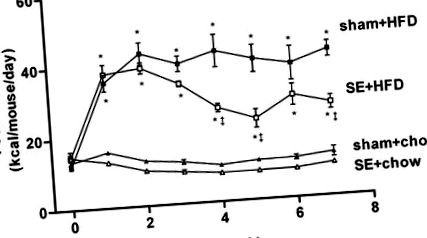
1. ábra.A látszólag kitett chow-táplált (kamu + egér; Cal) kalóriabevitele (kcal · egér -1−24 h -1), n = 16), álterhelésnek kitett, magas zsírtartalmú diétával táplált (HFD) (színlelt + HFD; ▪, n = 16), füstnek kitett (se) chow-táplált (se + chow; ▵, n = 16), és se HFD-vel táplálva (se + HFD; □, n = 16) csoportok a kísérleti időszak alatt. Az eredményeket átlag ± SE értékben fejezzük ki. Az adatokat egyutas ANOVA-val elemeztük, ismételt mérésekkel, majd post hoc legkevésbé szignifikáns különbség (LSD) tesztekkel. *P
Asztal 1. Testtömeg, táplálékfelvétel, szerv- és zsírtömeg, valamint egerek hossza
Az eredményeket átlag ± SE-ben fejezzük ki; n = 16 ál-kitett chow-táplált (színlelt + chow), ál-kitett nagy zsírtartalmú étrend-táplált (HFD) (ál + HFD), füstnek kitett (se) chow-táplált (se + chow) és se esetében HFD-vel táplált (se + HFD) egerek. BAT, barna zsírszövet; RpWAT, retroperitoneális fehér zsírszövet; N-A, naso-anális. Az adatokat kétirányú ANOVA-val elemeztük post hoc Bonferroni tesztekkel.
* P ‡ P 0,33)/N-A hosszúság (mm).
Az összes csoport testtömege jól megfelelt a kísérlet elején (2. ábra). Az ál-chow állatok testtömegük 30% -ot nyert a kísérlet során. A testtömeg a HFD-vel szignifikánsan megnőtt mind az ál + HFD, mind a se + HFD csoportokban. A HFD nettó súlygyarapodási hatása nagyobb volt a cigarettafüstnek kitett állatoknál (2. ábra). A testsúlygyarapodás a cigarettafüst-expozíció első hetében csökkent mind a se + chow, mind a se + HFD csoportokban, és ez a kísérlet végéig jelentős maradt (P
2. ábra.A színlelt + chow testtömege (▴, n = 16), színlelt + HFD (▪, n = 16), se + chow (▵, n = 16), és se + HFD (□, n = 16) csoportok a kísérleti időszak alatt. Az eredményeket átlag ± SE értékben fejezzük ki. Az adatokat egyutas ANOVA-val elemeztük, ismételt mérésekkel, majd post hoc LSD tesztekkel. *P
Testtömeg és szerv súlya halálakor.
7 hetes korban a színlelt + HFD csoport testtömege 8% -kal volt nagyobb, mint a színlelt + chow állatoké (P
2. táblázat. Vércukorszint, plazma leptin, inzulin, kortikoszteron és NPY koncentráció egerekben
Az eredményeket átlag ± SE-ben fejezzük ki; n = 16. NPY, Y neuropeptid. Az adatokat kétutas ANOVA-val elemeztük, post hoc Bonferroni tesztekkel.
* P ‡ P
3. ábra.A zsírszövet-triglicerid-lipáz (ATGL) mRNS-expressziója fehér (WAT) és barna zsírszövetben (BAT) színlelt + chow (nyitott oszlopok), ál + HFD (szürke oszlopok), se + chow (kikötött oszlopok) és se + HFD (fekete sávok) csoportok 7 héten belül. Az eredményeket a kontroll BAT mintához viszonyított szeres különbségként és ± ± SE átlagként fejezzük ki. Az adatokat kétutas ANOVA-val elemeztük, amelyet post hoc Bonferroni teszt követett. *P
3. táblázat. Az UCP1 és az UCP3 mRNS-expressziója BAT-ban, TNF-α és IL-6 WAT-ban 7 hét múlva
Az eredményeket a kontrollmintához viszonyított szeres különbségként és ± ± SE átlagként fejezzük ki; n = 4. UCP1 és -3, az 1. és 3. fehérje szétkapcsolása. Az adatokat kétutas ANOVA-val elemeztük.
Agy NPY koncentrációja és tartalma.
Az ál-kitett kohorszon belül a PVN-ben és az AH-ban az NPY-koncentráció szignifikánsan 14, illetve 16% -kal csökkent a HFD-t fogyasztó állatokban (P
4. ábra.Az agy neuropeptid Y-szerű immunreaktivitása (NPY-LI; ng/mg szövetben kifejezve) az ál + chow-ban (nyitott rudak; n = 16), színlelt + HFD (szürke sávok; n = 16), se + chow (rácsos rudak; n = 16), és se + HFD (fekete sávok; n = 16) csoportok 7 héten belül. A bemutatott területek a paraventrikuláris mag (PVN), az elülső hipotalamusz (AH), az íves mag (ARC), a hátsó hipotalamusz (PH), a medulla (Med) és az amygdala (AMYG). Az eredményeket átlag ± SE értékben fejezzük ki. Az adatokat kétutas ANOVA-val elemeztük, majd post hoc Bonferroni tesztekkel. *P
Így a füst expozíció részben visszafordította a hipotalamusz NPY peptidjének csökkenését a HFD-re adott válaszként (5. ábra), amint azt a teljes hipotalamusz NPY-tartalma tükrözi, amely az ál + HFD állatokban szignifikánsan csökkent a színlelt + chow csoporthoz képest (P
5. ábra.Az összes hipotalamusz NPY-LI a színlelt + chow-ban (nyitott sávok; n = 16), színlelt + HFD (szürke sávok; n = 16), se + chow (rácsos rudak; n = 16), és se + HFD (fekete sávok; n = 16) csoportok 7 héten belül. Az eredményeket átlag ± SE értékben fejezzük ki. Az adatokat kétutas ANOVA-val elemeztük, amelyet post hoc Bonferroni teszt követett. *P
A fejlett világban a dohányzást és az elhízást általában a legfontosabb módosítható tényezőként ismerik el a népesség szintjén a túlzott halálozásért. Ez az egész életen át bekövetkezik, és az inzulinrezisztenciához kapcsolódó kardiovaszkuláris kockázat nagyobb gyakoriságot figyelt meg a fiatal dohányosoknál, mint a nemdohányzóknál (49). Az elhízás és a cigarettázás is fontos kockázati tényező számos, az életkorral összefüggő betegségben, felgyorsítva az öregedési folyamatokat az oxidatív stressz és a gyulladás fokozásával (51). Feltételezik (32, 52), hogy a hosszan tartó dohányzóknál általában megfigyelt krónikus obstruktív tüdőbetegséggel összefüggő fogyás tulajdonképpen a sovány testtömeg-veszteségnek tudható be. Ez a tanulmány először vizsgálta e két káros viselkedés, a cigarettázás és az energiasűrű, magas zsírtartalmú étrend fogyasztásának együttes hatásait.
A füstnek való kitettség csökkentette a lineáris növekedést az étrend típusától függetlenül, míg a HFD-táplálás megnövelte a testhosszat mind az ál-, mind a füst által kitett állatokban. A cigarettafüst-expozíció a Lee-index alapján csökkentette az állattáplálékkal táplált állatok zsírtartalmát is, és ezt HFD-etetés fordította meg. A HFD által kiváltott elhízás káros hatásainak csökkentése helyett a füst expozíció csökkentette a súlygyarapodást anélkül, hogy jelentősen csökkentené a zsírtömeget a vizsgált régiókban. A HFD-vel táplált állatoknál a dohányzás sem csökkentette a vércukorszintet. A chow füstnek kitett egerek alacsonyabb testtömegével lényegesen kisebb zsír- és szervtömeg, valamint alacsonyabb plazma leptin- és inzulinkoncentráció kísérte, míg a hiperfágia, a zsír felhalmozódása, a hiperleptinémia és a hiperglikémia volt jelen a füstnek kitett egerekben, akik a HFD rokonát fogyasztották. az egerek ellenőrzésére.
- A nagyon alacsony kalóriatartalmú étrend hatása a testösszetételre, az anyagcsere-állapotra és a gének kifejeződésére a
- A COVID-19 és a metabolikus szindróma lehet a diéta a legfontosabb BMJ bizonyítékokon alapuló orvoslás
- A divatos diéta előnyei és hátrányai A divatos diéták pozitív hatásai és hátrányai
- A bél mikrobiotájának változásai a magas zsírtartalmú étrendben táplált patkányokban korrelálnak az elhízással összefüggő anyagcserével
- Változások a bél mikrobiota-szabályozásában Metabolikus Endotoxemia által kiváltott gyulladás nagy zsírtartalmú