III. Típusú glikogénmegőrző betegség: a módosított Atkins-diéta javítja a myopathiát
Sebene Mayorandan
Gyermekkori vese-, máj- és anyagcsere-betegségek klinikája, Carl-Neuberg-Str.1, D-30625 Hannover, Németország
Jelenlegi cím: Münster Egyetemi Kórház Gyermekgyógyászati Osztály, Albert-Schweitzer-Campus 1, D-48161 Münster, Németország
Uta Meyer
Gyermekkori vese-, máj- és anyagcsere-betegségek klinikája, Carl-Neuberg-Str.1, D-30625 Hannover, Németország
Hans Hartmann
Gyermekkori vese-, máj- és anyagcsere-betegségek klinikája, Carl-Neuberg-Str.1, D-30625 Hannover, Németország
Anibh Martin Das
Gyermekkori vese-, máj- és anyagcsere-betegségek klinikája, Carl-Neuberg-Str.1, D-30625 Hannover, Németország
Absztrakt
Háttér
A szénhidrátban gazdag ételekkel való folyamatos takarmányozás vagy a folyamatos enterális táplálás a választott terápia volt a III-as típusú glikogén-tároló betegségben (Glycogenosis). A diagnózisra és kezelésre vonatkozó legújabb irányelvek azt javasolják, hogy gyakran etessenek magas komplex szénhidrátot vagy kukoricakeményítőt, elkerülve a gyermekek éhezését, míg felnőtteknél alacsony szénhidráttartalmú, magas fehérjetartalmú étrend ajánlott. Noha ez a kezelés megakadályozhatja a gyermekek hipoglikémiáját, nem javítja a csontváz és a szívizom működését, amely veszélybe kerül a IIIa glikogenózisban szenvedő betegeknél. A szénhidrátok beadása reaktív hiperinzulinizmust válthat ki, ami a lipolízis, a ketogenezis, a glükoneogenezis elnyomását és a glikogénszintézis aktiválódását eredményezheti. Így a szív és a vázizomzat kimerül az energia szubsztrátjaiból. A módosított Atkins-diéta a ketontestek és a zsírsavak fokozott vérszintjéhez vezet. Feltételezzük, hogy ez az egészségügyi beavatkozás javítja az izmok energetikai egyensúlyát.
Mód
Két 9 és 11 éves glycogenosis IIIa fiút kezeltünk módosított Atkins-diétával (napi 10 g szénhidrát, fehérje és zsírsavak ad libitum) 32, illetve 26 hónapon keresztül.
Eredmények
Mindkét betegnél a kreatin-kináz szintje a vérben csökkent az Atkins-diéta hatására. Amikor az egyik betegnél visszavonták az étrendet, mellkasi fájdalomra panaszkodott, csökkent fizikai erő és a kreatin-kináz szintje gyorsan növekedett. Ezt megfordították, amikor Atkins diétát bevezették. Egy beteg súlyos kardiomiopátiában szenvedett, amely étrend alatt jelentősen javult.
A IIIa glycogenosisban szenvedő betegek javíthatják a szív és a vázizomzat energetikai állapotát azáltal, hogy Atkins diétát vezetnek be mind biokémiai, mind klinikai szinten. Az átmeneti hipoglikémián kívül nem figyeltek meg súlyos mellékhatásokat.
Háttér
A III. Típusú glikogéntároló betegség (GSD III) egy örökletes anyagcsere-betegség, amelyet a glikogén leágazó amil-1,6-glükozidáz enzim hiánya okoz, és abnormális glikogén („limit dextrin”) felhalmozódását eredményezi.
A GSD III két klinikai típusa ismert:
GSD IIIa máj és izom érintettséggel és GSD IIIb csak máj érintettséggel [1,2].
A GSD IIIa-ban a kardiomiopátia jelentős morbiditáshoz vezethet [3–5].
A hipoglikémia megelőzhető szénhidrátban gazdag ételek gyakori etetésével, folyamatos enterális táplálással vagy nyers kukoricakeményítő beadásával [6–8]. Ez a kezelés nem javítja a szív és a vázizom működését [9]. A szívműködési zavarokat tüneti módon kezelik. A legújabb tanulmányok egy fehérjében gazdag étrendet támogattak [10–12], amelyet keton testekkel is kiegészítettek [9]. Javasolták még a GSD III enzimpótló kezelését is, amely alátámasztja a hatékony kezelés kielégítetlen igényét [13]. Krishnani és mtsai. közzétett iránymutatások a GSD III diagnózisáról és kezeléséről, amelyek támogatják az éhezés, a magas komplex szénhidráttartalmú gyakori takarmányozás megelőzését vagy a kukoricakeményítő beadását gyermekeknél, míg a felnőtteket alacsony szénhidráttartalmú, magas fehérjetartalmú étrend kezelheti [14].
Míg a szénhidrátban gazdag étrend megakadályozza az éhgyomri hipoglikémiát, a legtöbb esetben a csontváz és a szívizom energia kimerüléséhez vezethet a következő mechanizmus révén: A magas szénhidráttartalmú ételek beadása reaktív hiperinzulinizmust vált ki a lipolízis, a ketogenezis, a glükoneogenezis későbbi visszaszorításával és a glikogénszintézis [15]. Így a zsírsavak, a keton testek és a glükóz mint a vázizom és a szív üzemanyaga kimerült.
Az inzulin szekréciójának elnyomása kívánatosnak tűnik a GSD IIIa-ban, azonban az egyszerű hipokaloros katabolizmus hipoglikémiát eredményez. Az eukalórikus ketogén étrend a ketontestek vérszintjének emelkedését eredményezi, mint alternatív szubsztrát az agy számára. Ugyanakkor a megemelkedett ketontestek és zsírsavak energiaszubsztrátumokként szolgálnak a szív [16] és a vázizmok számára. Így javul az izmok energetikai egyensúlya. A klasszikus ketogén étrend betartását gyakran gátolja az íztelenség, valamint a zsír, valamint a fehérje és a szénhidrát bevitel arányának kiszámításának szükségessége, amely állítólag 4 (3): 1. A megfelelés javítása érdekében javasoljuk egy módosított Atkins-diéta (MAD) alkalmazását, ahol a napi szénhidrát-bevitel 10 g-ra korlátozódik, miközben szabad a fehérjéhez való hozzáférés és a zsírbevitel ösztönzése.
Beszámolunk 2 fiú GSD IIIa kezeléséről a MAD által.
Mód
1. beteg
A Srí Lanka-i kivonulás fiú 9 éves volt a MAD kezdeményezésére. Motoros retardáció, myopathia és hepatomegalia miatt 7 hónapos korában diagnosztizálták GSD III-at.
Kezdetben megemelkedett májenzimek (ALT 711 U/l, AST 733 U/l és y-GT 52 U/l) és megnövekedett kreatin-kináz aktivitás (CK) volt a szérumban (514 U/l). A páciens ismételt hypoglykaemia-epizódokat szenvedett, minimális 0,1 mmol/l vércukorszinttel. A GSD III-t az amiloglükozidáz aktivitás hiánya gyanította és erősítette meg a vérsejtekben. A vörösvérsejtekben a megemelkedett glikogénkoncentráció 20 mg/dl (normális tartomány 0-10 mg/dl) összhangban volt ezzel a diagnózissal. A mutációanalízis homozigozitást mutatott a c.4256dupC mutációra. Az echokardiográfia enyhe hipertrófiás kardiomiopátiát mutatott ki.
A beteget kezdetben intravénás glükózinfúzióval kezelték, majd a maltodextrint éjszakai folyamatos enterális táplálással adták be, a hipoglikémia megelőzése érdekében 7–9 mg/kg/perc sebességgel. A vércukorszint stabilizálását végül egy főtt kukoricakeményítővel végzett étrendi kezeléssel értük el, amelyet az emésztőenzimek éretlensége miatt 6–8 hónapos kor előtt nem lehet használni. A következő években folytatták az éjszakai szénhidrát- és fehérjében gazdag ételek, valamint a nyers kukoricakeményítő etetését.
Ez a klasszikus étrend stabilizálta a plazma glükózszintjét, de az echokardiográfiai követés a bal kamra és a szeptum hipertrófia, valamint a bal kamra kiáramló traktus obstrukciójának (LVTO) progresszióját mutatta verapamillal történő kezelés alatt. A kamrai septum falvastagsága 1,4 cm-re, az LVOT-gradiens pedig 20 Hgmm-re nőtt. Az EKG (elektrokardiográfia) a biventricularis hypertophia és az abnormális repolarizáció jeleit tárta fel az ST-szegmensek emelkedésével (0,5 mV). A fiú sérült fizikai képességet mutatott, kezdeti nehézségekkel lépcsőzni. Az iskolai sporttevékenységek nagyon korlátozottak voltak; alig tudott megszakítás nélkül 100 méteres távolságot megtenni. A szérumban folyamatosan emelkedett CK-szint (akár 5300 U/l) több év alatt jelentős izom-érintettséget jelzett.
A kardiomiopátia gyors előrehaladtával kipróbáltunk egy fehérjében gazdag étrendet, napi 3 g/kg fehérjetartalommal (a teljes energiafogyasztás 19% -a). A kardiomiopátia azonban tovább fejlődött.
2. beteg
A második beteg egy iráni származású fiú volt, aki 11 éves volt a MAD kezdetekor. Kora gyermekkorban ismétlődő hypoglykaemia epizódok fordultak elő. A fiú lassulást mutatott a növekedés és a motor fejlődésében. 10 éves korában súlyos izomzavarral kórházunkba utalták. Nem volt lehetséges sporttevékenység, és a fiúnak még az izomgyengeség miatt is nehézségei voltak a lépcsőzésre. Sőt, a testmozgást követő mellkasi fájdalomra és az ismétlődő hányingerre panaszkodott. A vörösvértestekben megemelkedett a glikogén koncentráció (23 mg/dl, normál tartomány: 0–10 mg/dl), az amiloglükozidáz aktivitás hiánya a vörösvértestekben megerősítette a GSD III diagnózisát. A fiú homozigóta volt a c.753_756del mutációval szemben. A kezdeti szívvizsgálatok kisebb koncentrikus hipertrófiás kardiomiopátiát tártak fel megnyúlt QTc idővel.
Módosított Atkins-diéta
A betegeket a módosított Atkins-diéta kezdete miatt 7–14 napig kórházba helyezték. Ez lehetővé tette a betegek szoros nyomon követését, valamint a betegek és családjaik átfogó étrendi képzését. A MAD alacsony szénhidráttartalmú ételekből állt, összesen napi 10 g szénhidráttal. A családok cseretáblákat kaptak a tápanyagbevitel durva becsléséhez, és javasoltak speciális, alacsony szénhidráttartalmú ételeket. A betegeket arra ösztönözték, hogy zsírban és fehérjében gazdag ételeket fogyasszanak, például húst, halat, tojást, diót ad libitum. A vitaminokat és az ásványi anyagokat az étrendi ajánlásoknak megfelelően pótolták. A klasszikus ketogén étrendhez képest a MAD-ot könnyebb megvalósítani a mindennapi életben, mivel a zsír- és fehérjebevitelt nem kell kiszámítani, ami megkönnyíti a megfelelés betartását. A ketogén étrendben a zsír, a fehérje és a szénhidrát 4: 1 vagy 3: 1 arányát kell követni, amely magában foglalja a zsír, fehérje és szénhidrát bevitel kiszámítását. Míg a kereskedelemben kapható tápszeres tápszerek megkönnyíthetik a csecsemők mindennapi életét az élet első néhány hónapjában, az idősebb gyermekeknél nehezebb megfelelni.
A MAD bevezetését követő első hetekben alkalmi tünetmentes hipoglikémia fordult elő, ezért a főtt kukoricakeményítőt folytatni kellett. Az 1. betegnél az éjszakai nyers kukoricakeményítő lassan csökkenthető 5 hónap alatt, majd abbahagyható, a 2. beteg csak két hónapig kapott főzetlen kukoricakeményítőt.
Mindkét beteget ambuláns klinikáinkon követték (1: 32 hónapos betegek, 2: 26 hónapos betegek a MAD megkezdése után), és 3–6 havonta látták őket.
Az anyagcsere állapotának és a terápiának való megfelelés értékeléséhez 3-6 havonta a következő paramétereket rögzítették: keton testek a plazmában és a vizeletben, CK-szintek a szérumban, májfunkció, acilkarnitin profil, aminosavak a plazmában, lipidek és glükóz a szérumban. A szívvizsgálatokat echokardiográfiával és elektrokardiográfiával végezték 3-6 havonta. Otthon a szülők dip bot teszteléssel figyelték a vizeletben lévő ketontesteket.
Míg az 1. beteg családjának nem okozott problémát a MAD-hoz való ragaszkodás, a 2. beteg családja úgy döntött, hogy 3 hónap után abbahagyja a MAD-t, és átállt a hagyományos főzésre. A 2. beteg és családja a nyelvi nehézségek és a betegség megértésének hiánya miatt nem volt megfelelő. Sok (pszicho-) szociális probléma volt, mivel a család menekült státusszal rendelkezett. A következő hónapokban meg tudtuk győzni a családot a MAD folytatásáról.
Eredmények
A MAD diétás kezelése jól tolerálható volt, az átmeneti hipoglikémia kivételével. Az 1-es beteg szénhidrátfogyasztása a napi 10 g/kg-ról a 0,4 g/kg-ra csökkent MAD alatt, a fehérjebevitel napi 3 g/kg-ról napi 7 g/kg-ra nőtt, míg a zsírbevitel 1,6 g/kg/kg-ról napi 8 g/kg-ig. A 2. betegben a szénhidrátbevitel MAD alatt napi 0,5 g/kg, a zsírbevitel 6 g/kg naponta és a fehérje bevitel 5 g/kg naponta. A MAD bevezetése előtt ebben a betegben nem végeztek étrendi értékelést. Mindkét betegnél a DACH (német-osztrák-svájci táplálkozási szövetség) szerinti étrendi ajánlások teljesültek, a MAD során az étrendi protokollok alapján.
1. beteg
Az alapvető laboratóriumi és echokardiográfiai paramétereket az 1. táblázat foglalja össze. A ketontestek plazmakoncentrációja 1,7 és 7,8 mmol/l között mozgott. A vér CK aktivitása a MAD alatt szignifikánsan csökkent. A szívműködés javult az echokardiográfia és az EKG alapján. A bal kamrai kiáramló traktus (LVOT) obstrukciója jelentősen javult; a gradiens a MAD megkezdése előtti 20 Hgmm-ről 5 Hgmm-re csökkent 32 hónapos MAD után, a kamrai septum vastagsága 1,4 cm-ről 0,8 cm-re csökkent ugyanabban az időszakban, miközben a hátsó fal vastagsága állandó maradt (1. táblázat). Ezt a javulást tükrözik az NT-Pro BNP (N-terminális fragmens pro agy natriuretikus peptid) szintek, amelyek nagyon magasak és normalizálódtak a MAD alatt. A MAD előtt az EKG biventrikuláris hipertrófiát és rendellenességeket tárt fel a repolarizáció során, 0,5 mV ST-emelkedéssel. 32 hónapos MAD után a repolarizáció normalizálódott, az ST-eleváció eltűnt, miközben a bal kamrai hipertrófia jeleit továbbra is megfigyelték.
Asztal 1
Laboratóriumi paraméterek és echokardiográfiai vizsgálatok 1. betegen
2. beteg
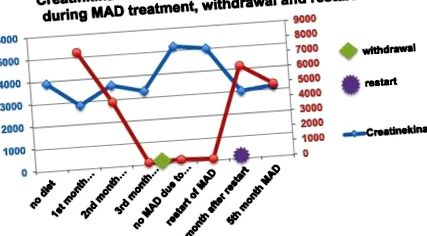
A MAD megemelkedett ketontesteket eredményezett a plazmában, maximum 7,8 μmol/l értékkel. A CK-szint 3895-ről 2846 U/l-re történő csökkenését észlelték két hónap alatt. A testmozgás után jelentkező mellkasi fájdalom és hányinger eltűnt. A fiú nagyobb erőnlétre tett szert. Ezt követően az étrend be nem tartása és a MAD teljes megvonása miatt a ketózis elveszett. A CK-szint 5 192 U/l-re emelkedett. A testmozgás után ismét jelentkezett mellkasi fájdalom, és a fizikai kapacitás csökkenését figyelték meg. A nem megfelelőség miatt nem végezhető szívkövetés.
Amikor a MAD folytatódott, a ketózis gyorsan helyreállt, a CK-szint 4 hét alatt 5 192 U/l-ről 3000 U/l-re csökkent (1. ábra). A mellkasi fájdalom és az izomgyengeség megszűnt.
CK- és keton testszint a 2. betegben.
A hipertrófiás kardiomiopátia eltűnt, az EKG normalizálódott.
A MAD okozta súlyos mellékhatásokat nem figyeltek meg, az LDL-koleszterin és a triglicerid szint normális maradt (az eredményeket nem mutatják be). A súlygyarapodás és növekedés az életkornak megfelelő volt.
Vita
A GSD III-t klasszikusan gyakran szénhidrátban gazdag ételekkel kezelték. Míg ez a terápiás lehetőség megakadályozza a hipoglikémiát, nem javítja az izomzatot [17] és a szívműködési rendellenességeket [18,19], beleértve az aritmiákat [20].
Feltételeztük, hogy a magas szénhidráttartalmú táplálkozásból eredő reaktív hiperinzulinizmus felelős az energiaszubsztrátok (zsírsavak és ketontestek) kimerüléséért a váz- és a szívizomban, majd izomzavarral. Ezenkívül az inzulin megemelkedett szintje aktiválja a glikogénszintázt és elősegíti a glikogén raktározását a miocitákban [15]. Ez súlyosbíthatja a finom energiahiányt, amelyről vitatták, hogy kóros fiziológiai szerepet játszik a glikogenózisokban [21,22].
Terápiás megközelítésünk MAD alkalmazásával mindkét páciensünknél a vázizom és a szív megnyilvánulásainak klinikai javulásához/stabilizálásához vezetett. A plazma CK-szintje, mint az izomdiszfunkció objektív kvantitatív paramétere, a MAD alá esett. Az izomerő mennyiségi vizsgálatát nem végezték el. (Önkéntelen) kereszt-vizsgálatra került sor a 2. páciensnél.
A szívműködés javult az echokardiográfia és az EKG alapján az 1. betegben. A Pro BNP, mint a károsodott szívműködés markere, lenyűgözően javult a MAD alatt. A szívműködés részletes vizsgálatát nem végezték el a 2. páciensnél, mivel a szívműködés nem sérült súlyosan a MAD megkezdése előtt.
Valószínűleg a mögöttes kórélettani mechanizmus a hiperinsulinizmus és következményeinek megelőzése. A napi szénhidrátmennyiség mindkét betegnél alacsony volt, 0,4-0,5 g/kg-nál, ami elegendő az inzulinszekréció elnyomására. Az energia szubsztrátok megfelelő ellátása a MAD alatt pozitívan befolyásolja az izom működését. Ezenkívül ismert, hogy a ketózis aktiválja a szívben a mitokondriális szukcinát-dehidrogenázt, ezáltal javítva az energetikai egyensúlyt [23]. A glikogénszintáz aktivitás csökkentése a tárolt glikogén egymás utáni csökkentésével további előnyös tényező lehet. Átmeneti hipoglikémiát figyeltünk meg a MAD kezdetekor, amikor a ketontestek még nem voltak megemelkedve. A MAD lehetséges mellékhatásait, mint gyomor-bélrendszeri tüneteket, fáradtságot és diszlipidémiát [24] nem figyeltünk meg betegeinknél. Eddig nem világos, mi szükséges a plazma keton testkoncentráció szempontjából a szív és a vázizmok megfelelő energiaellátásának biztosításához.
Nem világos, hogy a 2. betegben a MAD-ra adott válasz miért volt kevésbé kifejezett a CK-szintek alapján. A válasz függhet a GSD IIIa mögöttes specifikus mutációtól, alternatív megoldásként az étrendi megfelelés hiányos lehet a járóbeteg-szakrendelőink látogatásai között.
A magas fehérjetartalmú étrendet folytató betegeknél a GSD IIIa-val kapcsolatos kardiomiopátiáról és a légzőizomok myopathiájáról hasonló stabilizálódásról és visszafordításról számoltak be [10–12], amire egy friss iránymutatás is utal [14]. Feltételezzük, hogy ennek a megfigyelésnek a mögöttes mechanizmusa a reaktív hiperinsulinizmus megelőzése is lehet. Valayannopoulos és mtsai. olyan esetről számoltak be, amelyben a magas fehérjetartalmú étrend mellett a kardiomiopátia javult, kombinálva a D, L-3-hidroxi-butiráttal. Az exogén ketontestek ellátása fiziológiás és a beteg megfelelőségét igényli. A ketogén étrendhez való ragaszkodás igényesebb, mint a MAD követése. Így a MAD hatékonyabb és kényelmesebb lehet a beteg napi rutinja szempontjából.
Következtetés
Összefoglalva, 2 olyan GSD IIIa fiúról számolunk be, akik részesültek a MAD-ban. A CK-szint csökkent, a szívműködés javult és a testtűrés nőtt. A MAD kezdetekor jelentkező átmeneti tünetmentes hypoglykaemián kívül nem figyeltek meg súlyos mellékhatásokat.
Beleegyezés
A jelentés közzétételéhez az 1. beteg szüleitől és a 2. beteg édesanyjától írásos tájékozott beleegyezést kaptunk.
Köszönetnyilvánítás
Hálásak vagyunk mind a betegeknek, mind családjaiknak, hogy részt vettek ebben a vizsgálatban. Köszönjük a német Vitaflo GmbH-nak az anyagi támogatást.
- A ketogén étrend javítja a NAFLD-t, a fibrózist a 2-es típusú cukorbetegségben
- Szívbetegségek és étrend Orvostudományi Tanszék Georgetown Egyetem
- Szív-egészséges étrend 8 lépés a szívbetegségek megelőzésére
- Hogyan kezeljük természetesen a száraz szem betegségét diétával
- Kezdje el a vércsoport-diétát! Egyél a típusának megfelelően