A kallikrein-kinin és a renin-angiotenzin rendszerek többrétegű kölcsönhatásban vannak
Hematológiai és Onkológiai Osztály, Belgyógyászati és Patológiai Tanszék, Michigani Egyetem, Ann Arbor, Michigan 48109-0640
Absztrakt
A plazma kallikrein-kinin rendszer (KKS) fiziológiai szerepének megértését akadályozta az, hogy nem tudtuk, hogyan aktiválódnak fiziológiai körülmények között ennek a proteolitikus rendszernek az intravaszkuláris térben összegyűlt fehérjéi. A legújabb vizsgálatok azt mutatják, hogy a prolilkarboxipeptidáz enzim, egy ANG II inaktiváló enzim, prekallikrein aktivátor. A prolilkarboxipeptidáz azon képessége, hogy hat a KKS-ben és a renin-angiotenzin rendszerben (RAS), új kölcsönhatást jelez e két rendszer között. Ez az interakció, valamint az angiotenzin-konvertáló enzim szerepe keresztezi a bradykinin és az angiotenzin (1–7) hatását, és az ANG II 1. és 2. receptor aktiválásának ellentétes hatásai alátámasztják azt a hipotézist, hogy a plazma KKS ellensúlyozza az RAS-t . Ez az áttekintés e két fehérjerendszer kölcsönhatását és keresztbeszédét vizsgálja. Ez az elemzés azt sugallja, hogy e két rendszer között többrétegű kölcsönhatás van, amely fontos a fiziológiai funkciók széles skálájához.
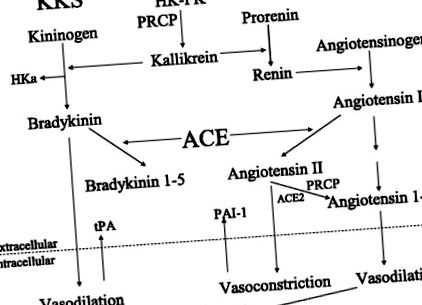
1. ábra.A plazma kallikrein/kinin rendszer (KKS) kölcsönhatása a renin-angiotenzin rendszerrel (RAS). HK, nagy molekulatömegű kininogén; PK, prekallikrein; PRCP, prolilkarboxipeptidáz; HKa, plazmából kallikreinnel hasított, nagy molekulatömegű, bradykinin mentes kininogén; ACE, ANG I konvertáló enzim; ACE2, angiotenzin konvertáló enzim 2; tPA, szöveti plazminogén aktivátor; PAI-1, 1 plazminogén aktivátor inhibitor; PGI2, prosztaglandin I2 vagy prosztacilin.
Asztal 1 A kallikrein-kinin és renin-angiotenzin rendszerek fehérjéinek és peptidjeinek angiogén aktivitása
HK, nagy molekulatömegű kininogén; LK, kis molekulatömegű kininogén; HKa, hasított HK; ACE, angiotenzin konvertáló enzim.
Ennek a felülvizsgálatnak az a célja, hogy részletesebben megvizsgálja ezeket a kölcsönhatásokat, és megállapítsa azok relatív jelentőségét, amelyet in vitro és in vivo vizsgálatok határoztak meg. Különösen az ACE szerepét vitatják meg az ANG I aktiválásában és a BK inaktiválásában. A plazma kallikrein hozzájárulását a prorenin aktiválásához újból megvizsgáljuk a PK aktiválásának fiziológiai mechanizmusának fényében. Megvizsgáljuk a BK és az angiotenzin- (1–7) összesítő biológiai hatásait. Bemutatjuk a PRCP szerepét az ANG II lebomlásában és a plazma PK aktiválásában. Áttekintjük az 1. és 2. angiotenzin receptorok ezekre a rendszerekre gyakorolt módosító hatását is. Végül bemutatjuk e rendszerek mindegyikének a trombózist, a fibrinolízist és az angiogenezist ellensúlyozó hatását.
2. ábra.Az ANG I és a bradikininek (BK) lebomlási útvonala az angiotenzin konvertáló enzimek által. desArg 9 BK, des-Arg 9 -BK; ATII, ANG II; BK 1–7, BK- (1–7); BK 1–5, BK- (1–5); BKB2R, BK B2 receptor; BKB1R, BK B1 receptor; AT1R, ANG II receptor 1; AT2R, ANG II receptor 2; Az Ang (1–7) Rp, feltételezte az angiotenzin- (1–7) receptort. Fontos értékelni, hogy az ANG II stimulálhatja az angiotenzin 1 és 2 receptorokat. Hasonlóképpen, az angiotenzin- (1–7) mindkét angiotenzin-receptort stimulálhatja, és rendelkezhet saját, Ang (1–7) R receptorral, amelyet fizikailag még nem kell azonosítani.
A BK degradációjának befolyásolása mellett az ACEI befolyásolja a BK aktivitását. Az ACEI növeli a BK-vel kapcsolatos hatásokat azáltal, hogy kölcsönhatásba lép a BKB2R-rel, ami növeli a nem elfoglalt BKB2R-molekulák belső aktivitását (58, 59). Alternatív megoldásként azt javasolták, hogy az ACEI zavarja a BKB2R sejtmembránokban történő megkötését (7). Újabb bizonyítékok azt mutatják, hogy az ACE által az ACE koncentrációjának növekedése fokozza a BKB2R BK általi aktiválódását (85). A BKB2R-re gyakorolt hatás mellett az ACEI közvetlenül aktiválja az emberi BKB1R-ket ACE és a BKB1R agonista, des-Arg 10, Lys 1-BK hiányában (66). Az enalaprilát vagy a ramiprilát, de a lizinopril nem, megköti és aktiválja a cinkkötő motívumot, a H 195 EXXH 199-et a BKB1R-en, hogy stimulálja a kalcium-mobilizációt (66). Végül a krónikus ACEI-kezelés funkcionális vaszkuláris és vese BKB1R-hez kapcsolódik, de nem a BKB2R-indukcióhoz (83). Ez utóbbi adatok arra utalnak, hogy az ACEI befolyásolja a BKB1R expresszióját szabályozó gyulladásos rendszereket is. A BKB1R ezen felülszabályozásának teljes következményei egyelőre nem teljesen ismertek.
A szöveti kallikreineket prorenin-konvertáló enzimekként is javasolták, bár kevés információ áll rendelkezésre arról, hogy a szöveti prokallikrein hogyan aktiválódik a szöveti kallikreinné. A sertés hasnyálmirigy-kallikrein lúgos pH-értéke 8,2 (64) aktiválja a prorenint. Az egér submandibularis mirigyszövetének kallikrein aktiválja az egér prorenint (74). Az egér szöveti kallikreinek, az mK1, mK9, mK13 és mK22 szintén prorenin aktivátorok (73). Az emberi hK1 aktiválja az emberi prorenint (34). Bár kimutatták, hogy a plazma és a szöveti kallikrein, valamint a katepszin B és a PC5 a prorenin aktivátorai, még mindig nem világos, hogy ezek közül az enzimek közül melyik vagy bármely más a fő felelős prohormon konvertáz (6, 94). Végül a szöveti kallikrein knockout egerek (KLK1 -/-) csökkent renális renin mRNS-t mutatnak a vad típusú egerekhez képest, de a BKB2R -/- egereknél megnőtt a renin mRNS (133). Ezen adatok jelentése jelenleg ismeretlen. A szöveti kallikrein elősegítheti a renin génexpresszióját; a plazma kallikrein a prorenin aktivátora lehet.
3. ábra.Részletes ANG I lebomlási utak. EP24.11, endopeptidáz 24.11, neprilizin; EP24.15, endopeptidáz 24.15; timet oligopeptidáz.
Van azonban néhány adat állatokon és embereken, amelyek arra utalnak, hogy a KKS nem ellensúlyozza a RAS-t. Widdop és mtsai. (141) megállapította, hogy az angiotenzin- (1–7) nem tudta fokozni a BK hipotenzív hatását a spontán hipertóniás (SHR) és a Wister-Kyoto patkányokban. Ezenkívül az angiotenzin- (1–7) infúzió 7 napig változóan befolyásolja a vérnyomást az SHR-ben (141). Az ACE-gátlóval kezelt szívelégtelenségben szenvedő betegek alkarjában az angiotenzin- (1–7) infúzió nem csökkentette a vérnyomást és nem erősítette a BK értágító hatását (28). Ez utóbbi tanulmány nem tekinthető véglegesnek, mivel a modell korlátozott betegek körében zajlik, akiket erősen előkezeltek gyógyszerekkel. Ezek az állat- és humán vizsgálatok azonban megkérdőjelezik az angiotenzin- (1–7), mint klinikailag jelentős értágító szer fontosságát. További állat- és humán modellekre van szükség az angiotenzin fiziológiai szerepének tisztázásához (1–7).
A legújabb vizsgálatok a C1 inhibitor (C1 INH) knockout egérrel arra utalnak, hogy a plazma kallikrein konstitutív módon jelen van az intravaszkuláris rekeszben, hogy BK-t generáljon (54). A C1 INH KO egér tartós mancsödémával rendelkezik, amelyet blokkol a C1 INH infúzió, a HOE140 infúzió, vagy a C1 INH KO egér párosulása a BKB2R -/- egérrel (54). Mivel a C1 INH a plazma kallikrein egyik fő plazma proteázinhibitora, nem a szöveti kallikrein, a képződött plazma kallikreinnek konstitutív módon jelen kell lennie a kininogének proteolizálásához és a BK felszabadításához, hogy közvetítse az angioödéma kialakulását. Ez az állatmodell összhangban áll a szövetkultúrában végzett vizsgálatokkal, amelyek azt mutatják, hogy a HK és a PK összeállítása az endothel sejteken azonnali PK aktivációt eredményez a PRCP-vel (88, 90, 118, 119). Ezek az adatok arra is utalnak, hogy az intravaszkuláris rekeszben a plazma PK konstitutív aktiválása hozzájárul a BK kialakulásához. Habár nem volt biztos PK knockout egér, a jelen adatok arra utalnak, hogy a plazma kallikrein aktiváció intravaszkuláris kininogenáz a BK konstitutív expressziójában.
Noha az ANG II stimulálhatja az AT2-receptort az NO és közvetetten a BK felszabadítására, további bizonyítékok vannak arra, hogy az AT1-receptor és a BKB2R között is létezik interakció egy alapvetõbb szinten. Az AT1 és a BKB2R stabil heterodimereket képez, ami a Gαq- és GαI-fehérjék fokozott aktiválódását okozza (3, 4). A heterodimerizáció mindkét receptor endocitális útvonalának változását is eredményezi. A heterodimerizáció az AT1 és a BKB2R között a vérlemezkékben és az omentális erekben történik a preeklamptusos nőknél (3). Ez az interakció a BKB2R fehérje szintjének négyszeres-ötszörös növekedését eredményezi (3). Végül az AT2 receptor megköti az AT1 receptorokat, hogy további heterodimereket képezzenek az AT1 receptor funkciójának antagonizálására (2). Ezek a vizsgálatok szabályozó kölcsönhatásokat jeleznek a két rendszer között a receptor fehérjék szintjén.
Bár a RAS-t és a KKS-t elismerték az érbiológia, a vérnyomásszabályozás és az érgyulladás fontos modulátorai (10), megvizsgálták őket a trombózisra, a fibrinolízisre és az angiogenezisre gyakorolt hatásuk szempontjából is. Úgy tűnik, hogy a RAS és a KKS terápiás manipulációja az artériás trombózis kockázatának megváltozását eredményezi. Az ACE-gátlókkal vagy az AT1-receptor antagonistákkal végzett kezelés ~ 15–20% -kal csökkenti a szívinfarktus és a stroke kockázatát (27, 130). Ezenkívül az ACE-gátló kezelés a trombolitikus terápia előtt csökkenti a plazma-mogén-aktivátor 1-es plazma-gén inhibitor 1 (PAI-1) szintjének korai növekedését az akut miokardiális infarktusban (140). Ezen klinikai eredmények kísérleti alapját felül fogják vizsgálni.
Az RAS-t protrombotikus rendszerként javasolták (18). Az ANG II-ről felismerték, hogy növeli a tenyésztett asztrocitákból és endoteliális sejtekből származó plazminogén aktivátor inhibitor-1 (PAI-1) mRNS, antigén és aktivitás szintjét (97, 101, 138). Az ANG II emellett növeli a szöveti faktor mRNS-ét és aktivitását anélkül, hogy befolyásolná a tPA vagy a szöveti faktor proteáz-gátlót patkány aorta endothel sejtjeiben (97). A pitvari natriuretikus peptid elnyomja a szöveti faktor és a PAI-1 mRNS ANG II által kiváltott expresszióját tenyésztett patkány aorta endothel sejtekben (149). A vazodilatáló peptid adrenomedullin blokkolja a szöveti faktor és a PAI-1 mRNS ANG II uregulációját tenyésztett patkány endoteliális sejtekben (128). A tenyésztett vaszkuláris simaizomsejtekben a MEK/ERK és Rho-kináz útvonalak aktiválása hozzájárul a PAI-1 mRNS angiotenzin által kiváltott emelkedéséhez (129). Tenyésztett humán monocitákban az ANG II növeli a szöveti faktor mRNS-t és az antigént, a PAI-1-et azonban nem (92). Az ACE-gátló (kaptopril) és az ANG II-receptor 1-antagonista (kandezartán) csökkenti ezekben a sejtekben a szöveti faktor szintjét. A kaptopril szintén csökkenti a PAI-1 fehérje szintjét, de ezt a hatást egy BKB2R antagonista gátolja (92).
Az RAS alternatívájaként a KKS-t eredeti jellemzése óta felismerték, hogy befolyásolja a fibrinolízist. A XII faktor hiányát több mint 40 évvel ezelőtt jellemezték hibás fibrinolízissel (96). A mai napig nem voltak olyan jó állatmodellek, amelyek meggyőzően kimutatták volna, hogy a plazma KKS részt vesz a trombózisban. A plazma kallikrein, a XIIa faktor és a XIa faktor képesek aktiválni a plazminogént plazminná, bár sokkal kevésbé hatékonyan, mint a szövet típusú plazminogén aktivátor és a kétláncú urokináz plazminogén aktivátor (22, 53, 82). Kimutatták azonban, hogy a plazma kallikrein kinetikailag kedvező aktivátora az egyláncú urokináznak (65). A plazma PK aktiválása HK-hoz kötődve endoteliális sejteken kinetikailag kedvező egyláncú urokináz képződést eredményez a későbbi plazmin képződéssel, ami arra utal, hogy ez az út az előnyös út a plazmin képződéséhez in vivo (90).
A fibrinolízisnek az egyláncú urokináz aktiválásban való részvételével történő stimulálása mellett a kallikrein által kiváltott BK felszabadulás befolyásolja a fibrinolízist azáltal, hogy stimulálja a tPA felszabadulását a vénás endotheliumból (15, 17, 126). Az a mechanizmus, amellyel a BK felszabadítja a tPA-t az emberi erekből, a BKB2R-en keresztül történik, és független az NO-tól és a BK által indukált prosztaciklin felszabadulástól (14). A ciklooxigenáz 2 (COX2) BK stimulációja az értágító prosztaciklin felszabadítással szintén hozzájárul az antikoaguláns állapothoz (49, 62, 105). A COX2 stimulálása egerekben emellett fokozza a vese medulláris véráramlását, fokozott vizeletáramlást és csökkent ANG II nyomóhatásokat, hozzájárulva az antitrombotikus állapothoz (105).
A KKS és a RAS hatása az angiogenezisre nemrégiben felértékelődött (1. táblázat). Egy ideje ismert, hogy a BK-nak lehetnek proangiogén hatásai. A BK patkányban beültetett szivacsokban stimulálja a neovaszkuláris választ, és az új érképződést gátolja [Leu 8] des-Arg 9-BK (63). Újabban az ép HK és LK is proangiogénnek bizonyult (24). A HK doménjére 5 irányított monoklonális antitest blokkolja a HK által indukált angiogenezist, valószínűleg azáltal, hogy megzavarja a HK kalikrein hasítását a BK felszabadítása érdekében (24, 117). Alternatív megoldásként a plazma kallikreinnel hasított HK (HKa) (kininosztatin), a HK rekombináns 5. doménje és az 5. domén régióból izolált peptidek gátolják az angiogenezist, a sejtek szaporodását és növekedését (23, 151).
A KKS szabályozása vagy az RAS beavatkozása befolyásolja az angiogenezist. A BK és az ANG II közötti kölcsönhatás elengedhetetlennek tűnik a normális szívfejlődéshez. A születéstől kezdve AT1 receptor antagonistával kezelt BKB2R -/- egereknél csökkent a bal kamrai tömeg, a kamra térfogata, a falvastagság és a szívizom fibrózis, mint a kezeletlenül hagyott állatoknál (37, 78). Ezek az adatok arra utalnak, hogy az ANG II szorosan részt vesz a szív fejlődésében.
Az ANG II és a BKB2R mellett a KKS és a RAS egyéb komponensei is hozzájárulnak az angiogenezishez. A BKB1R részt vesz az angiogén reparatív folyamatokban is. A tenyésztett sejtekben a BKB1R stimulálása elindítja az endothel sejtek szaporodását és túlélését; ennek a receptornak az antagonizmusa apoptózist eredményez (44). A végtag iszkémiájának egérmodelljében a BKB1R szignalizációval való interferencia gátolja az ischaemiara adott natív angiogén választ. A BKB1R knockout állatok a végtag ischaemia után hajlamosak a végtag nekrózisára (44). Alternatív megoldásként a BKB1R agonisták helyi bejuttatása fokozza a kollaterális ér növekedését és felgyorsítja a perfúzió helyreállítását (44). Végül az angiotenzinogén és hasított származékai zavarják az angiogenezist (20). Mivel az angiotenzinogén szerpin és az antithrombin erős antiangiogén aktivitással rendelkezik, a vizsgálatok kimutatták, hogy az angiotenzinogén és származékai [reaktív hurok hasított formája, és a des (ANG I) angiotenzinogén] antiangiogén aktivitással rendelkeznek (20). Összefoglalva, ezek az adatok arra utalnak, hogy a KKS és a RAS fehérjekomponenseinek bomlástermékei antiangiogén hatásúak, míg az ép fehérjék és meghatározott fiziológiásan biológiailag aktív peptidek proangiogének (1. táblázat).
Ez az áttekintés azt jelzi, hogy a plazma KKS és RAS alaposan összefonódik a szív- és érrendszerben. Az egyik rendszer aktiválása valószínűleg a másik proteolitikus rendszer bizonyos aspektusainak ellenaktiválását eredményezi a fiziológiai homeosztázis fenntartása érdekében. A felülvizsgált információkban mindkét út teljes fehérjeszinten és biológiailag aktív peptidjeinek egymást követő enzimatikus lebomlási termékeinek kölcsönhatása többrétegű és mélyreható. Jelenleg ezekben a rendszerekben néhány kritikus pontot elismertek kábítószer-célpontként. A két rendszerrel kapcsolatos további szív- és érrendszeri betegségek kezelésére szolgáló gyógyszercélok kialakíthatók e rendszerek kölcsönhatásainak jobb megértésével.
Köszönöm dr. A. Hasan, Z. Shariat-Madar, G. da Motta és F. Mahdi asszony az ötletek fejlődéséhez való hozzájárulásért.
- A kukoricaolajról szóló vita többszörösen telítetlen zsírokat jelent számunkra az Amerikai Tudományos és Egészségügyi Tanács számára
- Melyek az amerikai étrend alapjai az egészséges táplálkozás SF kapuja
- Környezetünk hatása a testsúlyra - Scientific American
- A Winthrop súlycsökkentő programja az első helyet foglalja el a harmadik év Mineola American számára
- UNI KEY Health Systems recept kiadós hasi fogyókúrás leves őrölve