A Ketogén diéta 2011: Hogyan működik
1 Gyermek- és Serdülőkori Neurológiai Osztály, Schneider Gyermekorvosi Központ, Izrael, Orvostudományi Kar, Tel-Avivi Egyetem, Tel-Aviv, Izrael
Absztrakt
Bár a ketogén étrendet (KD) széles körben elfogadták az epilepszia és más neurológiai rendellenességek legitim és sikeres terápiájaként, hatásmechanizmusa továbbra is rejtély. A KD alkalmazása jelentős metabolikus változásokat okoz. Közülük a legjelentősebbnek a krónikus ketózis helyzete tűnik, de vannak olyanok is, például a magas szintű többszörösen telítetlen zsírsavak (PUFA-k). Ezek az „elsődleges” hatások „másodlagos”, részben adaptív hatásokhoz vezetnek, például változásokhoz a mitokondriális sűrűségben és a génexpresszióban. Klinikailag az étrend hatásait görcsoldónak és neuroprotektívnek tekintik, bár a neuroprotektió a rohamok megelőzéséhez is vezethet. Ezen mechanizmusok lehetséges klinikai következményeit tárgyaljuk.
1. Bemutatkozás
A ketogén étrend (KD) értékét felismerték az epilepszia kezelésében, bár a hatásának pontos mechanizmusai továbbra is rejtélyek maradnak [1]. Úgy tűnik, különböznek a szokásos epilepszia elleni gyógyszerektől (AED) [2], és felfedezve, hogy mik lehetnek, az epilepsziától eltérő klinikai helyzetekben is alkalmazhatók [3].
A KD négy elemből áll, amelyek bármelyikének megváltozása potenciálisan antikonvulzív hatásának elvesztéséhez vezethet: (1) megnövekedett zsírmennyiség, általában 3–4 gramm zsír arányban minden egyes fehérje- és szénhidráttartalomra, (2) a lehető legkevesebb glükózfogyasztás, (3) kalóriakorlátozás és (4) folyadékkorlátozás [1]. Bár vita folyik az utolsó komponensről [4], a klinikai gyakorlat kimutatta, hogy a folyadékkorlátozás leállítása rohamok megismétlődéséhez vezethet ugyanúgy, mint a glükózkorlátozás leállításakor.
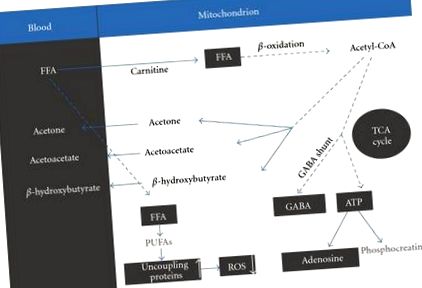
A KD szigorú megfigyelése krónikus ketózishoz vezet [5] a következő módon. Az étrend betartásának legfontosabb eredménye a szabad zsírsavak (FFA) megnövekedett vérszintje. Az FFA-k átkerülnek a mitokondriumba, amely folyamat megfelelő mennyiségű karnitin jelenlétét igényli, ahol keton testekké bomlanak le. β oxidáció. Ezek a keton testek a következők: β hidroxi-butirát, acetoacetát és aceton [5] (1. ábra).
1.1. A keton testek szerepe
A TCA ciklus révén az acetil-CoA növeli a neurotranszmitterek glutamát és γ-aminovajsav (GABA), illetve az agy fő ingerítő és gátló neurotranszmitterei. A megnövekedett GABAergiás hatás nettó hatása felelős lehet a görcsgátló hatásért [5].
1.2. A többszörösen telítetlen zsírsavak szerepe
A szabad zsírsavak magas szintjének másik terméke a többszörösen telítetlen zsírsavak (PUFA). A PUFA-k azon képességét, hogy blokkolják a roham aktivitását az agyban, feltételezik, hogy néhány meglehetősen bonyolultabb mechanizmushoz kapcsolódik, beleértve (1) a feszültségtől függő nátrium- és kalciumcsatornák közvetlen gátlását, (2) egy lipidérzékeny káliumcsatorna aktiválását, ( 3) a nátriumpumpa aktivitásának fokozása az idegsejtek ingerlékenységének korlátozása érdekében, (4) a peroxiszóma proliferátor által aktivált receptor aktiválása-α (PPARα), és (5) az agy-specifikus szétkapcsolódó fehérjék expressziójának és aktivitásának indukálása a mitokondriumokban, ezáltal neuroprotektív hatás kiváltása [5]. Ez az utolsó hatás a reaktív oxigénfajok (ROS) keletkezésének korlátozásán keresztül működik.
1.3. A bioenergetika és az idegvédelem fogalma
A ketogén étrend elsősorban görcsoldó. Azonban számos szempontból a KD neuroprotektív is. A neuroprotekció hozzájárulhat a görcsgátló hatáshoz, de más hatásai is lehetnek, amelyek a KD egyéb klinikai alkalmazásához vezethetnek [3]. Összességében a KD használata fokozza az agy energiatermelését. Appleton és De vivo [8] arról számolt be, hogy a KD növelte a bioenergetikus szubsztrátok (adenozin-trifoszfát (ATP)) teljes mennyiségét és megemelte az energia töltést a patkányagyban. Acetoacetát, a β A hidroxi-butirát dehidrogénezése acetil-CoA-ba kerül, amely belép a trikarbonsav (TCA) ciklusba. A TCA-ciklus megnövekedett forgalma protonokat és elektronokat generál, amelyek az elektrontranszportláncba kerülnek. Ez pedig az ATP-szintáz révén előidézi az ATP-t adenozin-foszfátból (ADP). A fokozott ATP vagy átalakítható foszfo-kreacinná energiatárolás céljából, vagy pedig adenozinná bontható. A megnövelt ATP-szintek energiatartalékot biztosítanak az idegsejt számára, hogy stressz alatt tovább működhessen. A megnövekedett extracelluláris adenozin neuroprotektív puffert kínál a sértések ellen, csökkenti az gerjesztést és elhárítja a túlzott ATP igényeket, ezáltal biztosítva a lokális rohamkontrollt és a neuroprotekciót [6].
Azt is felvetették, hogy a KD befolyásolja az energia-anyagcsere enzimeket kódoló transzkriptumok újraszabályozását és a mitokondriumok sűrűségének növekedését az idegsejtek folyamatában, ami megnövekedett energiatartalékokhoz vezet. A javult energetikai állapot támogathatja a rohamok megelőzését, például a GABAerg gátlás támogatásával [9]. Azt javasolják, hogy az étrend által kiváltott metabolikus változásokhoz alkalmazkodó folyamatok a génexpresszió változásaihoz vezessenek, amelyek viszont a fent említett változások némelyikét eredményezik.
A neuroprotekció másik útját a ROS csökkent generációja révén modulálják, amely összefüggésben van a PUFA-k fehérjék szétkapcsolódásával kapcsolatos hatásával [5].
1.4. A ketogén étrend egyéb klinikai alkalmazásai
Az a tény, hogy a KD-t bevált terápiának tekintik, viszonylag kevés káros mellékhatással és széles körű klinikai tapasztalattal rendelkezik, különösen gyermekek esetében, újabb tanulmányokhoz vezetett, amelyek új neurológiai rendellenességek új felhasználási lehetőségeit kutatták [3]. Az egyik legérdekesebb és legaktívabb kutatási terület a magas zsírtartalmú kalóriatartalmú étrend hatása az agydaganatos sejtek túlélésére. Az agyrákos sejtek metabolikus rugalmassága korlátozott, és főként a glükóz metabolizmusától függenek. Feltételezik, hogy a mitokondriális rendellenességek rontják az agydaganatok azon képességét, hogy energiát termeljenek keton testekből. A normál sejtektől eltérően a rosszindulatú daganatos sejtek genetikai rendellenességeik miatt károsítják a genetikai alkalmazkodóképességet, és ezért fokozott érzékenységet mutatnak a környezeti stresszre, például az éhgyomorra vagy a kalóriakorlátozásra. Ugyanazok a genomiális hibák, amelyek részt vesznek az agydaganatok létrehozásában, kihasználhatók rombolásukra [3, 10, 11].
1995-ben Nebeling et al. [12] két olyan fiatal lányról számolt be, akiknek nem sikerült visszafejleszteni az előrehaladott stádiumú agydaganatot, és akiknek rossz volt a válasza a sugárzásra és a kemoterápiára. KD-vel kezelték őket, és válaszuk figyelemre méltó volt, mind klinikailag, mind a pozitronemissziós tomográfia nyomon követése alapján. Zuccoli és mtsai. [13] egy glioblastoma multiformában szenvedő beteget írtak le, amelynek nagyon rosszindulatú daganata javult a KD-n. Meglepő, hogy ennek a kezelésnek a vonzó hatékonysága ellenére nem végeztek további humán vizsgálatokat vagy klinikai vizsgálatokat a KD-vel, mint agydaganatok terápiájával. Számos laboratóriumi vizsgálat egér- és patkánymodellekkel nemrégiben megerősítette, hogy az agydaganat növekedésének gátlása közvetlenül összefügg a csökkent glükózszinttel és a ketontestek szintjének emelkedésével. Sőt, kimutatták, hogy a KD csökkenti az agy reaktív oxigénfajtáit (ROS) [5]. A rákos sejteknek magas ROS-szintre van szükségük az angiogenezis indukálásához és a tumor növekedési faktorok termeléséhez [11], így ezen mechanizmus révén a KD védő lehet.
2. Szemléltető eset
Egy 12 éves kislánynál neurokután melanózist diagnosztizáltak, központi idegrendszeri érintettséggel. A tumor nagyon rosszindulatú volt, és a progressziója nagyon gyors volt. A klinikai megnyilvánulások főként kezelhetetlen rohamok voltak, amelyek szükségessé tették az intenzív osztályon történő ismételt felvételt, valamint súlyos kognitív és éberségi csökkenést. Miután az onkológusok úgy döntöttek, hogy a daganatellenes kezelés hatástalan, elkezdték a KD-t. Négy hetes kísérlet után semmilyen hatása nem volt a tumor progressziójára. A rohamok gyakorisága és súlyossága javult, de AED-vel egyidejűleg kezelték. Ennek azonban figyelemre méltó javító hatása volt a lány megismerésére, éberségére és hangulatára, annak pusztító állapota ellenére. A beteg a diéta megkezdése után több héttel lejárt.
A KD kognícióra, éberségre és hangulatra gyakorolt jótékony hatása jól ismert [1], és a klinikai tapasztalatok azt mutatják, hogy sokszor nem kevésbé fontos, mint a görcsoldó hatás. Ez különösen igaz az onkológiai betegség progresszív stádiumában lévő fiatalokra.
A KD potenciális neuroprotektív hatása motiválta annak vizsgálatát, hogy ez más neurológiai rendellenességek kezelésének lehetősége [3]. Egyre több olyan jelentés érkezik, miszerint az éhezéssel vagy a KD beadásával elért ketózisnak következetes neuroprotektív hatása van különféle agysérülések után állatmodellekben. Egy humán kísérleti vizsgálat és számos állatmodell-tanulmány kimutatta az autista viselkedési paraméterek javulását a KD kezeléssel. Továbbra is tisztázandó, hogy ez a javulás összefügg-e a betegek legfeljebb 30% -ában észlelt csökkent epilepsziás aktivitással, vagy a KD elsődleges hatásával [3].
Az a tényező, amely kulcsfontosságú lehet a KD alkalmazásához a kezelhetetlen epilepsziától eltérő orvosi körülmények között, az alkalmazásának velejárói. [14] Az étrendi korlátozás jelentős problémát jelenthet egy progresszív daganatban szenvedő, masszív kemoterápián átesett gyermeknél, aki már lehet, hogy kachektikus. Előfordulhat, hogy a felnőttkori hiperaktív autista gyermeknél a KD nem lehetséges. Ezért a neurológusnak nagyon óvatosan kell értékelnie a megfelelő klinikai, családi és környezeti helyzeteket a KD ajánlása előtt.
Összegzésképpen elmondható, hogy a KD fő metabolikus hatása az agy nagyobb mennyiségű szabad zsírsavakkal történő ellátása. Ketontestekké történő lebontásuk a PUFA-k terhelésével együtt jelentős változásokhoz vezet az anyagcsere, a bioenergetikus, a mitokondriális, sőt a genetikai konstellációban is. Ezeknek az elsődleges és másodlagos változásoknak antikonvulzív és neuroprotektív hatása van. A KD ma már a gyermek epileptológusok fegyverzetének jelentős eleme. Az, hogy más patológiák esetén is hatékony lehet-e, különösen a rosszindulatú daganatok kezelésében, várja a jövőbeni kutatásokat.
Hivatkozások
- A. L. Hartman és E. P. G. Vining, „A ketogén étrend klinikai vonatkozásai” Epilepszia, köt. 48. sz. 1, 2007. 31–42. Oldal. Megtekintés: Publisher Site | Google ösztöndíjas
- A. L. Hartman és J. M. Freeman: „A ketogén diéta hatékonysága a különböző epilepsziákban betekintést enged-e a mechanizmusaiba?” Epilepszia, köt. 49, 8. melléklet, 2008. 53–56. Oldal. Megtekintés: Kiadói webhely | Google ösztöndíjas
- K. W. Barañano és A. L. Hartman: „A ketogén étrend: epilepsziában és más neurológiai betegségekben való felhasználás” A neurológia jelenlegi kezelési lehetőségei, köt. 10. szám 6, 410–419, 2008. Megtekintés: Publisher Site | Google ösztöndíjas
- E. C. Wirrell: "Ketogén arány, kalória és folyadék: számítanak?" Epilepszia, köt. 49, 8. melléklet, 2008. 17–19. Oldal. Megtekintés: Kiadói webhely | Google ösztöndíjas
- K. J. Bough és J. M. Rho: „A ketogén étrend görcsoldó mechanizmusai” Epilepszia, köt. 48. sz. 1, 2007. 43–58. Oldal. Megtekintés: Publisher Site | Google ösztöndíjas
- S. A. Masino, M. Kawamura, C. A. Wasser, L. T. Pomeroy és D. N. Ruskin: „Adenozin, ketogén étrend és epilepszia: az anyagcsere és az agytevékenység közötti kialakuló terápiás kapcsolat” A jelenlegi neurofarmakológia, köt. 7. szám 3, 257–268., 2009. Megtekintés: Publisher Site | Google ösztöndíjas
- N. Hasebe, K. Abe, E. Sugiyama, R. Hosoi és O. Inoue: „A metil-etil-keton és a dietil-keton görcsoldó hatása az egér rohamok több típusában” European Journal of Pharmacology, köt. 642, 66–71., 2010. Megtekintés: Publisher Site | Google ösztöndíjas
- D. B. Appleton és D. C. De Vivo, „Kísérleti állatmodell a ketogén étrend hatására az epilepsziára” Az Ausztrál Neurológusok Egyesületének közleménye, köt. 10, 1973. 75–80. Megtekintés: Google Scholar
- K. Bough: „Az energia-anyagcsere a ketogén étrend görcsoldó mechanizmusának részeként” Epilepszia, köt. 49, 8. kiegészítés, 91–93., 2008. Megtekintés: Kiadói oldal | Google ösztöndíjas
- B. T. Seyfried, M. Kiebish, J. Marsh és P. Mukherjee: „Az energia-anyagcsere célzása az agyrákban a kalória-korlátozás és a ketogén diéta révén” Journal of Cancer Research and Therapeutics, köt. 5., 1. melléklet, 2009. S7–15. Oldal. Megtekintés: Google Scholar
- P. Stafford, M. G. Abdelwahab, D. Y. Kim, M. C. Preul, J. M. Rho és A. C. Scheck: "A ketogén étrend megfordítja a génexpressziós mintákat és csökkenti a reaktív oxigénfajták szintjét, ha a glioma adjuváns terápiájaként használják". Táplálkozás és anyagcsere, köt. 7, 2010. 74. cikk. Megtekintés: Publisher Site | Google ösztöndíjas
- L. C. Nebeling, F. Miraldi, S. B. Shurin és E. Lerner: „A ketogén étrend hatása a tumor metabolizmusára és tápláltsági állapotára gyermek onkológiai betegeknél: két esetjelentés” Journal of American College of Nutrition, köt. 14. sz. 2, 202–208, 1995. Megtekintés: Google Scholar
- G. Zuccoli, N. Marcello, A. Pisanello és mtsai: „A glioblastoma multiforme metabolikus kezelése standard terápiával és korlátozott ketogén étrenddel együtt: esettanulmány” Táplálkozás és anyagcsere, o. 2010., 33. Megtekintés: Kiadói webhely | Google ösztöndíjas
- J. H. Cross, A. Mclellan, E. G. Neal, S. Philip, E. Williams és R. E. Williams: „A ketogén diéta a gyermekkori epilepsziában: hol tartunk most?” A gyermekkori betegségek archívuma, köt. 95. sz. 7, 550–553., 2010. Megtekintés: Publisher Site | Google ösztöndíjas
- Az alacsony szénhidráttartalmú, ketogén étrend és az alacsony glikémiás indexű étrend hatása a glikémiára
- A ketogén étrend alkalmazása az epilepsziás encephalopathiák kezelésében Journal of the
- Az alacsony szénhidráttartalmú, ketogén étrend hatása a policisztás petefészek szindrómára Kísérleti tanulmány
- Miért működik nálam az 5 2 diéta
- Mi a ketogén diéta My Hudson Valley