A koplalás, a cirkadián ritmus és az idő korlátozott táplálkozás egészséges életkorban
Valter D. Longo
1 Hosszú élettartam Intézet és Davis Gerontológiai Iskola, University of Southern California, Los Angeles, CA 90089, USA
2 IFOM, FIRC Molekuláris Onkológiai Intézet, Via Adamello, 2013. szeptember 16., Milano, Olaszország
Satchidananda Panda
3 Szabályozó Biológiai Laboratórium, Salk Intézet Biológiai Tanulmányokhoz, La Jolla, CA 92037
Összegzés
A legtöbb állat etetése egy meghatározott időszakra korlátozódik, így rövid éhgyomri időszakok maradnak, amelyek egybeesnek az alvással. A böjt lehetővé teszi az organizmusok alternatív anyagcsere-fázisokba való belépését, amelyek kevésbé támaszkodnak glükózra és inkább a keton testszerű szénforrásokra. Az időszakos és az időszakos böjt mind a megelőzéstől a betegségek fokozott kezeléséig terjedő előnyökkel jár. Hasonlóképpen, az időtartamú etetés (TRF), amelyben az etetési idő a nap bizonyos óráira korlátozódik, lehetővé teszi a napi éhezési időszak> 12 órán át tartó tartamát, ezáltal több szervezetben pleiotrop előnyöket biztosítva. A tápanyagok és az éhgyomri előnyök közötti mechanikus kapcsolat megértése az éhgyomri utánzó étrendek (FMD) azonosításához vezet, amelyek hasonló változásokat érnek el, mint az éhezés. Tekintettel a TRF és az FMD pleiotróp és tartós előnyeire, mind az alaptudományi, mind a transzlációs kutatás indokolt az éhezéssel kapcsolatos beavatkozások hatékony és olcsó kezelésekké történő fejlesztésére, amelyek javíthatják az egészséget.
Bevezetés
Az életformák bolygónkon a napi fény/sötét ciklus erős hatására alakultak ki. Mivel a fotoszintézis elsődleges energiaforrása a napfény, a fotoszintetikus biomassza napi termelése kiszámítható napi ritmussal rendelkezik. A fotoszintetizált kémiai energia napi ciklikus termelése az élelmiszerlánc alapja. A fény és a sötétség napi változásai napi környezeti paramétereket, például hőmérsékletet és páratartalmat eredményeznek. Az ilyen kiszámítható és robusztus napi ritmus az élelmiszerek elérhetőségében és a környezeti tényezőkben az a
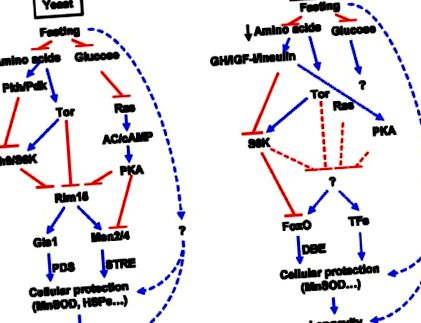
Megőrzött tápanyag-érzékelési utak élesztőben és egerekben.
A jövőbeli vizsgálatok során fontos lesz megérteni, hogy az éhezési körülmények hogyan befolyásolják az élesztő képességét a sérült organellák és makromolekulák helyreállítására és pótlására. Az egysejtű eukarióták egyszerűsége valószínűleg továbbra is alapvető új ötleteket hoz létre, és mélyebb mechanikus betekintést nyújt, amelyek felgyorsítják a magasabb eukarióták kutatását. A férgeken és a legyeken végzett vizsgálatok szintén fontosak lesznek az élesztő és emlősök éhomi molekuláris biológiájának megértése érdekében.
A koplalás és a koplalás utánzó étrend rágcsálók betegségei és hosszú élettartama esetén
A rágcsálók modelljeiben az éheztetés két fő formáját vizsgálták: szakaszos éhezés (IF), amely általában csak vizes vagy nagyon alacsony kalóriatartalmú időszakra vonatkozik, kevesebb, mint 24 órán át, majd normális, egy-két napos táplálkozási periódus következik. böjt (PF), amely legalább 2 napig tart, és amelyet a következő ciklus legalább egy héttel elválaszt (Longo és Mattson, 2014).
Az IF szerepe a rágcsálók öregedésében és betegségeiben még mindig ellentmondásos. Patkányokon több tanulmány is azt jelzi, hogy minden másnap a böjt következetesen meghosszabbítja az élettartamot, és hogy ez a hatás hangsúlyosabb, mint az a következmény, amelyet 3-4 napos 1 napos koplalás okoz (Carlson és Hoelzel, 1946; Kendrick, 1973). Azonban a különböző genetikai háttérrel végzett egérvizsgálatok azt mutatják, hogy az IF-nek nincs hatása az átlagos élettartamra, és akár csökkentheti is az élettartamot, ha 10 hónapos korban kezdődik (Goodrick et al., 1990). Még akkor is, amikor az IF-t 1,5 hónaposan kezdték, a hosszú élettartamra gyakorolt hatások csekélyek és nem következetesek (Goodrick et al., 1990).
A rágcsálóknál azonban az IF fokozza a kognitív teljesítményt (Fontán-Lozano és mtsai, 2007; Singh és mtsai, 2012), amelyet részben a szinaptikus plaszticitásra gyakorolt stimuláló hatása okozhat (Lee és mtsai, 2006), és javítja is. inzulinérzékenység, és csökkenti a vérnyomást és a pulzusszámot (Mager et al., 2006; Wan et al., 2003).
A száj- és körömfájás hét hónapja szintén javult a viselkedési tesztek körében, a motoros koordinációtól kezdve a hosszú és rövid távú memóriáig a standard kontroll étrenden lévő egerekhez képest (2. ábra) (Brandhorst et al., 2015). Az FMD neurogenezisre gyakorolt hatása, valószínűleg az IGF-1 és a PKA jelátvitelének csökkentése révén, azt jelzi, hogy új és funkcionális idegsejtek generálása hozzájárulhat az FMD-vel kezelt egerek fokozott kognitív teljesítményéhez, egyetértve a PF, IGF-1 és PKA a hematopoietikus regenerációról (Cheng et al., 2014).
Nem meglepő, hogy a 16 hónapos korban kezdődő FMD-ciklusok 18% -kal növelték a 75% -os túlélési pontot, és 11% -kal növelték az átlagos élettartamot. Nevezetesen, 24 hónapos életkor után úgy tűnt, hogy az egereket negatívan befolyásolja a 4 napos száj- és körömfájás, de nem egy azonos, 3 napra csökkentett száj- és körömfájás, összhangban a fehérje korlátozás eredményével, jelezve, hogy a fiatal, de nem öreg egerek képesek fenntartani a normális súlyt amikor a fehérjebevitel az összes kalóriabevitel kevesebb mint 7% -át teszi ki (2. ábra) (Levine et al., 2014).
IF és PF az emberi krónikus betegségek megelőzésében és kezelésében
IF és betegségek
Az IF sokféle hatással lehet az anyagcsere markerekre és a kockázati tényezőkre vagy betegségekre, beleértve a testzsírt és a vérnyomást. Túlsúlyos egyéneknél, akik körülbelül 500 kcal-kal, de viszonylag magas fehérjetartalmú étrendet fogyasztottak heti 2 napon keresztül, 6 hónapon keresztül, a hasi zsír csökkent vérnyomása és az inzulinérzékenység növekedett (Harvie et al., 2011). Hasonló eredményeket kaptunk 2-3 hét minden másnapi koplalás után (Halberg et al., 2005; Heilbronn et al., 2005). Az összes releváns klinikai vizsgálat eredményeinek áttekintése, amely mind a krónikus kalória-korlátozást 20-50% -os tartományban (CR), mind az intermittáló éhgyomrot értékeli, arra a következtetésre jut, hogy a CR a testtömeg-veszteséget okozza az IF-hez képest, de mindkét beavatkozás hasonló hatással van a a zsigeri zsír, az inzulin és az inzulinrezisztencia csökkenése (Barnosky et al., 2014). Azonban azt a következtetést is levonták, hogy sem a CR-nek, sem az IF-nek nincs klinikailag jelentős hatása a glükózszintre, ami felveti annak lehetőségét, hogy mindkét beavatkozás korlátozottan alkalmazható legyen a metabolikus szindróma és a cukorbetegség megelőzésében és kezelésében, különös tekintettel az egyik vagy másik betartásának elérésére vonatkozó nehézségekre. súlyos és krónikus CR vagy súlyos korlátozások, amelyek átlagosan napi 500–600 kcal-ra korlátozzák a kalóriafogyasztást, havonta 9–15 alkalommal.
Ha az éhezésnek is lehet némi hatása a gyulladásos betegségekre, mivel az alternatív nappali éhezés 2 hónapja az asztmában szenvedő betegeknél a gyulladásos markerek jelentős csökkenését eredményezte (Johnson és mtsai, 2007).
PF és betegségek
A PF egyik megalapozott klinikai felhasználása a rheumatoid arthritis (RA) kezelésében rejlik. Négy különböző kontrollos vizsgálat azt mutatta, hogy az egy-három hétig tartó éhgyomri periódusok csökkentik az RA tüneteit, bár ezeket a hatásokat a normál étrendhez való visszatérés megfordítja, hacsak a PF-et nem követi vegetáriánus étrend (Müller et al., 2001).
A PF a hipertónia kezelésében is hasznos lehet. Egy vizsgálat során az 13 napos vízzel történő éhezés csak enyhe magas vérnyomásban szenvedő betegek 82% -ában csökkentette a szisztolés vérnyomást 120 alá (Goldhamer et al., 2002). A PB szignifikánsan alacsonyabb maradt, miután az alanyok 6 napig visszatértek a szokásos étrendhez. Egy másik vizsgálatban a 10–11 napos koplalás 37–60 mm-rel csökkentette a magas vérnyomásban szenvedő betegek szisztolés vérnyomását, de ez a tanulmány nem követte a betegeket, miután visszatértek a szokásos étrendhez (Goldhamer et al., 2001). Összefoglalva: mind az IF, mind a PF potenciálisan alkalmazható gyulladásos és szív- és érrendszeri betegségek esetén, de további, nagyobb és randomizált vizsgálatokra van szükség, mielőtt ezek a stratégiák beépülhetnek az orvosok által nyújtott ellátás színvonalába.
Optimális módszertan és közegészségügy
Az időszakos koplalást utánzó étrend (FMD)
Számos fő akadály okozhatja a PF nagyon korlátozott mértékű hozzájárulását a szokásos orvosi gyakorlathoz: 1) az éheztetésnek a betegségek megelőzésére és kezelésére gyakorolt specifikus és következetes hatásait alátámasztó preklinikai és klinikai adatok hiánya vagy az érintett mechanizmusok, 2 ) a kizárólag vízfogyasztás vagy a klinikán kívül gyakran alkalmazott nagyon alacsony kalóriatartalmú (kb. 200 kcal) étrend elfogadásával kapcsolatos biztonsági aggályok; 3) az ezen extrém diéták betartásával kapcsolatos nehézségek. Bár évente valószínűleg emberek százezrei szenvednek valamilyen PF-ben, az egészségügyi szakemberek határozottan javasolják, hogy a csak vizet vagy hasonló éhomi beavatkozásokat csak orvosi szakszemélyzetből álló speciális klinikákra korlátozzák.
A száj- és körömfájást először egereknek, végül embereknek fejlesztették ki, hogy kezeljék ezeket az aggályokat, és segítsenek azonosítani a böjt pozitív és potenciálisan negatív hatásait, miközben minimalizálják a biztonsággal és a megfeleléssel kapcsolatos aggályokat. Az eredetileg csak az egerek éhgyomri helyettesítésére kifejlesztett FMD-t most embereken tesztelték. Az emberi száj- és körömfájás egy 5 napos kezelésből áll, amely 725–1090 kcal közötti mennyiséget biztosít, makroelem-tartalommal, amely csak a víz éhezését utánozza, de a táp maximalizálását célzó mikroelem-tartalommal. 19 alanyot randomizáltak havi FMD 3 ciklusának alávetésére, míg további 19 alanyot randomizáltak kontroll étrendre. 3 FMD ciklus után az étrend által okozott átlagos jelentett mellékhatás nagyon alacsony volt, és „enyhe” alatt volt (3. ábra). A cirkadián óra komponensei több ezer gén transzkripciós szabályozó régióihoz kötődnek, és ritmikus transzkripciójukat jórészt szövetspecifikus módon vezérlik (Koike et al., 2012; Vollmers et al., 2012). Az mTOR és az AMPK útvonalak modulálják a downstream fehérjék aktivitását is, beleértve a CREB, PPAR, FOXO, Hsf1, HNF és PGC1 transzkripciószabályozókat (Inoki és mtsai, 2011). A legtöbb gén szabályozó régióit azonban több transzkripciós faktor is megcélozza (Hager et al., 2009). Ennek megfelelően sok, cirkadián módon szabályozott átiratra, amelyek az órakomponensek downstream célpontjai, azokat a transzkripciós szabályozók is megcélozzák, amelyek tevékenységét táplálás és koplalás modulálja (Bugge et al., 2012; Feng et al., 2011; Koike et al., 2012; Vollmers et al., 2009). Az ilyen konvergens szabályozás a cirkadián órával és az etetési/éhomi érzékelőkkel adaptív előnyöket kínál a szervezet számára.
Ételbevitel hiányában az önfenntartó cirkadián oszcillátor egy maroknyi transzkripció kezdetleges oszcillációját hajtja a májban (3. ábra), ezáltal előre látó mozgást kínál az etetéshez vagy az éhezéshez. A napi etetési/éhezési ritmusok olyan jelátviteli utakat hajtanak végre, amelyek kölcsönhatásba lépnek a cirkadián oszcillátorral, hogy növeljék ezen transzkripciós oszcillációk robusztusságát vagy csúcs-mélység közötti különbségeit. Ezek az átiratok ezután anabolikus és katabolikus folyamatokat közvetítenek, amelyek megfelelnek az etetési/koplalási ciklus meghatározott szakaszainak. Funkcionális cirkadián óra hiányában az etetés és az éhezés által vezérelt utak bizonyos rezgéseket mozgathatnak a transzkripcióban (Vollmers et al., 2009), a downstream metabolitokban (Adamovich et al., 2014), sőt a bél mikrobiotájában is (Thaiss et et. al., 2014), de ezek a jelek nem tudják teljes mértékben kompenzálni a cirkadián óra veszteségét. Ezért a cirkadián oszcillátor és az etetési/éhomi jelek közötti szinergikus kölcsönhatások biztosítják, hogy az anyagcsere anabolikus és katabolikus típusai koordináltan, az állat aktivitási/pihenési ciklusával összhangban legyenek szabályozva.
A cirkadián rendellenesség epidemiológiája
Végül a kor az endogén cirkadián óra csillapításának kockázata is. Az idősebb egyének fibroblasztjainak nedvesített cirkadián órája van, és ennek a csillapításnak egy részét szérumfaktorok közvetítik (Pagani et al., 2011). A megnövekedett emberi élettartam mellett a cirkadián óra időskori csillapítása a krónikus cirkadián zavarok kockázatává válik.
A műszakos munka metabolikus betegségekre gyakorolt ok-okozati hatását kontrollált laboratóriumi körülmények között egyre inkább tesztelik állatokban és emberekben. Az éjszakai műszakban végzett szimulált munka csökkentette az emberi önkéntesek napi energiafelhasználását (2010-ig)
12–16%) és az étkezésekre adott válaszként (McHill et al., 2014). Ez a leptin és az YY jóllakottsági hormonok csökkent szintjével járt. Azoknál az egyéneknél, akiket 10 napig cirkadián elmozdulásnak vetnek alá, emelkedik az étkezés utáni glükóz, emelkedett inzulin (inzulinrezisztencia) és megnő az átlagos artériás nyomás (Scheer és mtsai, 2009).
Klinikai alkalmazások
A TRF előnyei rágcsálókban és Drosophilában. A rágcsálóknál éjszaka 8–12 órás, a Drosophila esetében pedig 12 órás TRF pleiotróp előnyöket eredményez, amelyek több szervrendszert is magukban foglalnak. A TRF által nyújtott előnyök és a változás iránya a hasonló obesogén vagy magas cukortartalmú étrend ad lib táplálásához viszonyítva.
Az emberek TRF protokoll elfogadásának megvalósíthatósága némi ígéretet mutatott. Ugyanez a tanulmány (Gill és Panda, 2015) azt tesztelte, hogy a napi étkezési időtartam megváltoztatása azáltal, hogy lehetővé teszi a résztvevők számára a napi kalóriabevitel elfogyasztását egy önállóan kiválasztott 10–11 órás időszak alatt, egészségügyi előnyökkel jár-e a túlsúlyos személyek számára. Nyolc túlsúlyos résztvevő megette a teljes napi kalóriabevitelt az önállóan kiválasztott 10–11 órás ablakon belül. Felük számára az étkezési ablak este 8-kor ért véget, hogy együtt vacsorázhassanak a családdal. Azokkal a rágcsálókkal ellentétben azonban, akik ugyanannyi kalóriát fogyasztanak, ha 8-15 órás TRF-t alkalmaznak, az étkezési idő csökkentése az embereknél a napi kalóriabevitelt is akár 20% -kal is csökkentette (ennek a csökkenésnek egy része a késő esti alkohol és harapnivalók csökkenéséből származott) ). 16 hét alatt legfeljebb 4% testsúlyt vesztettek, és ezt a fogyást legfeljebb 1 évig megtartották. Beszámoltak az éjszakai alvásjavulásról és a nappal fokozott éberségről is.
További tanulmányok azt is sugallják, hogy a TRF potenciális előnyökkel jár az emberi egészség szempontjából. Egy retrospektív vizsgálatban, amely az éjszakai éhgyomor és az emlőrák előfordulási gyakoriságának önjelölt időtartamát vizsgálta, az ≥13 órás, elhúzódó éjszakai éhgyomri korreláció csökkent a mellrák kockázatának csökkenésével (Marinac et al., 2015a; Marinac et al., 2015b). Míg ezek a jelentések a TRF megvalósíthatóságát mutatják be, mint beavatkozást vagy a TRF mint életstílus önkéntes elfogadását, a TRF mind a krónikus betegségek megelőzésére, mind előrejelzésére gyakorolt hatására koncentráltabb vizsgálatok szükségesek. Az amerikai felnőttek közel 50% -ának van olyan krónikus betegsége, amely miatt gyógyszert vagy kiegészítést szed. A cirkadián transzkriptóm és proteom vizsgálatok több olyan fehérjét azonosítottak, amelyek a célpontok, vagy amelyek a gyógyszerek abszorpciójára és clearance-ére szintén cirkadián moduláció alatt állnak (Neufeld-Cohen és mtsai, 2016; Robles és mtsai, 2014; Zhang és mtsai, 2014) . Mivel az étkezési szokás határozza meg a perifériás szervek cirkadián ritmusának fázisait, a gyógyszerek időzítése az étkezés idejéhez viszonyítva valószínűleg befolyásolja a prognózist.
Életkor-specifikus táplálkozás
Következtetések
- A testtömeg változásának eltérő reakciója a Ketonuria szerint az egészséges elhízásban koplalás után
- Zöld tea A legjobb idő egészséges italok fogyasztására a gyors fogyás érdekében
- Igyon vizet a megfelelő időben, hogy egészséges maradjon
- A tinédzser egészséges táplálkozása a tizenévesek számára
- Túladagolhatja a zöld tea kivonat egészséges táplálkozás SF kaput